Répétition armadillo
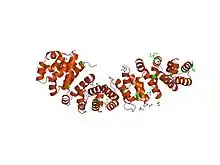
Une répétition armadillo est un type de structure rencontré dans de nombreuses protéines et constitué d'une quarantaine de résidus d'acides aminés organisés en une séquence répétitive. Le terme armadillo, qui signifie « tatou » en anglais, dérive historiquement du nom du gène de la β-caténine chez la drosophile, où il a été découvert. Les protéines qui contiennent une répétition armadillo en contiennent généralement plusieurs exemplaires en tandem[1],[2]. Dans la β-caténine, les douze répétitions armadillo forment une superhélice constituée de trois hélices α par unité[3]. La structure cylindrique présente un sillon chargé positivement dont on pense qu'il interagit avec les surfaces acides des molécules interagissant avec la β-caténine. D'une manière générale, chaque répétition armadillo comprend une paire d'hélices α formant une structure en épingle à cheveux. Plusieurs copies de cette répétition forment une structure appelée solénoïde α.
| Pfam | PF00514 |
|---|---|
| Clan Pfam | CL0020 |
| InterPro | IPR000225 |
| SMART | SM00185 |
| PROSITE | PS50176 |
| SCOP | 3bct |
| SUPERFAMILY | 3bct |
| CDD | cd00020 |
La β-caténine, où cette structure a été identifiée pour la première fois, intervient dans la liaison des cadhérines, protéines assurant l'adhérence cellulaire, au cytosquelette ; les répétitions armadillo peuvent cependant se trouver dans des protéines ayant d'autres fonctions. Ce type de protéines joue un rôle important dans la transduction de signal par protéines Wnt lors de l'embryogenèse. Outre la β-caténine, on compte ainsi, parmi les protéines qui présentent une répétition armadillo, l'importine α[4], la plakoglobine[5], la protéine APC[6] et de nombreuses autres.
Notes et références
- (en) Matthew R. Groves et David Barford, « Topological characteristics of helical repeat protein », Current Opinion in Structural Biology, vol. 9, no 3, , p. 383-389 (PMID 10361086, DOI 10.1016/S0959-440X(99)80052-9, lire en ligne)
- (en) Mark Peifer, Sven Berg et Albert B. Reynolds, « A repeating amino acid motif shared by proteins with diverse cellular roles », Cell, vol. 76, no 5, , p. 789-791 (PMID 7907279, DOI 10.1016/0092-8674(94)90353-0, lire en ligne)
- (en) Andrew H. Huber, W.James Nelson et William I. Weis, « Three-Dimensional Structure of the Armadillo Repeat Region of β-Catenin », Cell, vol. 90, no 5, septembre, p. 1997 (PMID 9298899, DOI 10.1016/S0092-8674(00)80352-9, lire en ligne)
- (en) Andrea Herold, Ray Truant, Heather Wiegand et Bryan R. Cullen, « Determination of the Functional Domain Organization of the Importin α Nuclear Import Factor », Journal of Cell Biology, vol. 143, no 2, , p. 309-318 (PMID 9786944, PMCID 2132842, DOI 10.1083/jcb.143.2.309, lire en ligne)
- (en) P. D. McCrea, C. W. Turck et B. Gumbiner, « A homolog of the armadillo protein in Drosophila (plakoglobin) associated with E-cadherin », Science, vol. 254, no 5036, , p. 1359-1361 (PMID 1962194, DOI 10.1126/science.1962194, lire en ligne)
- (en) Daniela Hirschl, Peter Bayer et Oliver Müller, « Secondary structure of an armadillo single repeat from the APC protein », FEBS Letters, vol. 383, nos 1-2, , p. 31-36 (PMID 8612785, DOI 10.1016/0014-5793(96)00215-3, lire en ligne)
- Portail de la biochimie