Ranélate de strontium
Le ranélate de strontium est un sel de strontium de l'acide ranélique. Il constitue le composant d'un médicament pour l'ostéoporose commercialisé sous le nom de Protelos, Protos, Bivalos, Protaxos ou Osseor par les laboratoires Servier. Ce médicament est indiqué chez la femme ménopausée et chez l’homme ; en 2014, son indication a été restreinte aux patients ayant une ostéoporose sévère, ne pouvant pas être pris en charge avec d’autres traitements. Ce médicament est retiré du marché par le fabricant le 30 aout 2017. Il était déremboursé depuis .
| Ranélate de strontium | ||
| ||
 | ||
| Ranélate de strontium | ||
| Identification | ||
|---|---|---|
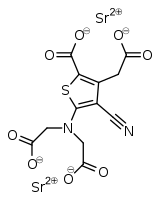
| Nom UICPA | 5-[bis(2-oxido-2-oxoéthyl)amino]-4-cyano-3-(2-oxido-2-oxoéthyl)thiophène-2-carboxylate de distrontium | |
| Synonymes |
5-[bis(carboxyméthyl)amino]-2-carboxy-4-cyanthiophén-3-acétate de distrontium |
|
| No CAS | ||
| No ECHA | 100.218.275 | |
| Code ATC | M05 | |
| PubChem | 6918182 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C12H6N2O8SSr2 |
|
| Masse molaire[1] | 513,49 ± 0,04 g/mol C 28,07 %, H 1,18 %, N 5,46 %, O 24,93 %, S 6,24 %, Sr 34,13 %, 513,491 g/mol |
|
| Données pharmacocinétiques | ||
| Biodisponibilité | 25% (écart 19–27%) | |
| Liaison protéique | 25% pour les protéines plasmatiques et affinité élevée pour le tissue osseux | |
| Métabolisme | En tant que cation divalent, le strontium n'est pas métabolisé. N'inhibe pas les enzymes du type cytochrome P450 | |
| Demi-vie d’élim. | 60 heures | |
| Excrétion |
rénale et gastro-intestinale |
|
| Considérations thérapeutiques | ||
| Classe thérapeutique | anti-ostéoporotique | |
| Voie d’administration | orale | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Mode d'action
Il a été montré in vivo que le ranélate de strontium augmente la formation d’os par les ostéoblastes, tout en réduisant la résorption osseuse par les ostéoclastes. La balance net de ces effets est la production d’os dans les modèles animaux d’ostéoporose[Note 1]. Ces effets sont corrélés par les observations faites in vitro montrant que le ranélate de strontium :
- augmente la formation osseuse et la réplication des précurseurs ostéoblastiques et la synthèse de collagène dans les cultures de cellules osseuses[2] ;
- diminue la différenciation des ostéoclastes et leur activité de résorption osseuse[3].
Enfin, les études cliniques réalisées chez des femmes ostéoporotiques ont montré que le ranélate de strontium avaient effectivement des propriétés sur l’architecture osseuse :
- augmentation de la formation osseuse au niveau de l’os cortical et trabéculaire[4],[5]
- amélioration de la résistance osseuse[4],[5]
- augmentation de la densité minérale osseuse[6], laquelle est prédictive de son efficacité thérapeutique, et de la diminution du risque de fractures[7],[8].
Le ranélate de strontium aide donc la croissance des os, améliore leur architecture, augmente la densité osseuse et réduit les fractures vertébrales[6], les fractures périphériques et les fractures de hanche[9].
Indications thérapeutiques
Le ranélate de strontium a été enregistré en 2004 dans les pays de l’union européenne. Dans les années qui ont suivi, l’enregistrement de cette molécule s’est poursuivi pour atteindre finalement plus d’une centaine de pays ayant le ranélate de strontium disponible sur leur marché. En revanche, Servier n’a pas cherché à obtenir d’autorisation de mise sur le marché aux États-Unis[10].
Depuis son lancement, le ranélate de strontium a fait l’objet d’évaluations successives du rapport bénéfice/risque. À la suite de nouvelles données concernant la survenue d’effets indésirables au niveau cardiaque, l’agence européenne du médicament décide le de restreindre l’indication du ranélate de strontium. Si l’efficacité de cette molécule pour réduire le risque de fractures vertébrales et de hanches chez la femme ménopausée est toujours validée par l’agence européenne du médicament, le ranélate de strontium est désormais indiqué :
- dans le traitement de l’ostéoporose sévère,
- chez la femme ménopausée et chez l’homme adulte à risque élevé de fractures,
- qui ne peuvent pas bénéficier d’autres traitements anti-ostéoporotiques, notamment pour des raisons de tolérance ou de contre-indication.
Une évaluation des risques (principalement cardiaques et ceux liés aux événements thrombo-emboliques veineux) doit être réalisée chez les patients, avant toute décision de prescrire le ranélate de strontium[11].
Efficacité
Deux grandes études cliniques de phase III, SOTI (en anglais : Spinal Osteoporosis Therapeutic Intervention) et TROPOS (en anglais : Treatment of Peripheral Osteoporosis), ont été publiées respectivement en 2004 et 2005 pour étudier l'efficacité du ranélate de strontium dans la réduction des fractures vertébrales d’une part, et périphériques, y compris les fractures de hanche d’autre part et la sécurité d'emploi.
L’efficacité du ranélate de strontium (2 g/jour) pour réduire le risque fracturaire a été démontrée après 3 ans de traitement, la durée réglementaire demandée par les agences pour la démonstration d’un traitement anti-ostéoporotique :
- Dans l’étude SOTI conduite chez 1 649 patientes, le ranélate de strontium réduit le risque de fractures vertébrales de 41 % après 3 ans de traitement[12].
- Dans l'étude TROPOS initiale (3 ans de traitement) qui incluait 2 714 patientes, a réduction du risque de fracture périphérique a été de 16 %[13].
- Dans un sous-groupe de l’étude TROPOS constituée de patientes âgées de plus de 74 ans, avec un T-score fémoral inférieur à -2.4SD, le risque de fracture de hanche est diminué de 36 %.
Le traitement d’une maladie chronique tel que l’ostéoporose impose de vérifier que le traitement est efficace sur le long terme. Dans ce contexte, l’efficacité du ranélate de strontium a été étudié dans des études d’extension des essais initiaux de SOTI et TROPOS, mettant en évidence :
Une diminution du risque relatif des fractures périphériques sur 5 ans de 15%[14].
- Un maintien de l’efficacité à 10 ans dans une étude ouverte[15].
- À 5 ans, une diminution du risque relatif de fractures de hanche de 43 % chez les patientes ostéoporotiques de plus de 74 ans[16].
Enfin, l’efficacité du traitement par ranélate de strontium a été établie indépendamment des facteurs de risque[17] et de la sévérité de la maladie définie selon le nombre de fractures vertébrales à l’initiation du traitement[18].
Le ranélate de strontium a par ailleurs fait l’objet d’autres développements cliniques en parallèle :
Ostéoporose masculine (étude MALEO)
Après 1 ans de traitement, le ranélate de strontium augmente la densité minérale osseuse d’hommes ostéoporotiques :
- au niveau vertébral de 8,2 % (vs. 1,9 % dans le groupe placebo)
- au niveau fémoral de 3,5 % (vs. 0,4 % dans le groupe placebo).
Ces résultats, similaires à ceux observés chez la femme ostéoporotique, laisse présager une efficacité anti-fracturaire comparable, raison pour laquelle l’agence européenne décida d’étendre l’indication du ranélate de strontium au traitement de l’ostéoporose masculine le [19].
Ostéoporose de la personne âgée
Plusieurs études ont permis d’évaluer l’efficacité et la sécurité d’emploi du ranélate de strontium chez la personne âgée de 80 ans et plus. Ainsi, le ranélate de strontium diminue le risque de fracture vertébrale de 32 % après 3 ans de traitement (incidence dans le groupe ranélate de strontium 19,1 % vs. 26,5 % dans le groupe placebo) et de fractures non vertébrales de 31 % (incidence dans le groupe ranélate de strontium 14,2 % vs. 19,7 % dans le groupe placebo,)[20]. Après 5 ans de traitement, un effet similaire était observé aux deux sites avec une diminution du risque de fracture vertébrale de 31 %, et celui de fractures non-vertébrales de 27%[21].
Arthrose (étude SEKOIA)
Le mode d’action du ranélate de strontium sur le remodelage osseux pouvait laisser supposer un effet positif sur la structure de l’os sous-chondral et du cartilage des patients souffrant d’arthrose. Pour vérifier cette hypothèse, des patients arthrosiques ont été traités pendant 3 ans avec du ranélate de strontium (566 patients à 2 g/jour, 558 patients à 1 g/jour, 559 patients sous placebo). À l’issue de l’étude, les patients arthrosiques traités par le ranélate de strontium ont vu ralentir la dégradation de leur articulation du genou par rapport au groupe traité par placebo (pincement articulaire de −0,23 mm à 1 g/jour, −0,27 mm à 2 g/jour, −0,37 mm avec le placebo). Cet effet était corrélé avec une diminution de la douleur à la dose de 2 g/jour.
Effets indésirables
Les principaux effets indésirables du ranélate de strontium sont :
- Le risque thrombo-embolique veineux. Celui-ci a été identifié dans les études cliniques SOTI et TROPOS et spécifié dès l’enregistrement initial du produit en 2004 ;
- Le risque cutané. De faible fréquence, ce risque a été identifié après la mise sur le marché du médicament, une fois que des populations relativement importantes aient commencé à être traitées ;
- Le risque cardio-vasculaire, mis en évidence à partir des études cliniques mises en place par les laboratoires Servier. L’analyse globale de toutes les populations des essais cliniques (SOTI, TROPOS, SEKOIA, MALEO, ainsi que les études secondaires) a révélé un sur-risque d’infarctus du myocarde dans une catégorie de patients à risque.
Risques thrombo-emboliques
Le risque thrombo-embolique a été identifié dès la fin du développement du médicament. Les études mises en place pour analyser à grande échelle cet effet n’ont pas permis de confirmer qu’en pratique médicale courante, les patients traités par le ranélate de strontium avaient une augmentation du risque de thrombose veineuse[22].
Toutefois, au vu des résultats des études cliniques et des rapports de pharmacovigilance, l’agence européenne a décidé de restreindre la prescription aux patients ne présentant pas de risque accru de thrombo-embolie veineuse, principalement les patients ayant des antécédents de cette pathologie. La prudence est donc de rigueur chez les patients à risque accru de thrombo-embolie veineuse, surtout les patients ayant des antécédents de cette pathologie.
Risques cutanés
Dans les études cliniques impliquant au total plus de 8 000 patients, les effets indésirables cutanés rapportés le plus communément ont été l’eczéma et les dermatites. Après la mise à disposition du médicament, le suivi des effets indésirables a montré une augmentation du risque de survenue de réaction d’hypersensibilité cutanée sévère (rare, supérieur à 1 patient sur 10 000 et inférieur à 1 patient sur 1 000), de syndrome de Stevens-Johnson (très rare, inférieur à 1 patients sur 10 000 patients)[23] et de syndrome de Lyell (très rare, inférieur à 1 patient sur 10 000)[24],[25], principalement à l’initiation du traitement.
Ces effets, rares, mais bien établis, imposent l’arrêt immédiat et définitif du traitement en cas de survenue (généralement dans les 3 mois après l’initiation).
Risques cardio-vasculaires
Le , le Comité de pharmacovigilance et d'évaluation des risques (PRAC) de l'Agence européenne du médicament (EMA) recommande une restriction de prescription du ranélate de strontium chez les patientes ayant eu des antécédents de maladie cardiaque ischémique (angine de poitrine, infarctus du myocarde), artérite des membres inférieurs, AVC, HTA[26] et chez les patientes ayant une hypertension non-contrôlée. Cette recommandation a été adoptée par le CHMP le [27].
En , le PRAC entame alors une revue complète du rapport bénéfice/risque du ranélate de strontium[28] qui recommandera la suspension du produit le . Un mois plus tard, le , le Comité des produits de santé à usage humain (CHMP) de l’EMA estimera que le médicament a encore une utilité thérapeutique pour les patients ostéoporotiques qui ne peuvent être traitées par d’autres médicaments et maintiendra le médicament sur le marché[29].
Les précautions d’emploi seront renforcées à cette occasion pour minimiser le risque cardio-vasculaire.
Patients insuffisants rénaux sévères
Le traitement de patients insuffisants rénaux sévères (clairance à la créatinine inférieure à 30 ml/min) n’est pas recommandée, la sécurité d’emploi chez ces patients n’étant pas suffisamment documentée.
Fréquents (entre 1 patient sur 10 et 1 patient sur 100)
- Hypercholestérolémie
- Insomnie
- Troubles du système nerveux central tels que maux de tête, troubles de la conscience, trouble de la mémoire, étourdissement, paresthésie, vertige
- Infarctus du myocarde
- Événements veineux thromboemboliques
- Hyperréactivité bronchique
- Nausées, vomissement, douleurs abdominales, douleurs gastro-intestinales, constipation, flatulence, diarrhées et pertes fécales
- Reflux gastro-œsophagien
- Dyspepsie
- Hépatite
- Eczéma
- Œdème périphérique
En France, de 2006 à 2009, 5 cas d'hépatite et 2 cas de pancréatite ont été rapportés soit au fabricant soit à un centre régional de pharmacovigilance[30].
Peu fréquents (entre 1 patient sur 100 et 1 patient sur 1000)
- Lymphadénopathie
- État confusionnel
- Convulsions
- Irritation des muqueuses buccales
- Bouche sèche
- Augmentation des transaminases sériques
- Dermatite
- Alopécie
- Pyrexie
- Malaise
Rares (entre 1 patient sur 1000 et 1 patient sur 10000)
En France, de 2006 à 2009, 5 cas de pancytopénie, 1 cas d'érythroblastopénie et 1 cas de purpura thrombocytopénique ont été rapportés[30].
Notes et références
Notes
- La couche de valence du strontium est semblable à celle du calcium : l'organisme absorbe facilement le strontium qui va prendre la place du calcium dans les os et l'émail des dents.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Marie PJ, « Strontium ranelate: a novel mode of action optimizing bone formation and resorption », Osteoporosis international, vol. 16, no supplément 1, , S7-S10 (PMID 15578159, lire en ligne, consulté le )
- (en) Gentleman E, Fredholm YC, Jell G, Lotfibakhshaiesh N, O'Donnell MD, Hill RG, Stevens MM, « The effects of strontium-substituted bioactive glasses on osteoblasts and osteoclasts in vitro », Biomaterials, vol. 31, no 14, , p. 3949-3956 (PMID 20170952, lire en ligne, consulté le )
- R Rizzoli et al. Osteoporos Int (2012) 23:305–315
- Arlot J Bone Miner Res 2008;23:215–222
- (en) Meunier P. J., Roux C., Seeman E. et al., « effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis », New England Journal of Medicine, vol. 350, no 5, , p. 459–468 (ISSN 0028-4793, PMID 14749454, DOI 10.1056/NEJMoa022436)
- Bruyère Journal of Clinical Endocrinology & Metabolism 92(8):3076–3081
- Bruyère Current Medical Research and Opinion ; Vol. 23, No. 12, 2007, 3041–3045
- (en) Reginster JY, Seeman E, De Vernejoul MC et al., « Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study », The Journal of clinical endocrinology and metabolism, vol. 90, no 5, , p. 2816–2822 (ISSN 0021-972X, PMID 15728210, DOI 10.1210/jc.2004-1774, lire en ligne)
- (en)Import Refusal Report sur le site de la FDA
- (en) « Protelos - European Medicines Agency », sur European Medicines Agency, (consulté le ).
- (en) Meunier PJ, Roux C, Ortolani S, Diaz-Curiel M, Compston J, Marquis P, Cormier C, Isaia G, Badurski J, Wark JD, Collette J, Reginster JY, « Effects of long-term strontium ranelate treatment on vertebral fracture risk in postmenopausal women with osteoporosis », Osteoporosis international, vol. 20, no 10, , p. 1663-1673 (PMID 19153678, lire en ligne, consulté le )
- (en) Reginster JY, Felsenberg D, Boonen S, Diez-Perez A, Rizzoli R, Brandi ML, Spector TD, Brixen K, Goemaere S, Cormier C, Balogh A, Delmas PD, Meunier PJ, « Effects of long-term strontium ranelate treatment on the risk of nonvertebral and vertebral fractures in postmenopausal osteoporosis: Results of a five-year, randomized, placebo-controlled trial », Arthritis and rheumatism, vol. 58, no 6, , p. 1687-1695 (PMID 18512789, lire en ligne, consulté le )
- Reginster Arthritis Rheum Vol. 58, No. 6, June 2008, p. 1687–1695
- Reginster Osteoporos Int (2012) 23:1115–1122
- Reginster JY, et al. Arthritis Rheum. 2008;58(6):1687-1695
- Seeman E, et al. J Bone Miner Res. 2006;21(7):1113-1120
- Seeman E, et al. Bone. 2010;46(4):1038-1042
- (en) Osborne V, Layton D, Perrio M, Wilton L, Shakir SA, « Incidence of venous thromboembolism in users of strontium ranelate: an analysis of data from a prescription-event monitoring study in England », Drug safety, vol. 33, no 7, , p. 579-591 (PMID 20553059, lire en ligne, consulté le )
- (en) K.W. Tan et Y.S. Wang, « Stevens-Johnson syndrome due to strontium ranelate », Annals of the Academy of Medicine, Singapore, Singapour, Academy Of Medicine, Singapore, vol. 40, no 11, , p. 510-511 (ISSN 0304-4602 et 0304-4602, PMID 22206068, lire en ligne [PDF])
- http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000560/WC500045525.pdf
- (en) Philippe Musette et al., « Cutaneous Side Effects of Antiosteoporosis Treatments », Therapeutic Advances in Musculoskeletal Disease, vol. 3, no 1, , p. 31-41 (DOI 10.1177/1759720X10387202, lire en ligne [html])
- (en)[PDF]PRAC recommendation 2013
- http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2013/04/WC500142507.pdf
- Elisabeth Autret-Leca, « [Adverse drug reactions of strontium ranelate(Protelos(®) in France] - PubMed », Presse medicale (Paris, France : 1983), vol. 40, no 10, , e453–e462 (ISSN 2213-0276, PMID 21885232, DOI 10.1016/j.lpm.2011.07.010, lire en ligne, consulté le ).
Voir aussi
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie