Sérine/thréonine protéine kinase
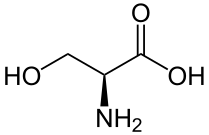
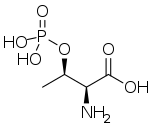
Une sérine/thréonine protéine kinase est une protéine kinase qui catalyse la phosphorylation de protéines sur certains de leurs résidus de sérine ou de thréonine, dont la chaîne latérale est semblable, pour former des résidus de O-phosphosérine ou de O-phosphothréonine respectivement.
Au moins 125 des plus de 500 protéine kinases humaines connues sont des sérine/thréonine kinases (STK). Ce type de phosphorylation intervient dans de très nombreux processus cellulaires et constitue une modification post-traductionnelle très importante[1],[2],[3],[4],[5],[6],[7].
L'expression des sérine/thréonine protéine kinases est modifiée dans de nombreux types de cancers. Des inhibiteurs de STK ont montré un bénéfice limité dans le traitement du cancer de l'ovaire[8]. La kinase s6 ribosomique (en) (RSK) est impliquée dans le développement de certains cancers de la prostate.
Notes et références
- (en) Zahi Damuni etLester J. Reed, « Purification and properties of a protamine kinase and a type II casein kinase from bovine kidney mitochondria », Archives of Biochemistry and Biophysics, vol. 262, no 2, , p. 574-584 (PMID 2835010, DOI 10.1016/0003-9861(88)90408-0, lire en ligne)
- (en) B. Baggio, L. A. Pinna, V. Moret et N. Siliprandi, « A simple procedure for the purification of rat liver phosvitin kinase », Biochimica et Biophysica Acta (BBA) - Enzymology, vol. 212, no 3, , p. 515-517 (PMID 5456997, DOI 10.1016/0005-2744(70)90261-5, lire en ligne)
- (en) Bengt Jergil et Gordon H. Dixon, « Protamine kinase from rainbow trout testis. Partial purification and characterization », Journal of Biological Chemistry, vol. 245, no 2, , p. 425-434 (PMID 4312674, lire en ligne)
- (en) Thomas A. Langan, « Action of Adenosine 3',5'-Monophosphate-dependent Histone Kinase in Vivo », Journal of Biological Chemistry, vol. 244, no 20, , p. 5763-5765 (PMID 4310608, lire en ligne)
- (en) M. Takeuchi et M. Yanagida, « A mitotic role for a novel fission yeast protein kinase dsk1 with cell cycle stage dependent phosphorylation and localization », Molecular Biology of the Cell, vol. 4, no 3, , p. 247-260 (PMID 8485317, PMCID 300923, DOI 10.1091/mbc.4.3.247, lire en ligne)
- (en) Thomas Groβ, Martin Lutzelberger, Holger Wiegmann, Andreas Klingenhoff, Suresh Shenoy et Norbert F. Käufer, « Functional Analysis of the Fission Yeast Prp4 Protein Kinase Involved in Pre-Mrna Splicing and Isolation of a Putative Mammalian Homologue », Nucleic Acids Research, vol. 25, no 5, , p. 1028-1035 (PMID 9102632, PMCID 146536, DOI 10.1093/nar/25.5.1028, lire en ligne)
- (en) Ying Wang, Thomas G. Hofmann, Laura Runkel, Thomas Haaf, Heinz Schaller, Klaus-Michael Debatin et Hubert Hug, « Isolation and characterization of cDNAs for the protein kinase HIPK2 », Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, vol. 1518, nos 1-2, , p. 168-172 (PMID 11267674, DOI 10.1016/S0167-4781(00)00308-0, lire en ligne)
- (en) Marcia A. Ciccone, Asaf Maoz, Jennifer K. Casabar, Hiroko Machida, Seiji Mabuchi, Koji Matsuo, « Clinical Outcome of Treatment With Serine-Threonine Kinase Inhibitors in Recurrent Epithelial Ovarian Cancer: A Systematic Review of Literature », Expert Opinion on Investigational Drugs, vol. 25, no 7, , p. 781-796 (PMID 27101098, DOI 10.1080/13543784.2016.1181748, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire