Sorafénib
Le sorafénib est un anticancéreux (co-développé et commercialisé par Bayer et par Onyx Pharmaceuticals (en) sous le nom de Nexavar). En France, on l'utilise pour le traitement du carcinome hépatocellulaire (un cancer du foie primitif) et du cancer du rein métastatique.
| Sorafénib | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.110.083 |
| Code ATC | L01 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
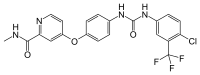
| Formule | C21H16ClF3N4O3 [Isomères] |
| Masse molaire[1] | 464,825 ± 0,022 g/mol C 54,26 %, H 3,47 %, Cl 7,63 %, F 12,26 %, N 12,05 %, O 10,33 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Mode d'action
Le sorafénib inhibe une tyrosine kinase, et plus particulièrement le récepteur au VEGF (en anglais : vascular endothelial growth factor)[2]. Il inhibe également le Raf-1 ainsi que le RET kinase[3].
Utilisation
Dans les cancers rénaux résistant aux autres traitements, le sorafénib prolonge la survie[4],[5].
Dans les cancers hépatiques avancés, il prolonge la survie de près de trois mois[6].
Il est testé avec un certain succès dans les cancers de la thyroïde résistant à l'iode radioactif[7], ainsi que dans les formes évoluées des tumeurs desmoïdes[8].
L'association atezolizumab bevacizumab est plus efficace et mieux toléré que sorafenib [9].
Législation
NEXAVAR se présente comme des comprimés dosés à 200 mg commercialisés par Bayer. Ce médicament a obtenu une AMM centralisée de l'agence européenne du médicament [10] le . Il est soumis à une prescription restreinte réservée aux services de cancérologie, hématologie et oncologie médicale. Il est disponible depuis le [11]. La boîte de 112 comprimés est vendue en officine au prix de 2 998,42 euros TTC au 01/01/2020. L'assurance-maladie la rembourse à 100 %[12].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Wilhelm SM, Carter C, Tang L et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis Cancer Res. 2004;64:7099–7109
- (en) Carlomagno F, Anaganti S, Guida T et al. BAY 43-9006 inhibition of oncogenic RET mutants J Natl Cancer Inst. 2006;98:326–334
- (en) Escudier B, Eisen T, Stadler WM et al. « Sorafenib in advanced clear-cell renal-cell carcinoma » N Engl J Med. 2007;356:125–134
- (en) Escudier B, Eisen T, Stadler WM et al. « Sorafenib for treatment of renal cell carcinoma: final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial » J Clin Oncol. 2009;27:3312–3318
- (en) Llovet JM, Ricci S, Mazzaferro V et al. « Sorafenib in advanced hepatocellular carcinoma » N Engl J Med. 2008;359:378–390.
- (en) Brose MS, Mutting CM, Jarzab B et al. « Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial » Lancet. 2014;384:319-328.
- Gounder MM, Mahoney MR, Van Tine BA et al. Sorafenib for advanced and refractory desmoid tumors, N Engl J Med 2018;379:2417-2428
- Atezolizumab plus Bevacizumab — A Landmark in Liver Cancer N Engl J Med 2020; 382:1953-1955 DOI: 10.1056/NEJMe2004851 https://www.nejm.org/doi/full/10.1056/NEJMe2004851?query=TOC
- « Nexavar - European Medicines Agency », sur European Medicines Agency, (consulté le ).
- ANSM http://agence-prd.ansm.sante.fr/php/ecodex/extrait.php?specid=64463662
- Arrêté JORF du 10/11/2015.
- Portail de la chimie
- Portail de la pharmacie