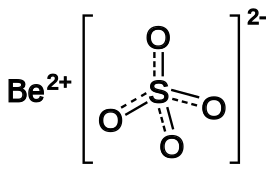
Sulfate de béryllium
Le sulfate de béryllium le plus souvent rencontré sous forme de tétrahydrate, [Be(H2O)4 ]SO4 est un solide cristallin blanc. Il a été isolé pour la première fois en 1815 par Jons Jakob Berzelius. Le sulfate de béryllium peut être préparé en traitant une solution aqueuse de nombreux sels de béryllium avec de l'acide sulfurique, suivi de l'évaporation de la solution et de la cristallisation. Le produit hydraté peut être converti en sel anhydre par chauffage à 400 °C.
| Sulfate de béryllium | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| No CAS | 13510-49-1
7787-56-6 (tetrahydrate) |
|
| No ECHA | 100.033.348 | |
| No RTECS | DS4800000 | |
| PubChem | ||
| ChEBI | CHEBI:53473 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | BeSO4 | |
| Masse molaire | 105.075 g/mol (anhydre)
177.136 g/mol (tetrahydraté) |
|
| Propriétés physiques | ||
| T° fusion | 110 °C (230 °F; 383 K) (tetrahydraté, −2H2O)
400 °C (dihydraté, déhydr.) 550–600 décomposés |
|
| T° ébullition | 2,500 °C (4,530 °F; 2,770 K) (anhydraté)
580 °C (tetrahydraté) |
|
| Solubilité | 36.2 g/100 mL (0 °C)
40.0 g/100 mL (20 °C) 54.3 g/100 mL (60 °C) insoluble in alcohol |
|
| Masse volumique | 2.44 g/cm3 (anhydre)
1.71 g/cm3 (tetrahydraté) |
|
| Thermochimie | ||
| S0solide | 90 J/mol K | |
| ΔfH0solide | -1197 | |
| Propriétés optiques | ||
| Indice de réfraction | 1.4374 (tetrahydrate) | |
| Précautions | ||
| SGH | ||
| H301, H315, H317, H319, H330, H335, H350, H372, H411 | ||
| Écotoxicologie | ||
| DL50 | 82 mg/kg (rat, oral)
80 mg/kg (mouse, oral)[ |
|
| AOEL | PEL (Permissible) TWA 0.002 mg/m3
C 0.005 mg/m3 (30 minutes), with a maximum peak of 0.025 mg/m3 (as Be) REL (Recommended) Ca C 0.0005 mg/m3 (as Be) IDLH (Immediate danger) Ca [4 mg/m3 (as Be)] Safety data sheet (SDS) ICSC 1351 |
|
| Seuil de l’odorat | sans odeur | |
| Composés apparentés | ||
| Autres cations | Magnesium sulfate
Calcium sulfate Strontium sulfate Barium sulfate |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Structure
Concernant la cristallographie aux rayons X, le tétrahydrate contient une unité Be(OH2)42+ tétraédrique et des anion sulfate. La petite taille du cation Be 2+ détermine le nombre de molécules d'eau qui peuvent être coordonnées. [1] En revanche, le sel de magnésium analogue, MgSO4.6H2O contient une unité octaédrique Mg(OH2)62+[2]. L'existence de l'ion tétraédrique [Be(OH2)4 ] 2+ dans les solutions aqueuses de nitrate de béryllium et de chlorure de béryllium a été confirmée par spectroscopie vibrationnelle, comme l'indique le mode BeO4 totalement symétrique à 531 cm- 1 . Cette bande est absente dans le sulfate de béryllium et les modes sulfate sont perturbés. Les données confirment l'existence de Be(OH2)3OSO3[3].
Le composé anhydre a une structure similaire à celle de la berlinite. La structure contient une alternance de Be et S de coordination tétraédrique et chaque oxygène est à 2 coordonnées (Be-OS). La distance Be-O est de 156 pm et la distance S-O est de 150 pm[4].
Un mélange de béryllium et de sulfate de radium a été utilisé comme source de neutrons dans la découverte de la fission nucléaire.
Les références
- Kellersohn, Delaplane et Olovsson, « The synergetic effect in beryllium sulfate tetrahydrate – an experimental electron-density study », Acta Crystallographica Section B Structural Science, vol. 50, no 3, , p. 316–326 (DOI 10.1107/S010876819400039X)
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications (ISBN 0-19-855370-6)
- Rudolph, Fischer, Irmer et Pye, « Hydration of Beryllium(II) in Aqueous Solutions of Common Inorganic Salts. A Combined Vibrational Spectroscopic and ab initio Molecular Orbital Study », Dalton Transactions, no 33, , p. 6513 (PMID 19672497, DOI 10.1039/B902481F)
- Grund, « Die Kristallstruktur von BeSO4 », Tschermaks Mineralogische und Petrographische Mitteilungen, vol. 5, no 3, , p. 227–230 (ISSN 0041-3763, DOI 10.1007/BF01191066, Bibcode 1955MinPe...5..227G)
Liens externes
- International Chemical Safety Card 1351
- IARC Monograph "Beryllium and Beryllium Compounds"
- IPCS Health & Safety Guide 44
- IPCS Environmental Health Criteria 106: Beryllium
- IPCS CICAD 32
- Portail de la chimie