Syndrome de Cushing équin
Le syndrome de Cushing équin ou DPIP dysfonctionnement du lobe intermédiaire de l’hypophyse ou Pituitary Pars Intermedia Dysfunction (PPID/DPIP)) est une pathologie fréquente retrouvée chez le cheval.
La DPIP est une maladie d’apparition spontanée et d’évolution progressive caractérisée par une hypertrophie et une hyperplasie de la pars intermedia de l’hypophyse[1]. Les chevaux atteints présentent des concentrations de dopamine inférieures à celle des chevaux sains et des concentrations circulantes supérieures de peptides POMC tels que la mélanocortine (α-MSH), la ß-endorphine (ß-END), le CLIP (corticotrophin-like intermediate peptide), ainsi que d’ACTH[2].
Le syndrome de Cushing toucherait 15 % des chevaux et des poneys de plus de 15 ans. Les signes cliniques de la DPIP sont plus ou moins marqués et incluent : hirsutisme, hypersudation, polyurie/polydipsie, baisse de tonus et fonte musculaire donnant un aspect « gros ventre », distribution anormale des masses grasses, fourbure et immunosuppression[3]. La syndrome de Cushing nécessite un traitement quotidien à vie. Le pergolide est depuis plusieurs années considéré comme le traitement de référence.
| À retenir |
|---|
|

Terminologie
DPIP est la dénomination scientifique préférée car la zone de l’hypophyse concernée et la cause de la maladie chez le cheval diffèrent de celles qui caractérisent le syndrome de Cushing chez l’homme ou le chien. Cependant l'appellation la plus courante chez le cheval reste Syndrome de Cushing équin.
Dans cet article, nous utiliserons indifféremment DPIP ou syndrome de Cushing du cheval.
Épidémiologie
Il est difficile de savoir si la population des chevaux âgés est en augmentation ou si cette population est tout simplement plus suivie médicalement.
Mellor et al. ont estimé en 1999 que 25 % environ de la population équine du Royaume-Uni était âgée de plus de 15 ans[4],[5] et une estimation plus récente réalisée par Ireland en 2009 indique que 28 % des chevaux au Royaume-Uni ont plus de 15 ans. L’âge maximal chez le cheval est estimé à 40-45 ans[6],[7],[8]. Plus de la moitié des chevaux de plus de 20 ans continuent à avoir une certaine activité physique et 10 % font encore de la compétition, même si la capacité sportive des chevaux âgés est bien inférieure à celle des jeunes chevaux[7],[9].
Bien que les caractéristiques démographiques des chevaux puissent varier selon les populations équines, il est clair que, comme dans le marché de la santé des petits animaux de compagnie, l’amélioration de la nutrition et des soins apportés aux chevaux ont entraîné une augmentation de leur espérance de vie, ainsi qu’une augmentation consécutive de l’incidence et de l’importance des maladies « gériatriques » des chevaux et des poneys. Les chevaux âgés font aujourd’hui plus souvent l’objet de consultations vétérinaires[10]. La DPIP est une dysendocrinie couramment diagnostiquée chez le cheval. Dans les années 1970, l’incidence du syndrome de Cushing était estimée entre 0,0075 et 0,5 % de la population équine totale[3],[11],[12]. Le diagnostic de la DPIP a progressé depuis grâce à une meilleure connaissance de la maladie, au développement de nombreux tests diagnostiques et à l’augmentation de la population des chevaux âgés. Les études épidémiologiques récentes estiment qu’environ 25 % des chevaux ont plus de 15 ans et que 14 à 45 % d’entre eux souffrent de DPIP[3],[13].
Le syndrome de Cushing du cheval est une maladie chronique évolutive. L’âge moyen décrit d’apparition des signes cliniques est compris entre 15 et 21 ans[3]. La fourchette d’âge est liée à la population et au stade de la maladie étudiés[11],[14],[15]. Bien que la DPPI soit rarement observée avant l’âge de 10 ans, elle a été décrite chez des chevaux n’ayant que 4 ans [2],[15],[16]. Le diagnostic devient de plus en plus probable avec l’âge[9],[17].
Mécanisme
Anatomie
L’hypophyse des primates est composée d’un grand lobe antérieur (adénohypophyse) et d’un petit lobe postérieur (neurohypophyse), elle est située à la base du cerveau, dans la selle turcique. Elle se trouve sous le chiasma optique et à côté des sinus caverneux, elle est séparée du cerveau par un repli de la dure-mère appelé diaphragme de la selle ou tente de l’hypophyse. Les termes d’hypophyse « antérieure » et « postérieure » sont incorrects d’un point de vue anatomique chez les quadrupèdes, la neurohypophyse étant généralement située dorsalement au reste de l’hypophyse ; chez le cheval, la neurohypophyse est même incluse dans l’adénohypophyse[3].
L’adénohypophyse est anatomiquement subdivisée en : pars tuberalis, pars intermedia, et pars distalis. La pars tuberalis est une fine couche de tissu entourant la pars eminens (ou infundibulum), partie de l’hypothalamus formant le pédoncule qui traverse le diaphragme de la selle. La pars intermedia de l’hypophyse du cheval forme une coque ininterrompue de tissu autour de la neurohypophyse, séparant cette dernière de la pars distalis[3].
Physiologie
L’hypophyse est un organe endocrine complexe qui sécrète de nombreuses hormones peptidiques jouant un rôle crucial dans le maintien[18] :
- de l’homéostasie
- du métabolisme
- de la reproduction
- de la croissance
- de la lactation
Les cellules spécifiques de la pars distalis (corticotropes) et de la pars intermedia (mélanotropes) produisent le même précurseur protéique appelé pro-opiomélanocortine (POMC)[3]. En raison de différents mécanismes de post-traduction, chaque type cellulaire sécrète un ensemble différent de peptides POMC[19] :
- Cellules corticotropes
- Corticotrophine (ACTH)
- ß-endorphine (ß-END)
- ß-LPH
- Cellules mélanotropes
- α-mélanocortine (a-MSH)
- ß-endorphine (ß-END)
- CLIP (corticotrophin-like intermediate peptide)
- Petites quantités d’ACTH
Cellules mélanotropes (pars intermedia)
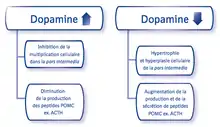
Les cellules mélanotropes de la pars intermedia sont innervées par des neurones dopaminergiques de l’hypothalamus périventriculaire[20],[21]. La dopamine libérée par ces neurones interagit avec les récepteurs dopaminergiques (D2) présents sur les cellules mélanotropes, et inhibe la prolifération cellulaire, la transcription de POMC, et la libération des peptides POMC (ACTH, α-MSH, CLIP, ß-END)2. La suppression de cet effet inhibiteur entraîne une augmentation de la synthèse d’hormones par la pars intermedia hypophysaire, ayant pour conséquence une hyperplasie de la pars intermedia avec risque de développement d’un adénome.
Les cellules mélanotropes sont également stimulées par la sécrétion hypothalamique du facteur de libération de la mélanocortine[21]. Il est établi que l’administration exogène de thyréolibérine (TRH) stimule l’activité sécrétoire des cellules mélanotropes (l’importance physiologique de cet effet étant néanmoins inconnu à ce jour) et cet effet est utilisé dans des tests diagnostiques[17],[22],[23],[24],[25].
Cellules corticotropes (pars distalis)
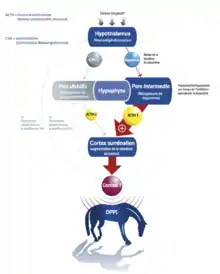
Les cellules corticotropes de la pars distalis produisent de l’ACTH en réponse à la stimulation pulsatile de la corticolibérine (CRH) et de l’arginine vasopressine (ADH) produites par l’hypothalamus[3]. L’ACTH ainsi libérée agit sur la zone fasciculée du cortex surrénalien, stimulant la production et la sécrétion de cortisol. Un rétrocontrôle négatif sur la sécrétion d’ACTH s’exerce dans l’hypothalamus et la pars distalis en réponse à des taux plasmatiques normaux ou élevés de cortisol[19]. le DPIP est caractérisé par la surproduction par la pars intermedia de l’hypohyse de 4 hormones α-MSH, β-endorphine, CLIP, ACTH. La production en excès de ces hormones est causée par un déficit de dopamine du fait de la dégénérescence des neurones dopaminergiques qui la produisent au niveau de l’hypothalamus, la dopamine exerçant un rôle régulateur sur la pars intermedia de l’hypophyse.
Hormone corticotrope (ACTH)
L’ACTH est essentiellement synthétisée et sécrétée par la pars distalis. Sa sécrétion est contrôlée par des neuropeptides tels que la corticolibérine (CRH) et l’arginine-vasopressine (ADH). L’ACTH est également synthétisée par la pars intermedia, mais une grande partie de cette hormone est ensuite transformée en peptides de taille inférieure, α-MSH et CLIP. L’ACTH stimule la synthèse et la sécrétion de cortisol par les surrénales. Le cortisol inhibe la libération d’ACTH par la pars distalis, mais n’a aucun effet sur la pars intermedia[26].
α-mélanocortine (α-MSH)
L’α-MSH jouerait un rôle essentiellement dans la pigmentation de la peau et du poil. À ce niveau, elle interagit avec le récepteur de la mélanocortine de type 1, présent de manière prédominante dans la peau[21]. Dans les autres espèces, elle a une activité anti-inflammatoire puissante qui diminue la libération de cytokines pro-inflammatoires après administration d’endotoxine[21]. L’α-MSH fait également partie intégrante de la voie leptine-mélanocortine, jouant un rôle dans l’équilibre appétit-satiété et le métabolisme lipidique[27]. Un effet saisonnier (avec des valeurs maximales en septembre), mais non circadien, a été observé chez le cheval et le poney[28],[29].
CLIP (Corticotropin Like Intermedia Peptide)
Le CLIP est un sécrétagogue qui agit sur les cellules bêta pancréatiques en stimulant la libération d’insuline et potentiellement en modulant la fonction exocrine du pancréas[30],[31].
ß-endorphine (ß-End)
La ß-End est un opioïde endogène. Elle procure une analgésie et induit des modifications comportementales. Elle a également une action immunosuppressive et un effet sur le tonus vasculaire[30]. Elle pourrait être responsable de modifications comportementales chez les chevaux atteints de DPIP, comme une augmentation de la docilité et une diminution de la sensibilité aux stimuli douloureux[32]. La forme la plus abondante de ß-End normalement produite par la pars intermedia du cheval, est l’Ac-ß-Endorphine-(1-27), qui n’a que peu d’activité opioïde. La forme la plus abondante de ß-End présente chez le cheval souffrant de DPPI est la ß-Endorphine-(1-31), un agoniste opioïde[21].
Cortisol – synthétisé et sécrété par le cortex surrénalien
Le cortisol est également appelé « hormone du stress ». Il joue un rôle dans l’adaptation du métabolisme des glucides, lipides et protéines, dans le foie, le muscle et le tissu adipeux, pour assurer un apport suffisant de glucose et d’acides gras lors de jeûne. Le cortisol stimule la néoglucogenèse par une mobilisation des acides aminés, qui sont ensuite métabolisés en glucose dans le foie et le rein. Le cortisol induit également une baisse de l’utilisation du glucose dans les cellules périphériques, qui pourrait être due en partie à une baisse de la sensibilité à l’insuline. Les glucocorticoïdes augmentent la lipolyse pour la production d’acides gras. Cela permet de fournir de l’énergie (tout en économisant le glucose) aux tissus périphériques et d’apporter un substrat pour la néoglucogenèse. Le cortisol possède également plusieurs propriétés anti-inflammatoires, considérées aussi comme immunosuppressives[26]. Chez le cheval, la cortisolémie suit un rythme circadien, avec une augmentation des taux le matin et un minimum autour de minuit. Une perte de ce rythme circadien normal est observée lors de DPIP, cependant des variations permanentes dans la journée empêchent l’utilisation des dosages répétés de cortisol comme test diagnostique de la DPIP[1].
Physiopathologie
Bien que le syndrome de Cushing ait été identifiée pour la première fois en 1932 chez le cheval âgé, sa physiopathologie n’a été élucidée qu’au cours de ces 25 dernières années3. En 1988, Millington et al. ont observé chez les chevaux atteints une baisse des concentrations de dopamine dans les tissus hypophysaires, ce qui a permis de comprendre la physiopathologie de cette maladie[32]. En 2008, Haritou et al. ont décrit des variations saisonnières de la dopaminémie chez les chevaux sains, les taux étant toutefois bien plus faibles chez les chevaux souffrant de DPIP[33]. Les chevaux atteints de DPIP présentaient des concentrations de dopamine 88 % plus faibles que celles de leurs témoins du même âge[32].
À la suite de cette étude, McFarlane et al. ont utilisé en 2005 l’immunohistochimie pour montrer que les chevaux souffrant de DPPI présentaient 50 % moins de corps cellulaires périventriculaires que leurs témoins du même âge[34],[35].
Les données issues de ces études appuient fortement l’idée que le syndrome de Cushing serait due à une neurodégénérescence dopaminergique.
Syndrome de Cushing chez le cheval vs maladie de Parkinson chez l’homme
La neurodégénérescence dopaminergique du cheval ressemble beaucoup à la pathologie de la maladie de Parkinson, bien qu'il existe d’importantes différences.
Les principaux signes cliniques de la maladie de Parkinson sont la conséquence d’une dysfonction motrice progressive, alors que les principaux signes cliniques de la DPIP sont le résultat d’une dysfonction hormonale. La différence entre les signes cliniques est probablement due aux différences de localisation de la neurodégénérescence dopaminergique dans le système nerveux central. La dysfonction motrice observée dans la maladie de Parkinson provient d’une destruction des neurones nigrostriés, tandis que la dysfonction hormonale de la DPPI résulte d’une perte des neurones de la zone périventriculaire de l’hypothalamus[35].
La cause exacte de la neurodégénérescence dopaminergique fait toujours l’objet de recherches ; mais des données récentes indiquent que le stress oxydatif jouerait un rôle dans les deux maladies. Les dérivés actifs de l’oxygène (DAO) produits au cours du métabolisme des neurotransmetteurs par les neurones dopaminergiques peuvent léser ces neurones car ceux-ci sont extrêmement sensibles à leurs effets[34]. Mc Farlane et al. ont montré en 2005 que le vieillissement est responsable d’une augmentation du stress oxydatif[34]. Le stress oxydatif observé chez les chevaux sains âgés et chez les chevaux atteints de DPIP n’est pas la conséquence d’une baisse de capacité antioxydante systémique[34].
Effet de la dopamine sur l’hypophyse
La dopamine, comme il a déjà été dit, est libérée par les neurones de la zone périventriculaire de l’hypothalamus :
- La dopamine inhibe la multiplication des cellules de la pars intermedia
- La dopamine diminue la production des peptides POMC
Du fait de la neurodégénérescence et de la baisse consécutive de la dopamine, les cellules de la pars intermedia deviennent hypertrophiques et hyperplasiques, avec un risque de développement de macroadénomes (> 5 mm de diamètre) ou microadénomes (1,5 mm de diamètre) [36],[37].
En 1990, Heinrichs et al. ont étudié une série d’adénomes post mortem et ont trouvé que, sur les 19 chevaux autopsiés, 13 présentaient des macroadénomes de la pars intermedia et 6 seulement des microadénomes. Une majorité des macroadénomes observés avaient pris une fonction de pars distalis chez les chevaux concernés. Les tumeurs de la pars intermedia ont généralement un faible indice mitotique et ne métastasent pas[3].
Ces tumeurs sont également bien vascularisées et présentent souvent des hémorragies associées. Elles ne possèdent généralement pas de capsule propre[3]. D’autres tumeurs, notamment de la pars distalis ainsi qu’une tumeur corticosurrénalienne fonctionnelle, ont été associées au syndrome DPIP, mais elles sont rares[38],[39]. La taille de l’hypophyse augmente avec l’âge, mais elle ne semble pas être corrélée à la sévérité des signes cliniques ou des résultats des tests endocriniens (la plus grosse tumeur ne produit pas forcément le plus d’hormones)[36].
La baisse du contrôle inhibiteur de la dopamine permet aux cellules de la pars intermedia non seulement de proliférer mais aussi de produire et de sécréter plus de peptides POMC[3], phénomène prouvé par coloration immunohistochimique[16]. Même si la majorité des signes cliniques associés à la DPIP sont considérés comme le résultat d’une augmentation de la production d’ACTH, la coloration immunohistochimique a permis de montrer que les peptides MSH et la ß-END potentialisent encore l’effet de l’ACTH[18].
Syndrome de Cushing chez l’homme et le chien
Le syndrome de Cushing chez l’homme et le chien est lié à :
- une augmentation de la production d’ACTH par la pars distalis de l’hypophyse
ou moins fréquemment
- une augmentation de la production de cortisol par des tumeurs surrénaliennes.
Chez le cheval, la DPIP est normalement associée à une hyperplasie ou un adénome de la pars intermedia de l’hypophyse. Un seul cas d’adénocarcinome des corticosurrénales responsable d’un syndrome de Cushing chez le cheval[39] a été décrit.
DPIP chez l’âne
Les ânes peuvent aussi souffrir de DPIP et exprimer la même variété de signes cliniques. Toutefois, il peut être difficile d’identifier une DPIP chez l’âne car les signes cliniques les plus évidents chez le cheval (hirsutisme) sont moins visibles sur un pelage épais comme celui de l’âne. Les ânes sains peuvent avoir un poil épais, même en été.
Description
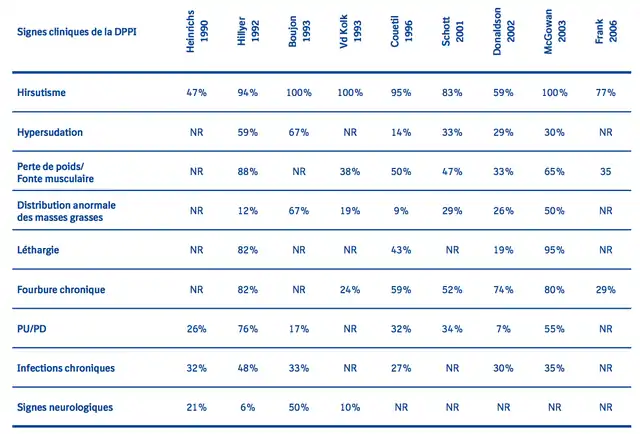
Les chevaux atteints de DPIP présentent une large variété de signes cliniques non spécifiques qui progressent avec le temps. Ces signes incluent : hirsutisme, fourbure, hypersudation, léthargie, fonte musculaire, distribution anormale des masses grasses et polyurie/polydipsie. Les signes moins souvent décrits de la DPIP sont : retard de cicatrisation, immunosuppression et sensibilité aux infections (sinusite, par ex.), lactation persistante et infertilité. Certains de ces signes peuvent être associés à tort au processus normal de vieillissement, ceux-ci apparaissant souvent de manière insidieuse. Aucun consensus n’existe actuellement sur le tableau clinique de la DPIP. Le tableau ci-dessous résume les observations décrites dans différentes publications.
Hirsutisme
Le signe clinique caractéristique de la DPIP est l’hirsutisme, considéré comme pathognomonique. De précédentes études rétrospectives sur la DPIP, comme celles de McGowan et Neiger en 2003, Boujon en 1993 et van der Kolk en 1993, ont révélé que l’hirsutisme s’observe dans 100 % des cas de DPIP. Mais les études rétrospectives pourraient présenter un biais de sélection pour les chevaux montrant un hirsutisme (considéré comme signe clinique de certitude en l’absence d’autres outils diagnostiques)[40].
Il est souvent utilisé pour faire un « diagnostic par-dessus la clôture »[3],[17]. Les chevaux atteints d’hirsutisme muent plus tardivement ou ne perdent pas leur poil et développent ainsi un pelage anormalement long et épais. Les cas anciens peuvent présenter un poil « bouclé ». Souvent, des modifications discrètes du pelage apparaissent avant que l’hirsutisme ne devienne cliniquement visible. La pathogénie de ce signe particulier, caractérisé par le blocage des follicules pileux en phase télogène, reste inconnue à ce jour[3]. L’hypothèse actuellement retenue est que ce phénomène serait dû à des augmentations chroniques des peptides MSH[3].
Fourbure
La fourbure correspond à une inflammation du système lamellaire reliant la phalange distale à la muraille engendrant une douleur très intense et une boiterie caractéristique. Elle peut être due à[41] :
- endocrinienne (DPIP, syndrome métabolique équin)
- inflammatoire (endotoxémie)
- alimentaire (excès de glucides alimentaires)
- iatrogène (surdosage de glucocorticoïdes)
- liée au stress (boiterie controlatérale)
La fourbure chronique est décrite dans 24 à 82 % des cas de DPIP chez le cheval[11],[17]. En 2004, Donaldson et al. ont étudié 40 chevaux souffrant de fourbure pour rechercher une éventuelle DPIP[40]. Ils ont conclu que 70 % des chevaux étaient atteints de DPPI et que les chevaux avaient plus de risques de développer une fourbure en septembre et en mai. L’âge moyen des chevaux souffrant de fourbure avec diagnostic ultérieur de DPIP était de 15,5 ans et que la majorité d’entre eux ne montrait pas d’hirsutisme « pathognomonique ». Il serait donc prudent de rechercher une DPPI chez tous les chevaux souffrant de fourbure, après stabilisation des signes cliniques.
La physiopathologie du développement de la fourbure reste largement méconnue et semble plurifactorielle. L’insuline et le cortisol ont des actions antagonistes, et la plupart des hypothèses tournent autour d’une augmentation de la production de l’ACTH/cortisol et la potentialisation de ses effets, notamment l’insulinorésistance et l’hyperinsulinémie qui en résulte. Les principales théories sont :
- Manque de glucose dans le tissu lamellaire : Le pied du cheval a un besoin énergétique inhabituellement élevé et montre donc une absorption accrue de glucose[42]. Une hypothèse était que l’insulinorésistance induite par les glucocorticoïdes privait de glucose les tissus lamellaires sensibles, entraînant une destruction des lamelles[21]. Mais une récente étude de Asplin et al. en 2010 a montré que le tissu lamellaire ne possédait pas de GLUT-4 (un récepteur au glucose, insulinodépendant), prouvant que l’absorption de glucose par les tissus lamellaires était indépendante de l’insuline[42],[43].
- Hyperinsulinémie : Il a été observé plus récemment que les concentrations élevées d’insuline pourraient jouer un rôle direct dans le développement de la fourbure. De Laat et al. ont montré en 2010 dans un modèle expérimental que l’hyperinsulinémie (avec normoglycémie) induisait une fourbure chez les poneys et les chevaux sains[42],[44].
Perte de poids
La perte de poids, due à l’atrophie musculaire, est le signe clinique le plus fréquent, et potentiellement le plus précoce, de la DPIP[21].
En règle générale, ce sont les muscles de la ligne du dos et de la paroi abdominale qui s’atrophient en premier. Dans les cas avancés, les chevaux deviennent « bedonnants » (à cause de la fonte des muscles abdominaux). On pense que le cortisol joue un rôle central dans la diminution de la masse musculaire du fait de ses effets cataboliques sur les protéines. Les protéines ayant des fonctions secondaires sont dégradées en acides aminés avant les protéines ayant des fonctions essentielles.
Distribution anormale des masses grasses
De la graisse peut se déposer anormalement au- dessus et en arrière des yeux (fosse supra-orbitaire)3. Le tissu adipeux constitue une source importante d’hormones qui influent sur la régulation de la masse et de la composition corporelles[45]. Des dépôts adipeux plus généralisés peuvent être un signe évocateur de Syndrome Métabolique Equin (SME).
Diabète
Une polyurie (PU) et une polydipsie (PD) se développent dans environ 33 % des cas de DPIP chez le cheval[3]. La consommation moyenne d’eau d’un cheval est de 20 à 30 litres par jour. Une consommation hydrique supérieure à 100 ml/kg/j et une production urinaire supérieure à 50 ml/kg/j caractérisent une PU/PD. Ce signe clinique commence avec le développement d’une hyperglycémie induite par le cortisol et la polyurie consécutive. Le cortisol entraîne une augmentation du débit de filtration glomérulaire ainsi qu’une diminution de la sécrétion d’ADH. La consommation hydrique augmente jusqu’à 50 à 90 litres par jour[46].
Hypersudation
Une hypersudation concerne également jusqu’à deux tiers des cas de DPIP, le plus souvent localisée à l’encolure et aux épaules, et pourrait représenter une réaction de thermorégulation du fait du pelage anormalement long dans certains cas[3].
Retard de cicatrisation
Les chevaux atteints de DPIP peuvent présenter un retard de cicatrisation et développer des infections secondaires persistantes : infections cutanées, récidives d’abcès de la sole, de périostite alvéolaire et de sinusite, conjonctivite, gingivite et bronchopneumonie, entre autres[3]. L’hypercortisolémie prolongée a un effet immunosuppresseur.
Dysfonction du Système Nerveux Central (SNC)
Une dysfonction du SNC se traduisant par une ataxie, des crises convulsives et une cécité, a été décrite lors de DPIP, mais est rarement diagnostiquée[3]. Ces signes cliniques sont probablement liés à la présence d’adénomes de grande taille, occupant une place importante dans le crâne et augmentant ainsi la pression intracrânienne. La cécité pourrait être due à une compression directe du chiasma optique (comme chez le chien souffrant de Cushing).
Autres signes cliniques
Les autres signes cliniques qui ont été décrits chez les chevaux atteints de DPIP sont : problème de lactation et infertilité, qui pourraient être dues à une anomalie de sécrétion de la prolactine (également sous le contrôle inhibiteur de la dopamine) et endométrite chronique liée à l’immunosuppression. La léthargie et les baisses de performances sont plus probablement la conséquence de l’augmentation du taux de α-END, et l’augmentation de l’appétit pourrait être une réaction à l’état catabolique[3].
Examens complémentaires
Aucune anomalie hématologique ou biochimique n’est spécifique de la DPIP. La majorité des chevaux souffrant de DPIP ont des résultats hématologiques et biochimiques normaux[47].
Hématologie
La DPPI peut entraîner une légère anémie. Dans d’autres espèces, l’hypercortisolémie peut entraîner :
- une neutrophilie (augmentation du nombre de neutrophiles)
- une lymphopénie (diminution du nombre des lymphocytes)
Toutefois, ce « leucogramme de stress » est rarement présent chez le cheval et n’est pas observé chez les chevaux atteints de DPPI (contrairement aux cas de Cushing chez le chien)[48]. Si présent, il est plus souvent le reflet d’une maladie concomitante que d’une hypercortisolémie[47],[49].
Biochimie
L’insulinorésistance peut entraîner une hyperglycémie. Le pronostic semble moins favorable en cas de DPIP avec insulinorésistance, bien que l’insulinorésistance puisse ne pas s’accompagner d’hyperglycémie car l’épuisement pancréatique est relativement rare chez le cheval[50]. Les autres anomalies peuvent inclure : augmentation d’activité des enzymes hépatiques, hypercholestérolémie et hypertriglycéridémie, évoquant là encore une maladie concomitante[3].
Analyse urinaire
Dans une série de 18 chevaux atteints de DPIP, la densité urinaire variait de 1022 à 1047, en l’absence de glycosurie, sauf en cas d’hyperglycémie concomitante (175 - 200 mg/dl)[3].
Diagnostic différentiel
L’autre grande hypothèse diagnostique à envisager est celle du Syndrome Métabolique Equin (SME), parfois appelé Cushing périphérique[51].
Le SME s’observe chez toutes les races de chevaux, mais les animaux plus prédisposés sont les poneys, chevaux Morgan et Paso Fino, d’âge moyen.
Définition du SME
Le syndrome métabolique équin (SME), considéré comme étant dû à une augmentation de l’efficacité métabolique, est actuellement défini par la présence de :
- obésité générale ou adiposité régionale → région du ligament nucal, dépôts adipeux au niveau de la base de la queue et du fourreau
- fourbure → démarre souvent au printemps avec la pousse rapide de l’herbe
- insulinorésistance (IR) → concentrations normales d’insuline incapables de stimuler l’absorption tissulaire du glucose
Les signes cliniques du SME ressemblent à ceux observés lors de DPIP débutante, à savoir fourbure récidivante et polyurie/polydipsie. Toutefois, l’hirsutisme et l’hypersudation n’ont pas été décrits lors de SME.
Diagnostic du SME
Le syndrome métabolique se reconnaît d’abord généralement par l’apparition d’une fourbure chronique récidivante chez des chevaux obèses. Il faut rechercher chez ces animaux une éventuelle insulinorésistance, en prélevant du sang afin de mesurer les concentrations de glucose et d’insuline. L’hyperinsulinémie compensatoire caractérise l’insulinorésistance, car la sécrétion pancréatique d’insuline augmente pour compenser sa baisse d’efficacité tissulaire. L’hyperinsulinémie est définie par rapport aux normes de référence établies par le laboratoire pour le type de dosage réalisé. Il est recommandé d’observer une courte période de jeûne (d’environ 6 heures) avant de réaliser les prélèvements sanguins. Ce dosage doit être effectué en dehors des périodes de douleur ou de stress.
Si l’insulinorésistance est modérée et que les concentrations d’insuline restent dans les normes de référence, un test de tolérance au glucose et à l’insuline est conseillé.
SME vs DPIP
Les dépôts graisseux localisés et la fourbure sont des signes cliniques de la DPIP et du SME. Par conséquent, si ces signes sont observés, les deux hypothèses doivent être envisagées. Le SME peut se différencier de la DPPI par :
- L’âge d’apparition : Les chevaux souffrant du SME sont généralement plus jeunes que les ceux atteints de DPPI (les deux maladies peuvent coexister !)
- Les autres signes caractéristiques de la DPPI, mais pas du SME, sont : absence de mue, hirsutisme, hypersudation, PU/PD, fonte musculaire
- Résultats positifs aux tests endocriniens (test de freinage à la dexaméthasone/dosage de l’ACTH) diagnostiques de la DPPI[52].
Prise en charge du SME
Le SME étant dû à une augmentation de l’efficacité métabolique, son traitement doit surtout viser à :
- résoudre l’obésité
- améliorer l’insulinorésistance
La prise en charge inclut un régime alimentaire strict (éviter les aliments riches en amidon, en sucre et limiter l’accès aux pâtures) et la mise en place d’un programme d’exercice physique. Si les chevaux ne répondent pas à la prise en charge nutritionnelle, différents compléments et médicaments peuvent être utilisés pour améliorer la sensibilité à l’insuline :
- Lévothyroxine sodique
- Metformine
- Chrome
Arbre décisionnel pour le diagnostic de la DPIP - Consensus 2011[53]
Le diagnostic de la maladie à un stade avancé repose souvent sur l’anamnèse ainsi que le tableau clinique (hirsutisme).
Il existe toute une série d’examens sanguins à disposition du praticien pour confirmer une DPIP à un stade avancé ou pour diagnostiquer l’affection en cas de suspicion à un stade débutant, c’est-à-dire lorsque les signes cliniques ne sont pas évidents.
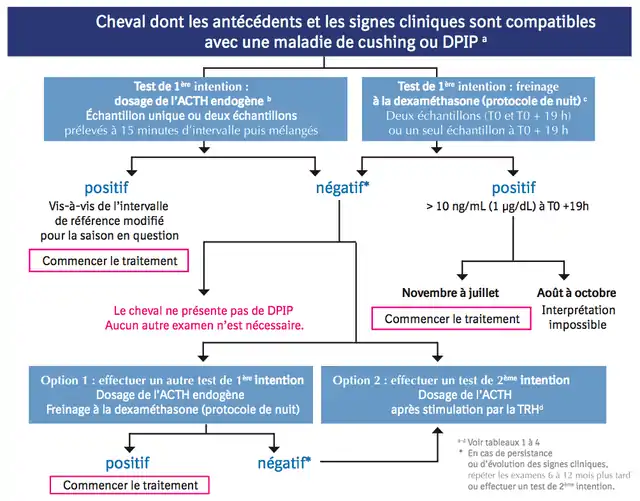
Tests diagnostiques de 1re et 2e intention

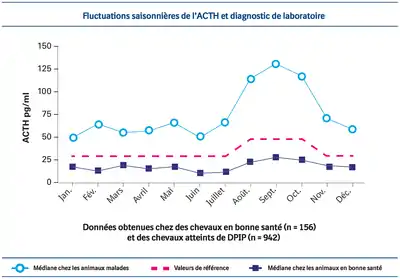
Dosage de l'ACTH endogène : une saison plus propice ?
Y a-t-il une saison plus propice qu’une autre pour réaliser un dosage de l’acth endogène ?
En raison des fluctuations saisonnières de l’ACTH, particulièrement à l’automne, certains auteurs pensaient qu’il fallait éviter de pratiquer le test à cette période de l’année. De nouvelles données (cf. graphique) montrent qu’en ajustant les valeurs de référence physiologiques en fonction de la saison, c’est, de fait, la période de l’année la plus favorable à la réalisation de l’examen[3],[54].
En effet, c’est à ce moment-là que :
- La différence entre les valeurs physiologiques (ajustées) et les valeurs pathologiques est la plus importante
- Le dosage offre une meilleure sensibilité et une plus grande exactitude
Cela signifie qu’il est maintenant possible d’effectuer un dosage de l’ACTH endogène à tout moment dans l’année, et ce en toute confiance (sous réserve que votre laboratoire d’analyses utilise un intervalle de référence modifié en conséquence).
Autres examens
Le test de stimulation à l’ACTH permet d’évaluer la fonction surrénalienne, et comme les chevaux atteints de DPIP n’ont pas une fonction surrénalienne anormale, ce test n’est pas intéressant pour le diagnostic de la DPIP. L’insulinémie à jeun, la glycémie de repos, la cortisolémie de repos, le rythme circadien du cortisol et le rapport cortisol/créatinine urinaire ne sont pas des bons indicateurs de la DPIP[3]. Toutefois, l’insulinémie à jeun (ou l’insulinémie à minuit) et la glycémie de repos peuvent aider au diagnostic et servir au suivi des chevaux atteints de DPIP. Dans une étude, les chevaux qui souffraient de DPIP avec hyperinsulinémie marquée (> 188 μUI/ml) avaient plus de risques de développer une fourbure et de ne pas vivre plus de 2 ans, que ceux avec hyperinsulinémie légère à modérée (< 62 μUI/ml)[52].
La tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM) ont été utilisées pour diagnostiquer les adénomes hypophysaires chez le cheval60, bien que ces techniques ne soient pas utilisables en routine. L’équipement correspondant est peu accessible, très coûteux et l’anesthésie générale est un risque qu’il n’est pas nécessaire de prendre ; en outre, la taille microscopique de certains adénomes exclut l’utilisation de la TDM et de l’IRM à des fins diagnostiques. De plus, des microadénomes ou des macroadénomes de la pars intermedia ont été détectés chez 17 % des chevaux ne présentant aucun signe clinique de DPIP[36].
DPIP débutante
Le diagnostic des premiers stades de la DPIP reste un défi pour les vétérinaires équins. Nous ne connaissons pas à ce jour la capacité des tests à détecter la DPIP en début d’évolution. Par ailleurs, il est particulièrement important de distinguer la DPIP du SME.
On s’intéresse beaucoup à l’effet de la DPIP débutante chez les chevaux de sport d’âge moyen pouvant présenter des problèmes de pied récidivants, des baisses de performance, une fonte musculaire/perte de poids ou des infections récidivantes (sinusite, parodontite, par ex.). On en sait peu sur le diagnostic, les effets du traitement ou l’observance du client à ce stade de la maladie.
L’approche de ces chevaux suspects de DPIP débutante inclut :
- un examen clinique complet annuel ou semestriel
- un bilan hématologique et biochimique complet avec détermination de l’insulinémie
- un dosage de l’eACTH ou un test de freinage à la dexaméthasone à faible dose ➔ les résultats étant parfois difficiles à interpréter, il peut être nécessaire de refaire ces tests 30 à 60 jours plus tard
- la recherche de signes précoces de fourbure sous-jacente
Traitement d’essai de 3 mois
Il est parfois nécessaire d’observer une réponse positive au traitement d’essai de 3 mois pour confirmer le diagnostic de DPIP. Mais le « diagnostic thérapeutique » des maladies endocriniennes n’est pas sans risques, car la dose efficace peut varier d’un individu à l’autre.
ATTENTION : l’absence de réponse après 3 mois de traitement à la dose recommandée n’exclut pas l’hypothèse d’une DPIP.
Cela peut simplement signifier qu’il faut augmenter la dose. En outre, il peut être difficile d’évaluer une réponse positive au traitement si le cheval ne présente aucun signe clinique classique et visible de DPIP.
Traitement
Le traitement de la DPIP chez le cheval consiste à réguler la neurotransmission. Ce syndrome est la conséquence d’un manque de dopamine, et le traitement par des agonistes de la dopamine, comme le pergolide, semble constituer l’approche thérapeutique la plus logique et est considéré comme LE traitement de référence. Les antagonistes de la sérotonine, qui ont été parmi les premiers médicaments utilisés pour traiter la DPIP, sont aujourd’hui largement utilisés car ils ont prouvé leur efficacité sur le Cushing humain. Dans certains cas, le trilostane ou la phytothérapie (poivre des moines) sont utilisés. De toutes les options thérapeutiques, le mésilate de pergolide est le traitement de choix. La DPIP n’étant pas réversible, un traitement à vie est nécessaire. Outre le traitement pharmacologique, la prise en charge complémentaire est primordiale pour soulager les signes cliniques tels que les problèmes dentaires, la fourbure et la perte de poids. L’exérèse chirurgicale de l’adénome hypophysaire n’est pas tentée chez le cheval, comme elle l’est chez l’homme ou chez le chien souffrant de Cushing.
Pergolide
Le pergolide est un agoniste dopaminergique de longue durée d’action qui a d’abord été utilisé pour traiter la maladie de Parkinson chez l’homme.
Le pergolide (sous forme de mésilate) est utilisé pour traiter la DPIP chez le cheval depuis plus de 25 ans. Vingt-six publications ont démontré la tolérance et l’efficacité du pergolide chez 219 chevaux souffrant de DPIP d’apparition spontanée. Les doses utilisées dans les études publiées varient de 0,25 à 5 mg/cheval/jour et la plus longue durée de traitement publiée est de 7 ans[49].
Administration
Le pergolide est disponible sous forme de comprimés rectangulaires roses sécables contenant chacun 1 mg de pergolide (soit 1,31 mg de mésilate de pergolide), conditionnés sous blisters aluminium (Prascend, Boehringer Ingelheim).
Posologie
La posologie initiale recommandée est de 2 μg/kg de poids vif. La dose de départ doit ensuite être adaptée en fonction de la réponse de l’animal.
La majorité des chevaux se stabilisent avec une dose moyenne de 2 μg/kg, mais parfois après avoir d’abord augmenté la dose pour contrôler les signes cliniques, et l’avoir ensuite diminuée progressivement. Certains chevaux peuvent répondre cliniquement à des doses inférieures ou fluctuantes. La stratégie thérapeutique recommandée consiste à rechercher la plus petite dose efficace pour chaque animal, en se basant sur la réponse au traitement, en matière d’efficacité ou de signes d’intolérance. Certains chevaux doivent recevoir des doses allant jusqu’à 10 μg/kg et ces chevaux doivent être suivis très étroitement. Habituellement, le propriétaire dissout le comprimé dans de l’eau et administre à l’aide d’une seringue cette solution additionnée de mélasse, de sirop de glucose ou d’érable, ou met le comprimé directement sur l’aliment ou dans une pomme ou une friandise. Si une dose est oubliée, la dose suivante doit être administrée comme prévu.
Surveillance et ajustement de la dose
La stratégie thérapeutique consiste à rechercher la plus petite dose efficace pour chaque animal, en se basant sur la réponse au traitement, en matière d’efficacité ou de signes d’intolérance.
Après le diagnostic initial, répéter les tests diagnostiques endocriniens pour l’ajustement de la dose et le suivi du traitement à intervalles de 6 semaines jusqu’à stabilisation des signes cliniques ou des résultats des tests diagnostiques. L’ajustement de la dose doit s’appuyer sur :
- l’amélioration des signes cliniques ou
- l’amélioration/normalisation des résultats des tests diagnostiques (dosage de l’ACTH ou test de freinage à la dexaméthasone, par ex.)
ATTENTION : La dose de départ actuellement recommandée de 2 μg/kg est une dose faible → essayer d’obtenir une dose inférieure peut aboutir à un échec de traitement. À long terme, certains chevaux peuvent être main- tenus à des doses inférieures, mais ils doivent être suivis attentivement afin de guetter une éventuelle réapparition des signes cliniques.
Souvent dans la littérature, une amélioration des signes cliniques est décrite malgré l’absence de normalisation des paramètres de laboratoire. On ignore s’il faut que le taux d’ACTH ou le résultat du test de freinage à la dexaméthasone se normalise avec le traitement ou si une diminution par rapport au taux/résultat d’avant traitement est suffisante.
Délai de la réponse au traitement
L’amélioration des signes cliniques dépend de la sévérité de la maladie, mais elle s’observe généralement après 6 à 12 semaines environ. Cependant, certains signes peuvent s’améliorer après seulement 3-4 semaines de traitement, et si le signe principal est l’hirsutisme, l’amélioration de l’état du pelage peut mettre plus longtemps.
Si les signes cliniques ne s’améliorent pas ou si les résultats des tests diagnostiques ne se stabilisent pas après 6 semaines, la dose journalière peut être augmentée de 0,5 mg/cheval. Certains individus peuvent montrer une amélioration sans être toutefois normalisés/stabilisés et leur dose sera ou non augmentée selon l’appréciation du vétérinaire et la réponse/tolérance de l’animal à la dose utilisée.
Tant que les signes cliniques ne sont pas suffisamment contrôlés (d’après l’évaluation clinique ou les résultats des tests diagnostiques), il est recommandé d’augmenter la dose journalière par paliers de 0,5 mg toutes les 6 semaines jusqu’à stabilisation, si la dose est bien tolérée. En règle générale, les signes d’intolérance doivent être traités en diminuant la dose journalière de 0,5 mg.
Après stabilisation, l’animal doit être réévalué cliniquement et par des tests diagnostiques tous les 6 mois, pour contrôler le traitement et la dose.
Effets secondaires
Seuls quelques effets secondaires légers, de type baisse légère et transitoire de l’appétit ou du poids, ont été décrits chez certains chevaux aux doses recommandées.
Au début de l’utilisation du pergolide chez le cheval (à des doses bien supérieures), on craignait qu’il ne provoque une vasoconstriction des vaisseaux sanguins périphériques (par stimulation des récepteurs D1) et une aggravation des fourbures existantes. Mais rien de tel n’a été observé dans aucune des études publiées.
Les autres effets secondaires potentiels incluent :
- léthargie
- légers signes nerveux centraux (dépression et ataxie légères, par ex.)
- diarrhée
- coliques
Tous les effets sont transitoires et disparaissent en diminuant la dose.
Si des signes d’intolérance apparaissent, le traitement doit être interrompu pendant 2-3 jours puis réinstauré à la moitié de la dose initiale. Si nécessaire, la dose journalière totale peut alors être réaugmentée jusqu’à obtention de l’effet clinique souhaité par paliers de 0,5 mg toutes les 2 à 4 semaines. Un surdosage massif n'a jamais été rapporté.
Précautions et mises en garde
Le pergolide ne doit pas être utilisé chez les chevaux destinés à la consommation humaine.
Gestation et lactation
Les vétérinaires sont parfois confrontés au cas de juments gestantes semblant développer une DPIP aiguë. Le pergolide a quelques fois été utilisé dans ce type de cas en toute sécurité[49]. Toutefois, un article[55] a rapporté le cas de deux juments gestantes traitées avec le pergolide qui ont subi un retard de mise-bas et un défaut de lactation.
La notice du pergolide met en garde sur le fait que pendant la gestation le pergolide doit faire l’objet d’une évaluation bénéfice/risque, et il ne doit être recommandé qu’accompagné d’une mise en garde nécessaire.
Les études de laboratoire sur souris et lapins n’ont pas mis en évidence d’effets tératogènes. À dose élevée, une réduction de la fertilité a été observée chez la souris.
L’utilisation du pergolide n’est pas recommandée chez les juments allaitantes. On ne dispose d’aucune donnée de tolérance chez la jument en lactation. Comme les autres agonistes dopaminergiques, le pergolide peut inhiber la sécrétion de prolactine.
Chez les animaux de laboratoire, une réduction des poids corporels et des taux de survie de la descendance ont été attribués à l’inhibition pharmacologique de la sécrétion de prolactine par le pergolide, entraînant une chute de lactation. De nombreux médicaments sont excrétés dans le lait et, comme la tolérance du pergolide n’a pas été démontrée chez le poulain, le pergolide ne doit être utilisé chez les juments en lactation qu’après évaluation bénéfice/risque. De nombreux experts préconisent l’arrêt du pergolide dans le dernier mois de gestation et sa reprise environ 6 semaines après la mise-bas si la jument a une lactation normale.
Interactions médicamenteuses
Le pergolide présente un taux de liaison aux protéines plasmatiques de 90 %.
Le pergolide ne doit pas être associé aux antagonistes de la dopamine, tels que les neuroleptiques (phénothiazines), la dompéridone ou le métoclopramide, car ces molécules peuvent réduire l’efficacité du pergolide.
Pharmacocinétique
Le pergolide est très rapidement absorbé. La concentration maximale de pergolide est observée moins d’une heure après l’administration (Tmax = 0,4 heures) dans une étude pharmacocinétique réalisée chez le cheval à la dose de 10 μg/kg, et 1,25 ± 0,5 heures après l’administration dans une autre étude pharmacocinétique réalisée chez le cheval à la dose de 2 μg/kg. L’aire sous la courbe est égale à 14 ng.h/ml.
La demi-vie d’élimination est estimée à 6 heures. Les effets pharmacocinétiques et pharmacodynamiques du pergolide sont « dissociés », c’est-à-dire que le temps pendant lequel le médicament est efficace et le temps de demi-vie ne sont pas égaux. Les effets du pergolide sur la production des peptides hypophysaires durent jusqu’à 48 heures. Toutes les études publiées ont démontré l’efficacité d’une administration quotidienne unique.
Les voies de métabolisation et d’élimination n’ont pas été étudiées chez le cheval mais dans toutes les autres espèces étudiées, le pergolide est fortement métabolisé et son principal métabolite est le sulfoxyde de pergolide, actif pharmacologiquement.
Pharmacodynamie
Le pergolide est un dérivé synthétique de l’ergot de seigle ; c’est un agoniste des récepteurs de la dopamine (D2) puissant et de longue durée d’action. Chez les chevaux atteints de DPIP, le pergolide exerce son effet thérapeutique en stimulant les récepteurs à la dopamine de l’hypophyse. Pharmacologiquement, le pergolide est un agoniste dopaminergique plus puissant et de plus longue durée d’action que les autres molécules de sa classe (classe du pergolide), comme la bromocriptine.
La dose recommandée est beaucoup plus faible chez le cheval que chez l’homme car le site d’action chez le cheval, l’hypophyse, est situé à l’extérieur de la barrière hématoméningée, alors que chez l’homme, le pergolide doit traverser la barrière hématoméningée pour stimuler les récepteurs à la dopamine situés à l’intérieur du cerveau.
Le pergolide a peu d’effet sur les voies noradrénergiques, adrénergiques ou sérotoninergiques aux doses thérapeutiques. Comme les autres agonistes dopaminergiques, le pergolide peut inhiber la sécrétion de prolactine.
Résistance
Aucune résistance à l’effet du médicament n’est observée lors de traitement prolongé.
Cyproheptadine
La cyproheptadine est un antagoniste de la sérotonine. Elle a d’abord été utilisée comme traitement de la DPIP, la sérotonine ayant montré un effet de stimulation sur la sécrétion d’ACTH chez le rat, et la cyproheptadine ayant donné de bons résultats pour le traitement du Cushing chez l’homme.
Elle est bien absorbée au niveau de l’intestin chez le cheval. La posologie moyenne utilisée est de 0,13 mg/kg. Les effets secondaires sont rares, bien qu’une sédation puisse se développer à des doses plus élevées64. Schott a comparé en 2001 l’efficacité du pergolide et de la cyproheptadine[56]. Le pergolide et la cyproheptadine ont respectivement montré une efficacité de 85 % et 45 % pour l'amélioration clinique, et de 85 % et 15 % pour la normalisation des résultats du test de freinage à la dexaméthasone.
Donaldson et aI. (2002) ont montré qu’un nombre significativement plus important de propriétaires décrivaient une amélioration avec le pergolide (85 %) que pour la cyproheptadine (28 %)[15].
Love (1993) a également montré une supériorité du pergolide sur la cyproheptadine en matière d’efficacité dans le traitement de la DPIP[57]. Il a été proposé d’utiliser la cyproheptadine en association avec le pergolide dans les cas réfractaires, bien que l’intérêt de cette association n’ait pas été démontré[58].
Bromocriptine
La bromocriptine est également un agoniste dopaminergique, mais moins puissant que le pergolide.
- son absorption orale est faible
- la fréquence décrite d’effets secondaires est supérieure à celle du pergolide
- son coût est élevé
Trilostane
Le trilostane inhibe la production surrénalienne de cortisol, et il est enregistré pour le traitement du syndrome de Cushing chez le chien en Europe, en Australie et aux États-Unis. Il a été démontré qu’une dose de 0,5 à 1 mg/kg/j de trilostane en 1 prise permet de traiter efficacement la DPIP chez le cheval[59].
Une amélioration de la polyurie/polydipsie a été observée chez tous les chevaux et une amélioration de la fourbure a été observée dans 81 % des cas. Aucun effet secondaire n’a été décrit. La posologie actuellement recommandée est de 1 mg/kg/j.
Le traitement avec le trilostane est onéreux et n’a pas fait la preuve de sa supériorité par rapport au pergolide.
Poivre des moines (Vitex agnus-castus)
Chez le rat, il a été démontré que l’extrait de poivre des moines se fixe sur les récepteurs D2 de l’hypophyse et inhibe la production de prolactine[60]. Ce produit nutraceutique n’a fait l’objet d’aucune standardisation du « principe actif » (les facteurs environnementaux et la maturité du fruit influent sur la composition chimique de l’extrait), ni d’aucune évaluation de l’activité biologique ou de la biodisponibilité chez le cheval. Toutefois, certains propriétaires trouvent que ce produit fait du bien à leurs chevaux.
Poivre des moines vs pergolide
Le UK Horse Journal a mené une étude terrain sur 10 chevaux âgés de 13 à 25 ans présentant des signes de DPIP. Le journal rapporte que l’amélioration des signes cliniques a commencé après 3 semaines et qu’elle était « rapide et spectaculaire ». Les résultats de cette étude ont ensuite été contredits par ceux de l’étude menée par l’université de Pennsylvanie.
Étude comparative entre le poivre des moines et le pergolide[61]
L’université de Pennsylvanie a mené une étude comparant le poivre des moines et le pergolide[61]. L’étude d’efficacité du poivre des moines devait initialement durer 6 mois, mais elle a été écourtée en raison de la dégradation des signes cliniques observée chez 14 chevaux traités. Après l’arrêt du poivre des moines, 9 de ces chevaux ont été placés sous pergolide. Le pergolide a montré un effet bénéfique chez 8 d’entre eux. L’étude a montré que le poivre des moines n’avait pas d’effet bénéfique chez les chevaux atteints de DPIP.
Utilisation long terme du poivre des moines
Le Laminitis Trust a évalué l’administration prolongée du poivre des moines. Cent vingt chevaux et poneys ont été inclus dans une étude qui a débuté en . Seuls les résultats préliminaires de 25 chevaux ont été publiés et aucune tendance à la normalisation des taux d’eACTH n’a été observée chez ces animaux. Les chevaux ont montré une certaine amélioration de leur comportement et de leur pelage.
Il n’existe aucune étude sur l’association du poivre des moines et d’un traitement pharmaceutique de la DPIP.
Traitements complémentaires et mesures préventives
Les traitements complémentaires visent à soutenir l’état général du cheval âgé. Ils sont particulièrement indispensables :
- pendant le premier mois de traitement
- en attendant que le pergolide résolve les signes cliniques
- pour les chevaux que les propriétaires décident de ne pas traiter
Voici quelques exemples de mesures thérapeutiques et préventives adjuvantes :
- Changement fréquent de la litière ou renouvellement constant afin de prévenir l’humidité dans les boxes due à l’augmentation des mictions
- Denture : les chevaux âgés ont des surfaces dentaires trop usées et n’arrivent plus à broyer le grain ou à mâcher le foin. Leurs dents doivent être régulièrement examinées car une mauvaise digestion des aliments peut entraîner une malnutrition voire une obstruction intestinale
- Pelage : une tonte régulière des chevaux atteints de DPIP est recommandée car elle favorise la thermorégulation et permet de prévenir les problèmes de peau
- Parage régulier des pieds
- Vermifugation après coproscopie régulière • Vaccination régulière
- Distribution régulière d’eau fraîche
- Alimentation adaptée
- Visite vétérinaire annuelle ou semestrielle
Notes et références
Liens externes
Références
- Dybdal NO, Hargreaves KM, Madigan JE, Gribble DH, Kennedy PC, Stabenfeldt GH. Diagnostic testing for pituitary pars intermedia dysfunction in horses. J Am Vet Med Assoc 1994;204:627-632
- Orth DN, Holscher MA, Wilson MG, Nicholson WE, Plue RE, Mount CD . Equine Cushing's disease: plasma immunoreactive proopiolipomelanocortin peptide and cortisol levels basally and in response to diagnostic tests. Endocrinology 1982;110:1430-1441
- Schott HC. Pituitary pars intermedia dysfunction: equine Cushing's disease. Vet Clin North Am Equine Pract 2002;18:237-270
- Granger, L. Equine 2005 Part I: Baseline Reference of Equine Health and Management, 2005. 2006. United States Department of Agriculture Animal and Plant Health Inspection Service Veterinary Services National Animal Health Monitoring System . Ref Type: Report
- Mellor DJ, Love S, Gettinby G, Reid SWJ . Demographic characteristics of the equine population of northern Britain. Veterinary Record 1999;145:299-304
- McFarlane D, Sellon DC, Gibbs SA . Age-related quantitative alterations in lymphocyte subsets and immunoglobulin iso- types in healthy horses . Am J Vet Res 2001;62:1413-1417
- McKeever KH, Malinowski K . Exercise capacity in young and old mares . Am J Vet Res 1997;58:1468-1472
- Ireland, J . The geriatric equine population: Demographics, health and disease . British Equine VeterinaryAssociation CongressBEVA 48th, 141 . 2009 . Ref Type: Conference Proceeding
- Brosnahan MM, Paradis MR . Assessment of clinical charac- teristics, management practices, and activities of geriatric horses . J Am Vet Med Assoc 2003;223:99-103
- Paradis MR. Demographics of health and disease in the geriatric horse . Vet Clin North Am Equine Pract 2002;18:391-401.
- van der Kolk JH, Kalsbeek HC, van GE, Wensing T, Breukink HJ. Equine pituitary neoplasia: a clinical report of 21 cases (1990-1992). Vet Rec 1993;133:594-597.
- Evans,D.R.The Recognition and Diagnosis of a Pituitary Tumor in the Horse. AAEP Annual Convention Proceeding 18th, 417-418. 1972. Ref Type: Conference Proceeding
- McGowan,T.M.,Hodgson,D.R., and McGowan, C.M. The Prevalence of Equine Cushing's Syndrome in aged Horses. American College of Veterinary Internal Medicine - Research Abstracts 25th, 603. 2007. Ref Type: Conference Proceeding
- Donaldson MT, McFarlane D, Jorgensen AJ, Beech J . Correlation between plasma alpha-melanocyte-stimulating hormone concentration and body mass index in healthy horses . Am J Vet Res 2004;65:1469-1473
- Donaldson MT, LaMonte BH, Morresey P, Smith G, Beech J . Treatment with pergolide or cyproheptadine of pituitary pars intermedia dysfunction (equine Cushing's disease) . J Vet Intern Med 2002;16:742-746
- HeinrichsM,BaumgartnerW,CapenCC .Immunocytochemical demonstration of proopiomelanocortin-derived peptides in pituitary adenomas of the pars intermedia in horses . Vet Pathol 1990;27:419-425
- Frank N, Andrews FM, Sommardahl CS, Eiler H, Rohrbach BW, Donnell RL . Evaluation of the combined dexamethasone suppression/ thyrotropin-releasing hormone stimulation test for detection of pars intermedia pituitary adenomas in horses . J Vet Intern Med 2006;20:987-993
- Wright,A.M. Pharmacokinetics of Pergolide in normal Mares. 2009. Ref Type: Thesis/Dissertation
- Froin HR, Assmann G, Hoppen HO. Das equine Cushing-Syndrom. Der praktische Tierarzt, collegium veterinarium 1998;XXVIII:16-21.
- SalandLC. The mammalian pituitary intermediate lobe: an update on innervation and regulation. Brain Research Bulletin 2001;54:587-593
- McFarlane D. Pituitary and Hypothalamus. In Smith BP, editor. Large Animal Internal Medicine. Mosby/Elsevier, 2008:1339-1344
- Beech J, Boston R, Lindborg S, Russell GE. Adrenocorticotropin concentration following administration of thyrotropin-releasing hormone in healthy horses and those with pituitary pars intermedia dysfunction and pituitary gland hyperplasia. J Am Vet Med Assoc 2007;231:417-426
- Beech J, Garcia M. Hormonal response to thyrotropin-releasing hormone in healthy horses and in horses with pituitary adenoma. Am J Vet Res 1985;46:1941-1943
- McFarlane D, Beech J, Cribb A. Alpha-melanocyte stimulating hormone release in response to thyrotropin releasing hormone in healthy horses, horses with pituitary pars intermedia dysfunction and equine pars intermedia explants. Domest Anim Endocrinol 2006;30:276-288
- Eiler H, Oliver JW, Andrews FM, Fecteau KA, Green EM, McCracken M. Results of a combined dexamethasone suppression/thyrotropin-releasing hormone stimulation test in healthy horses and horses suspected to have a pars intermedia pituitary adenoma. J Am Vet Med Assoc 1997;211:79-81
- Considine RV. The Adrenal Gland. In Rhoades RA, Bell DR, editors. Medical Physiology: principles for clinical medicine. Lippincott Williams & Wilkins, 2009:624-640
- Ellacott KL, Cone RD. The role of the central melanocortin system in the regulation of food intake and energy homeostasis: lessons from mouse models. Philos Trans R Soc Lond B Biol Sci 2006;361:1265-1274
- McFarlane D, Donaldson MT, McDonnell SM, Cribb AE. Effects of season and sample handling on measurement of plasma alpha-melanocyte-stimulating hormone concentrations in horses and ponies. Am J Vet Res 2004;65:1463-1468
- Beech J, Boston RC, McFarlane D, Lindborg S. Evaluation of plasma ACTH, alpha-melanocyte-stimulating hormone, and insulin concentrations during various photoperiods in clinically normal horses and ponies and those with pituitary pars intermedia dysfunction. J Am Vet Med Assoc 2009;235:715-722
- McFarlane, D. Role of the Equine Hypothalamic-Pituitary Pars Intermedia Axis in Health and Disease. American Association of Equine Practitioners. AAEP Annual Conven- tion Proceeding 52th, 55-59. 2006. Ref Type: Conference Proceeding
- Marshall JB, Kapcala LP, Manning LD, McCullough AJ. Effect of corticotropin-like intermediate lobe peptide on pancreatic exocrine function in isolated rat pancreatic lobules. J Clin Invest 1984;74:1886-1889
- Millington WR, Dybdal NO, Dawson R, Jr., Manzini C, Muel- ler GP. Equine Cushing's disease: differential regulation of beta-endorphin processing in tumors of the intermediate pituitary. Endocrinology 1988;123:1598-1604
- Haritou SJ, Zylstra R, Ralli C, Turner S, Tortonese DJ. Seasonal changes in circadian peripheral plasma concentrations of melatonin, serotonin, dopamine and cortisol in aged horses with Cushing's disease under natural photoperiod. J Neuroendocrinol 2008;20:988-996
- McFarlane D, Dybdal N, Donaldson MT, Miller L, Cribb AE. Nitration and increased alpha-synuclein expression associated with dopaminergic neurodegeneration in equine pituitary pars intermedia dysfunction. J Neuroendocrinol 2005;17:73-80
- McFarlane D. Advantages and limitations of the equine disease, pituitary pars intermedia dysfunction as a model of spontaneous dopaminergic neurodegenerative disease. Ageing Res Rev 2007;6:54-63
- van der Kolk JH, Heinrichs M, van Amerongen JD, Stooker RC, in de Wal LJ, van d, I. Evaluation of pituitary gland anatomy and histopathologic findings in clinically normal horses and horses and ponies with pituitary pars intermedia adenoma. Am J Vet Res 2004;65:1701-1707
- Miller MA, Pardo ID, Jackson LP, Moore GE, Sojka JE. Correlation of pituitary histomorphometry with adrenocorticotrophic hormone response to domperidone administration in the diagnosis of equine pituitary pars intermedia dysfunction. Vet Pathol 2008;45:26-38
- Boujon CE, Bestetti GE, Meier HP, Straub R, Junker U, Rossi GL. Equine pituitary adenoma: a functional and morpho- logical study. J Comp Pathol 1993;109:163-178.
- van der Kolk JH, Ijzer J, Overgaauw PA, van der Linde- Sipman JS. Pituitary-independent Cushing's syndrome in a horse. Equine Vet J 2001;33:110-112
- Donaldson MT, Jorgensen AJ, Beech J. Evaluation of suspected pituitary pars intermedia dysfunction in horses with laminitis. J Am Vet Med Assoc 2004;224:1123-1127
- Johnson PJ, Messer NT, Ganjam VK. Cushing's syndromes, insulin resistance and endocrinopathic laminitis. Equine Vet J 2004;36:194-198
- Asplin KE, Sillence MN, Pollitt CC, McGowan CM. Induction of laminitis by prolonged hyperinsulinaemia in clinically normal ponies. The Veterinary Journal 2007;174:530-535
- Asplin KE, Curlewis JD, McGowan CM, Pollitt CC, Sillence MN. Glucose transport in the equine hoof. Equine Vet J 2010;early view
- de Laat MA, McGowan CM, Sillence MN, Pollitt CC. Equine laminitis: Induced by 48 h hyperinsulinaemia in Standardbred horses. Equine Veterinary Journal 2010;42:129-135
- Johnson PJ, Messer NT, Slight SH, Wiedmeyer CE, Ganjam SK. Endocrinopathic Laminitis in the Horse. Clinical Techniques in Equine Pratice 2004;3:45-56
- Fey K, Jonigkeit E, Moritz A. Zum equinen Cushing-Syndrom (ECS): Fallbericht, Literaturauswertung zu Diagnostik und Therapie sowie wesentliche Unterschiede zum Cushing- Syndrom des Hundes. Tierarztl Prax Ausg G Grosstiere Nutztiere 1998;26:41-47
- McGowan C. Diagnostic and management protocols for equine Cushing's syndrome. In Pract 2003;25:586-592
- McGowan, T. W. Aged Horse Health, Management and Welfare. 2010.RefType:Thesis/Dissertation
- Schott, H. C. Pars Pitutitary Intermedia Dysfunction: Challenges of Diagnosis and Treatment. American Association of Equine Practitioners. AAEP Annual Convention Proceeding 52th, 60-73. 2006. Ref Type: Conference Proceeding
- McGowan CM, Frost R, Pfeiffer DU, Neiger R. Serum insulin concentrations in horses with equine Cushing's syndrome: response to a cortisol inhibitor and prognostic value. Equine Vet J 2004;36:295-298
- Frank N. Equine Metabolic Syndrome. J Equine Vet Sci 2009;29:259-267
- Frank N, Geor RJ, Bailey SR, Durham AE, Johnson PJ. Equine metabolic syndrome. Journal of Veterinary Internal Medicine 2010;24:467-475
- The PPID Working Group Consensus, Frank Andrews, Ben Buchanan, Andy Durham, Nicholas Frank, Janice Kritchevsky, Dianne McFarlane, and Hal Schott, Septembre 2011. in press
- Copas and Durham, EVJ, sous presse 2011
- Beech J. Diseases of the pituitary gland. Equine Medicine and Surgery. St.Louis: Mosby, 1999:1951-1967
- Schott,H.C.,Coursen,C.L.,Eberhart,S.W.,Nachreiner,N. J., Refsal, K. R., Ewart, S. L., and Marteniuk, J. V. The Michigan Chushing's Project. Americna Association of Equine Practitioners. AAEP Annual Convention Proceeding 47th, 22-24. 2001. Ref Type: Conference Proceeding
- Love S. Equine Cushing's disease. Br Vet J 1993;149:139-153
- Toribio RE. Pars intermedia dysfunction (equine Cushing's disease). Equine Internal Medicine. Saunders, 2004:1327-1337
- McGowan CM, Neiger R. Efficacy of trilostane for the treatment of equine Cushing's syndrome. Equine Vet J 2003;35:414-418
- Sliutz G, Speiser P, Schultz AM, Spona J, Zeillinger R. Agnus castus extracts inhibit prolactin secretion of rat pituitary cells. Horm Metab Res 1993;25:253-255
- Beech, J., Donaldson, M.T., and Lindborg, S. Comparison of Vitex agnus castus Extract and Pergolide in Treatment of Equine Cushing's Syndrome. AAEP Annual Convention Proceeding 48, 175-177. 2002. Ref Type: Conference Proceeding
- Portail équestre
- Portail de la médecine vétérinaire