Tyrosinase
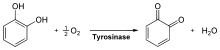
La tyrosinase (ou catéchol oxydase ou monophénol monooxygénase) est une oxydoréductase qui catalyse l'oxydation des phénols, comme la tyrosine :
- (1a) L-tyrosine + ½ O2 L-DOPA
- (1b) L-DOPA + ½ O2 dopaquinone + H2O
- (2) 2 L-DOPA + O2 2 dopaquinone + 2 H2O
| Tyrosinase | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | TYR | |
| Synonymes | Monophénol monooxygénase, OCA1, OCA1A, OCAIA | |
| N° EC | 1.14.18.1 | |
| Homo sapiens | ||
| Locus | 11q14.314.3 | |
| Masse moléculaire | 60 393 Da[1] | |
| Nombre de résidus | 529 acides aminés[1] | |
| Entrez | 7299 | |
| HUGO | 12442 | |
| OMIM | 606933 | |
| UniProt | P14679 | |
| RefSeq (ARNm) | NM_000372.4 | |
| RefSeq (protéine) | NP_000363.1 | |
| Ensembl | ENSG00000077498 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme intervient dans deux réactions distinctes de biosynthèse de la mélanine : l'hydroxylation d'un monophénol et la conversion d'un o-diphénol en o-quinone, laquelle conduisant à la mélanine[2]. Elle est très répandue chez les plantes, les animaux et les mycètes. Chez l'homme, elle est codée par le gène TYR, situé sur le chromosome 11[3], et exprimée dans les mélanosomes, organite des mélanocytes. Certaines mutations du gène TYR sont responsables de la forme 1 de l'albinisme oculocutané (OCA1), maladie génétique rare dont l'incidence globale est estimée à environ un cas pour 17 000 personnes.
Elle comprend un cation de cuivre Cu2+ comme cofacteur. Elle catalyse la production de mélanine et d'autres pigments par oxydation à partir de la tyrosine, comme lorsqu'une pomme de terre pelée ou découpée en tranches noircit à l'air libre[4].
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Cu2+ |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Réactions catalysées
La tyrosinase peut catalyser deux types de transformation successives :
- l'oxydation, en présence d'oxygène, d'un monophénol en catéchol : on parle alors d'une activité crésolase ;
- l'oxydation, en présence d'oxygène, de ce catéchol en o-quinone ou benzoquinone : on parle alors d'une activité catécholase.
Elle est présente dans le vin, le dioxyde de soufre ajouté par le viticulteur permettant de la désactiver.
- Synonymes : crésolase, monophénol oxydase, phénolase, tyrosinase
- Maladies génétiques liées :
- Albinisme oculo-cutané type I (OCA1) MIM:203100
- Albinisme oculocutané de type IB (OCA1B) MIM:606952
- Albinisme oculaire avec surdité sensorineural MIM:103470
Une catéchol oxydase (en) est une enzyme apparentée dépourvue d'activité crésolase et qui ne catalyse que l'oxydation d'un catéchol en benzoquinone à travers une activité catécholase.
- Synonymes : diphénol oxydase, o-diphénolase (lire ortho-diphénolase), phénolase, polyphénol oxydase, tyrosinase.
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) C. Mahendra Kumar, U. V. Sathisha, Shylaja Dharmesh, A. G. Appu Rao et Sridevi A. Singh, « Interaction of sesamol (3,4-methylenedioxyphenol) with tyrosinase and its effect on melanin synthesis », Biochimie, vol. 93, no 3, , p. 562-569 (PMID 21144881, DOI 10.1016/j.biochi.2010.11.014, lire en ligne)
- (en) David E. Barton, Byoung S. Kwon et Uta Francke, « Human tyrosinase gene, mapped to chromosome 11 (q14 → q21), defines second region of homology with mouse chromosome 7 », Genomics, vol. 3, no 1, , p. 17-24 (PMID 3146546, DOI 10.1016/0888-7543(88)90153-X, lire en ligne)
- (en) Lucas H. Stevens, Evert Davelaar, Ria M. Kolb, Ed J. M. Pennings et Nico P. M. Smit, « Tyrosine and cysteine are substrates for blackspot synthesis in potato », Phytochemistry, vol. 49, no 3, , p. 703-707 (DOI 10.1016/S0031-9422(98)00207-6, lire en ligne)
- Portail de la biochimie