الأيزومرات (المتشكلات الفراغية)
في الكيمياء الفراغية، تعتبر الأيزومرية الفراغية، أو الأيزومرية المكانية، شكلاً من أشكال التماثل حيث يكون للجزيئات نفس الصيغة الجزيئية وتسلسل الذرات المترابطة (تكوين)، ولكنها تختلف في الاتجاهات ثلاثية الأبعاد لذراتها في الفراغ.[1] [2] يتناقض هذا مع الأيزومرات الهيكلية، التي تشترك في نفس الصيغة الجزيئية، لكن روابط الرابطة أو ترتيبها يختلف. بالتعريف، تمثل الجزيئات التي تكون متجانسة مجسمة لبعضها البعض نفس الأيزومر الهيكلي.
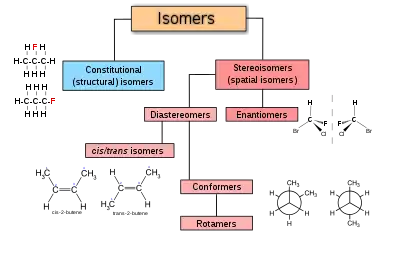
المصاوغات المرآتية - Enantiomers
المصاوغات المرآتية -Enantiomers ، المعروف أيضًا باسم المتقابلات الضوئية ، عبارة عن اثنين من الأيزومرات الفراغية التي ترتبط ببعضها البعض عن طريق الانعكاس: إنها صور معكوسة لبعضها البعض غير قابلة للتركيب. الأيدي البشرية هي التناظرية العيانية لهذا. كل مركز فراغي في أحدهما له التكوين المعاكس في الآخر. يمتلك مركبان متماثلان لبعضهما البعض نفس الخصائص الفيزيائية، باستثناء الاتجاه الذي يدوران فيه الضوء المستقطب وكيفية تفاعلهما مع أيزومرات بصرية مختلفة لمركبات أخرى. نتيجة لذلك، قد يكون للمركبات المتشابهة المختلفة تأثيرات بيولوجية مختلفة إلى حد كبير. تُظهر المتشكلات النقية أيضًا ظاهرة النشاط البصري ولا يمكن فصلها إلا باستخدام عامل الكيرالي (اللاتناظر المرآتي) . في الطبيعة، يوجد متماثل واحد فقط من معظم المركبات البيولوجية الكيرالية، مثل الأحماض الأمينية (باستثناء الجلايسين، وهو أكيرالي أو غير كيرالي). يظهر المركب النشط بصريًا شكلين: شكل D - (+) وشكل L - (-).
المصاوغات غير مرآوية - دياستيريومرز
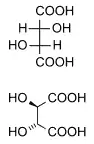
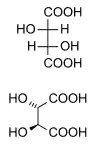
الدياستيريومرات هي إيزومرات مجسمة لا ترتبط بعملية الانعكاس إنها ليست صورًا معكوسة لبعضها البعض. وتشمل هذه مركبات الميزو، الأيزومرات الهندسية، أيزومرات EZ ، والأيزومرات الضوئية غير المتماثلة. نادرا ما يكون للديستيريومرات نفس الخصائص الفيزيائية. في المثال الموضح أدناه، يشكل شكل الميزو لحمض الطرطريك زوجًا ثنائيًا مع كل من أحماض levo و dextro tartaric ، والتي تشكل زوجًا متماثلًا.
 |
 |
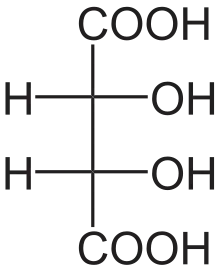 |
| حمض الطرطريك (طبيعي) L- (+) - حمض الطرطريك حمض ديكستروطرطريك | D - (-) - حمض الطرطريكحمض ليفو الطرطريك | حمض ميزو الطرطريك |
| (1: 1) حمض الطرطريك - DL "حمض راسيمي" | ||
إن وضع العلامات D - و L - للأيزومرات أعلاه ليس هو نفسه وضع d - and l - الذي يُنظر إليه بشكل أكثر شيوعًا، موضحًا لماذا قد تظهر معكوسة لمن هم على دراية باتفاقية التسمية الأخيرة فقط.[بحاجة لشرح]
ايزومرية الهندسية Cis – trans و EZ
تنشأ الأيزومرية الفراغية حول الروابط المزدوجة لأن الدوران حول الرابطة المزدوجة مقيد، مما يجعل البدائل ثابتة بالنسبة لبعضها البعض. إذا كان البديلان الموجودان على طرف واحد على الأقل من الرابطة المزدوجة متماثلين، فلا يكون هناك ايزومر فراغي والرابطة المزدوجة ليست مركزًا فراغيًا، على سبيل المثال البروبين، CH 3 CH = CH 2 حيث يكون البديلان في أحد طرفيه كلاهما H .
تقليديا، تم وصف الكيمياء الفراغية للرابطة المزدوجة على أنها إما رابطة cis (لاتينية، في هذا الجانب) أو trans (لاتينية، عبر)، في إشارة إلى الموضع النسبي للبدائل على جانبي الرابطة المزدوجة. أبسط الأمثلة على رابطة cis- trans هي ethenes 1,2 مزدوج الاستبدال، مثل dichloroethene isomers (C2H2Cl2) هو مبين أدناه.
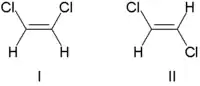
الجزيء الأول هو cis -1,2-dichloroethene والجزيء الثاني هو عبر -1,2-dichloroethene.
بسبب الغموض العرضي، اعتمدت IUPAC نظامًا أكثر صرامة حيث يتم إعطاء الأولوية للبدائل في كل طرف من الرابطة المزدوجة بناءً على العدد الذري. إذا كانت البدائل ذات الأولوية العالية على نفس الجانب من الرابطة، يتم تعيين (Ger. zusammen, together, معا) Z. إذا كانوا على جانبين متقابلين، فهو (Ger. entgegen, opposite, مقابل) E. نظرًا لأن الكلور يحتوي على عدد ذري أكبر من الهيدروجين، فهو يمثل المجموعة ذات الأولوية القصوى. باستخدام هذا الترميز لتسمية الجزيئات الموضحة أعلاه، يكون الجزيء الأول هو Z)-1,2-dichloroethene) والجزيءالثاني هو E) -1,2-dichloroethene). ليس الأمر كذلك أن Z و cis أو E و trans قابلة للتبادل دائمًا. ضع في اعتبارك الفلوروميثيل بنتين التالي:
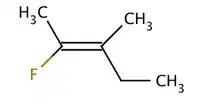
الاسم الصحيح لهذا الجزيء هو إما trans -2-fluoro-3-methylpent-2-ene لأن مجموعات الألكيل التي تشكل السلسلة الأساسية (مثل الميثيل والإيثيل) تتواجد عبر الرابطة المزدوجة من بعضها البعض، أو (Z(-2-fluoro-3-methylpent-2-ene لأن المجموعات ذات الأولوية القصوى على كل جانب من الرابطة المزدوجة تقع على نفس الجانب من الرابطة المزدوجة. الفلورو هي المجموعة ذات الأولوية القصوى على الجانب الأيسر من الرابطة المزدوجة، والإيثيل هي المجموعة ذات الأولوية القصوى على الجانب الأيمن من الجزيء.
يتم استخدام المصطلحين cis و trans أيضًا لوصف الموضع النسبي لبديلين على حلقة؛ رابطة cis إذا كانت على نفس الجانب، وإلا trans.
ايزومرات متطابقة - Conformers
التماثل التوافقي هو شكل من أشكال التماثل الذي يصف ظاهرة الجزيئات التي لها نفس الصيغة الهيكلية ولكن بأشكال مختلفة بسبب الدوران حول رابطة واحدة أو أكثر. يمكن أن يكون للتشكيلات المختلفة طاقات مختلفة، ويمكن أن تتحول عادة، ونادرًا ما تكون قابلة للعزل. على سبيل المثال، يمكن أن يوجد الهكسان الحلقي في مجموعة متنوعة من التشكيلات المختلفة بما في ذلك شكل الكرسي وتشكل القارب، ولكن بالنسبة إلى الهكسان الحلقي نفسه، لا يمكن فصلهما مطلقًا.[بحاجة لمصدر] يمثل شكل القارب الطاقة القصوى في مسار رحلة مطابقة بين شكلي الكرسي المكافئين؛ ومع ذلك، فإنه لا يمثل حالة الانتقال لهذه العملية، نظرًا لوجود مسارات منخفضة الطاقة.
هناك بعض الجزيئات التي يمكن عزلها في عدة تركيبات، بسبب حواجز الطاقة الكبيرة بين التكوينات المختلفة. 2,2 '، 6,6'-Tetrasubstitated biphenyls يمكن أن تندرج في هذه الفئة الأخيرة.
مصاوغ كربونيلي - Anomers
التصاوغ الكربونيلي - Anomerism هو هوية لهياكل الحلقة المفردة الرابطة حيث يحتاج "cis" أو "E" و "trans" أو "Z" (التماثل الهندسي) إلى تسمية البدائل على ذرة الكربون التي تعرض أيضًا هوية chirality ؛ لذلك تحتوي الأنومرات على ذرات كربون لها تماثل هندسي وتماثل بصري (Enantiomerism) على واحد أو أكثر من ذرات الكربون في الحلقة. تسمى الأنومرات «ألفا» أو «محورية» و «بيتا» أو «استوائية» عند استبدال بنية الحلقة الحلقية التي تحتوي على روابط مفردة بين ذرات الكربون في الحلقة، على سبيل المثال، مجموعة الهيدروكسيل، ومجموعة ميثيل هيدروكسيل، ومجموعة ميثوكسي أو مجموعة أخرى من البيرانوز أو الفورانوز وهي بدائل نموذجية للروابط الفردية ولكنها لا تقتصر على هذه البدائل. سيكون التماثل الهندسي المحوري عموديًا (90 درجة) على مستوى مرجعي وسيكون خط الاستواء بعيدًا عن الرابطة المحورية بمقدار 120 درجة أو ينحرف بمقدار 30 درجة عن المستوى المرجعي.[3]
أتروبيزومرات
الأتروبيزومرات هي إيزومرات مجسمة ناتجة عن دوران معوق حول روابط مفردة حيث يكون حاجز الإجهاد الفراغي للدوران مرتفعًا بما يكفي للسماح بعزل المطابقات.
المزيد من التعريفات
- الأيزومر الفراغي التكويني هو أيزومر مجسم لجزيء مرجعي له التكوين المعاكس في مركز مجسم (على سبيل المثال، R- مقابل S- أو E- مقابل Z-). هذا يعني أنه لا يمكن تحويل الأيزومرات التكوينية إلا عن طريق كسر الروابط التساهمية إلى المجسم، على سبيل المثال، عن طريق عكس تكوينات بعض أو كل اماكن المركز الفراغي في المركب.
- ومصاوغ صنوي epimer هو مصاوغ diastereoisomer لديه التكوين المعاكس في مكان واحدة فقط من المركز فراغي.
قاعدة Le Bel-van't Hoff
تنص قاعدة Le Bel-van't Hoff على أنه بالنسبة للبنية التي تحتوي على عدد n من ذرات الكربون غير المتماثلة، يوجد حد أقصى n2 من الأيزومرات الفراغية المختلفة الممكنة. كمثال، D -glucose هو ألدوهكسوز وله الصيغة C6H12O6. أربع من ذرات الكربون الست تكون مجسمة، مما يعني أن D -glucose هو واحد من 2 4 = 16 من الأيزومرات الفراغية المحتملة.
المراجع
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "stereoisomerism". Compendium of Chemical Terminology Internet edition.
- Columbia Encyclopedia. "Stereoisomers" in Encyclopedia.com, n.l., 2005, Link نسخة محفوظة 11 يناير 2021 على موقع واي باك مشين.
- Morrison and Boyd Organic Chemistry Sixth ed. pgs. 1170-1171 (ردمك 0-13-643669-2)
- بوابة الكيمياء