أيون هيدروكسيد
أيون هيدروكسيد هو أيون سالب الشحنة ، وهو ينشأ عند تفاعل قاعدة مع الماء . و صيغته الكيميائية تكون على الشكل OH−. وتكون ذرة الهيدروجين مرتبطة بذرة أكسجين في هذا الأيون ، وتكتسب ذرة الأكسجين إلكترونا إضافيا عما تمتلكه في الحالة الطبيعية (العدد الذري 8 ، حالة الأكسدة -2 ) ، ولذلك تكون له شحنة واحدة سالبة .
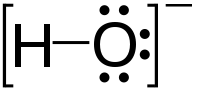
في الكيمياء الغير عضوية
تتفاعل قاعدة B مع الماء على النحو التالي:
ومن تركيز أيونات الهيدروكسيد يمكننا تعيين الأس الهيدروجيني (هاباء) في المحلول . ونبدأ ذلك بحساب «ثابت القاعدة» pOH .
ومنه نحصل على الأس الهيدروجيني pH-value:
وتتغير القيمة pKw بتغير درجة الحرارة . وقيمة pKw = 14 عند 22 درجة مئوية .[1]
حالة خاصة وهي حالة الماء النقي:
يتحل جزء من جزيئات الماء طبيعيا وتتفكك إلى أيونات هيدروكسيد OH (سالبة الشحنة ) وبروتونات H (موجبة). ويتغير عدد الجزيئات المتأينة بتغير درجة الحرارة.
وتوجد أيونات الهيدروكسيد في الماء النقي بتركيز 10−7 مول · لتر−1 عند 22 درجة مئوية . وهذا يعتمد على التحلل الطبيعي للماء (أوتوبروتوليز) طبقا للتفاعل التالي:
ويعتمد التوصيل الكهربائي للماء المقطر على حركة أيون أوكسونيوم و أيون الهيدروكسيد حيث ينتقلان في وجود مجال كهربائي. وهو كما نري من السهمين تفاعل عكوس ، بمعنى أن معدل سير التفاعل من اليسار إلى اليمين يساوي معدل سير التفاعل من اليمين إلى اليسار؛ فالتفاعل متوازن .
أمثلة لأملاح الهيدروكسيد
تسمى المركبات الحاوية على أيون هيدروكسيد بالهيدروكسيدات. أمثلة منها :
- هيدروكسيد الصوديوم NaOH
- هيدروكسيد البوتاسيوم KOH
- هيدروكسيد الكالسيوم Ca(OH)2
نظرا لأن الكالسيوم ثنائي التكافؤ فهو يرتبط بأيونين هيدروكسيد.
في الكيمياء العضوية
يستخدم أيون الهيدروكسيد لتركيب الكحوليات في الكيمياء. وتتكون الألكانولات (الألكانات الكحولية) من ألكان الهالوجينات .[2]
مراجع
- Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 300−301, ISBN 3-342-00280-8.