تكون الحيوانات المنوية
الإنطاف[1] أو تكوُّنُ الحيوانات المنويّة[2] أو تكون المني[3] أو عمليّة يتطوَّر فيها الحيوان المنويّ الحيّ (أو السبيرماتوزون) أحاديّ الصيغة الصبغيّة من خليّة جنسيّة (أو عروسيّة أو منتشة) في الأنابيب المنويّة للخصية. تبدأ هذه العمليّة بالانقسام التفتليّ لخلايا جذعيّة تقع بالقرب من الغشاء القاعديّ للأنابيب، وتُدعى هذه الخلايا بالخلايا الجذعيّة بزرة النطاف. ينتج عن هذا الانقسام التفتليّ نوعان من الخلايا. تسدُّ خلايا النمط A نقص الخلايا الجذعيّة، فيما تتمايز خلايا النمط B إلى خلايا نُطْفِيّة. تنقسم الخلايا النُطْفِيّة الأوليّة تفتليّاً (انقساماً مُنصِّفاً أولاً) إلى خليتين نُطفيّتين ثانويّتين، تنقسم بدورها كل خليّة نُطفيّة ثانويّة إلى أرومتين نطفيّتين أو طليعتين منويّتين أحاديتي الصيغة الصبغيّة بالانقسام المُنصّف الثاني. تتحول الأرومة النطفيّة إلى حيوانات منويّة (نِطاف) بعمليّة تكوُّن النِطاف. تتطوَّرُ هذه بدورها إلى حيوانات منويّة بالغة، تُعرف أيضاً باسم الخلايا المنويّة.[4] وهكذا، فإن الخليّة النُطْفِيّة الأوليّة ستعطي خليتين نطفيّتين ثانويّتين، وستعطي هذه الخليّتين النطفيّتين الثانويّتين بانقساماتهما الفرعيّة أربع حيوانات منويّة.[5]
تُمثِّلُ الحيوانات المنويّة الأعراس (أو الأمشاج) الذكريّة البالغة لدى العديد من الكائنات الحيّة المُتكاثرة جنسيّاً. وبالتالي، تُمثّل عمليّة تكوُّن النطاف النسخة الذكريّة من عمليّة تكوُّن الأعراس (أو تكوّن الأمشاج) ويقابلها عند الأنثى عمليّة تكوّن البيضة (أو البويضة). تحدث عمليّة تكون النطاف لدى الثدييات في الأنابيب المنويّة في خِصَى الذكور بطريقة مُتدرّجة. تعتمد هذه العمليّة بشكل كبير على الظروف المحيطة، وتتأثر بشدّة فيما لم تكن الظروف ملائمة، كما تُعتبر هذه العمليّة ضروريّة للتكاثر الجنسيّ. ويبدو أن عمليتي مثيلة الحمض النووي الريبوزي منقوص الأوكسجين DNA وتعديل الهستونات تدخلان في إطار تنظيم هذه العمليّة.[6] تبدأ هذه العمليّة في سن البلوغ، وتستمر عادةً دون انقطاع حتى الوفاة، رغم ملاحظة انخفاض طفيف في كميّة النطاف المُنتج مع التقدُّم بالعمر.
| تكون الحيوانات المنوية | |
|---|---|
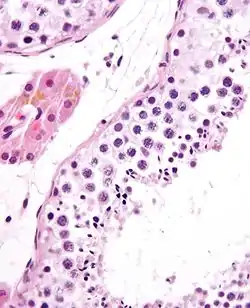 أنيبيب ناقل للمني ويظهر حيوان منوي ناضج. صبغة H&E. | |
 حيوان منوي بشري ناضج حيوان منوي بشري ناضج | |
| تفاصيل | |
| ن.ف.م.ط. | G04.152.650.624، وG08.686.784.310.760 |
| ن.ف.م.ط. | D013091 |
الهدف
تنتج عن عمليّة تكون النطاف أعراس ذكريّة بالغة تُعرف باسم النطاف وتُعرف على نحو أشهر بالحيوانات المنويّة، وتكون هذه الأعراس قادرة على إخصاب العرس الأنثويّ المُقابل وهو البويضة، وينتج عن هذا الإخصاب بيضة مُلقَّحة ستُعطي فيما بعد فرداً من النوع فيما لو حصلت عمليّة الحمل (إذا وصلت البيضة المُلقَّحة دون عوائق إلى الرحم) والولادة. وتُمثّل عمليّة الإخصاب حجر الزاويّة في التكاثر الجنسيّ وتتضمن مساهمة العرسين (أو المشيجتين) على حدٍ سواء بنصف مجموعة الصبغيّات (إذ تكونان أحاديتي الصيغة الصبغيّة) وينتج بيضة مُلقّحة كاملة الصبغيّات (ثنائية الصيغة الصبغيّة).
و بغية الحفاظ على عدد الصبغيات في النسل (و هو عدد يختلف بين الأنواع المختلفة)، ينبغي على كل عرس (مشيج) أن يمتلك نصف عدد الصبغيّات الموجود في خلايا الجسم الأُخرى، وإلا سيمتلك النسل اللاحق ضعفي العدد الطبيعيّ (في هذا النوع) من الصبغيّات، وستحدث تشوُّهات خطيرة. لدى البشر، تنتج التشوُّهات الصبغيّة من عمليّة تكوّن نطاف غير سويّة، إذ تحدث عيوب خلقيّة (مثل متلازمة داون ومتلازمة كلاينفلتر)، وفي كثير من الأحيان يحدث إجهاض تلقائيّ (عفويّ) للجنين.
مكان العملية لدى البشر
يحدث تكون النطاف في عدّة بنى في الجهاز التكاثريّ الذكريّ. إذ تحدث المراحل الأولى داخل الخصى وتتقدّم مراحل هذه العمليّة في البربخ، حيث تُخزَّن الأعراس حتى لحظة القذف. إذاً فالنُبيبات الناقلة للمني في الخصيّة هي نقطة الانطلاق لهذه العمليّة، إذ تبدأ الخلايا الجذعيّة بزرة النطاف المجاورة لجدار النبيبات الداخليّ بالانقسام باتجاه مركزيّ، إذ تبدأ من الجدران وتتجّه نحو اللمعة لتنتج نطافاً غير ناضجة.[4] بينما يحدث النضج في البربخ. يرتبط نجاح عمليّة تكون النطاف بموقع حدوث العمليّة [الخصيتان/كيس الصفن] بشدّة، إذ تتطلَّب هذه العمليّة درجة حرارة أخفض من درجة حرارة الجسم كي تكون النطاف الناتجة قادرة على الحياة، وتحديداً أخفض من درجة حرارة الجسم بدرجة إلى ثمان درجات مئويّة من حرارة الجسم الطبيعيّة (و التي تبلغ 37 درجة مئويّة).[7] سريرياً، لا تؤدي التقلُّبات الصغيرة في درجة الحرارة، كتلك الناتجة عن ارتداء حزام الدعم الرياضيّ إلى ضرر في عدد أو حيويّة النطاف.[8]
المدة
لدى البشر، تستغرق كامل عمليّة تكون النطاف حوالي 74 يوماً[9][10] (طبقاً لخزعات التريتيوم الموصوفة) وحوالي 12 يوماً[11] (طبقاً لقياسات ساعة الحمض النووي DNA). وتصل المدة إلى ثلاثة أشهر بحساب نقل النطاف في الأقنية الناقلة. تنتج الخصى حوالي 200 إلى 300 مليون حيوان منويّ يومياً.[12] رغم أن حوالي نصفها أو ما يُقارب 100 مليون نطفة فقط تكون قادرة على الحياة.[13]
المراحل
يمكن تقسيم كامل عمليّة الإنطاف إلى عدة مراحل منفصلة، ملائمة لنوع الخليّة. في الجدول التالي الصيغة الصبغيّة وعدد الصبغيّات لكل خليّة في سلسلة تكون النطاف، عموماً قبل اصطناع DNA والانقسام (في الطور G1 إن أمكن الثقول).باستثناء الخليّة النُطفيّة الأوليّة، إذ تُشاهد بعد اصطناع DNA وقُبيل الانقسام.
| نمط الخليّة | الصيغة الصبغيّة/الصبغيّات لدى البشر | عدد نُسخ DNA/الصُبيغيَّات لدى البشر | العمليّة التي ستدخلها هذه الخليّة |
| بِزْرَةُ النُّطْفَة (الأنماط Ad وAp وB) | ثنائيّة الصيغة الصبغيّة/46 صبغي | نسختان/46 صبغي | تَكَوُّن الخَلاَيا النُّطْفِيَّة (انقسام تفتُّلِيّ) |
| خليّة نُطفيّة أوليّة | ثنائيّة الصيغة الصبغيّة/46 صبغيّ | أربعة نسخ / 2x46 صُبيغيّ | تكوُّن الأرومة النطفيّة أو تكوّن الطليعة المنويّة (الانقسام المنصف الأول) |
| خليّتان نُطفيَّتان ثانويّتان | أحاديّة الصيغة الصبغيّة/23 صبغيّ | نسختان / 2x23 صُبيغيّ | تكوُّن الأرومة النطفيّة أو تكوّن الطليعة المنويّة (الانقسام المنصف الثاني) |
| أربع أرومات نطفيّة (طلائع منويّة) | أحاديّة الصيغة الصبغيّة/23 صبغيّ | نسخة واحدة/23 صُبيغيّ | تكوُّن النطاف |
| أربع نطاف (حيوانات منويّة) فعّالة وظيفياً | أحاديّة الصيغة الصبغيّة/23 صبغيّ | نسخة واحدة/23 صُبيغيّ | تنطُّف (إطلاق خلايا سيرتولي للنطاف) |
تكون الخلية النطفية
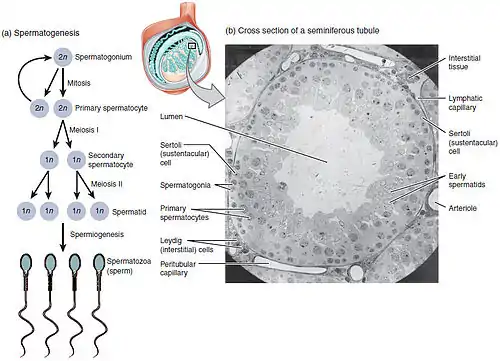
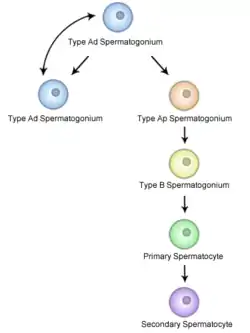
تُمثّل عمليّة تكوّن الخلايا النطفيّة الشكل الذكريّ من عمليّة تكون الخلايا العرسيّة، وتؤدي لتكوّن الخلايا النطفيّة الحاوية لنصف الكميّة الطبيعيّة للمادة الوراثيّة لا الصبغيّات. تكون الخلايا بزرة النطاف ثنائيّة الصيغة الصبغيّة، وتتوضّع بالقرب من جدران النُبيبات الالناقلة للمني، وتنقسم هذه الخلايا تفتليَّاً لتعطي خليتين متوسطتين (مرحلة متوسطة) ثنائيّة الصيغة الصبغيّة تُدعى الخلايا النطفيّة الأوليّة. تتحرك بعدها كل خليّة نطفيّة أوليّة إلى الجزء اللمعيّ من النُبيبات الناقلة للمني وتُضاعف حمضها النووي الريبوزيّ منقوص الأوكسجين DNA وتخضع بعدها لعمليّة انقسام مُنصّف أول لينتج خليَّتين نطفيّتين ثانويّتين أحاديتي الصيغة الصبغيّة، والتي ستنقسم كلُّ واحدةٍ منهما لاحقاً إلى أرومتين نطفيّتين (طليعتين منويَّتين) أحاديتي الصيغة الصبغيّة. يضمن هذا الانقسام مصدراً للتنوّع الوراثيّ كالتضمين العشوائيّ لصبغيّات الوالدين (عدم تلازم صبغيات أحد الأبوين في خلية ناتجة) والعبور الصبغيّ، وذلك بغية زيادة التنوّع الوراثيّ لأعراس الفرد.
يكون كل انقسام خلويّ بدءاً من بزرة النطاف وحتّى الأرومة النطفيّة غير كامل؛ إذ تبقى الخلايا متصلة واحدة بالأخرى بجسور من السيتوبلاسما للسماح بالتطوّر المتزامن. تجدر الإشارة أيضاً إلى عدم إنتاج خلايا نطفيّة من جميع بزر النطاف التي تنقسم؛ وإلا كانت ستُستنفد كميّة بزر النطاف الموجودة. وبدلاً من ذلك، تنقسم الخلايا الجذعيّة بزر النطاف تفتليَّاً لتعطي نُسخ منها، مما يضمن استمرار وجود بزر نطاف وبالتالي استمرار الإنطاف.[14]
تكون الطليعة المنوية
تتكوّن الأرومة النطفيّة من الخلايا النطفيّة الثانويّة. تدخل الخلايا النطفيّة الثانويّة التي أُنتجت باكراً في انقسام منصّف ثاني وتنقسم لتعطي أرومتين نطفيّتين أحاديتي الصيغة الصبغيّة. ونتيجةً لقصر هذه المرحلة وعدم تزامنها فإن عدد الخلايا النطفيّة الثانويّة قليلة ونادراً ما تُشاهد في الدراسات النسيجيّة.
تكون النطفة
تبدأ الخلايا النطفيّة خلال تكون النطاف بتشكيل ذيل لها عبر نمو الأنبيبات الدقيقة على أحد المُريكزات، والذي سيتحول إلى جسم قاعديّ. تُشكّل هذه النُبيبات الدقيقة خيطاً محوريّاً. لاحقاً يُعدَّل المريكز في عمليّة تخفيض الجسيم المركزيّ.[15] يتثخَّن الجزء الأماميّ للذيل (و الذي يُدعى القطعة المتوسطة) بسبب تراصف المُتقدِّرَات (الميتاكوندريا) حول الخيط المحوريّ لضمان تأمين الطاقة. أيضاً يتحزّم الحمض النووي الريبوزيّ منقوص الأوكسجين DNA للخلايا النطفيّة، ما يجعله شديد التكثُّف. يُحزّم أولاً الحمض النووي ببروتينات أساسيّة نوويّة نوعيّة، وتُستبدل لاحقاً ببروتامينات خلال تطاول الخلايا النطفيّة. يكون الكروماتين المحزوم بشدّة والناتج عمَّا سبق غير فعَّالاً . يحيط بعدها جهاز غولجي بالنواة المتكثِّفة للتو وينتج الجسيم الطرفيّ.
يحدث فيما بعد النضج بتأثير التستوستيرون، إذ يزيل هذا الهرمون الهَيولى والعُضيَّات المُتبقية غير الضروريّة. وبالنسبة للهيولى الزائدة، والتي تُعرف بالأجسام المُتبقية، فتُبلعم بواسطة خلايا سيرتولي المُحيطة في الخصى. أصبحت النطاف الناتجة الآن ناضجة ولكن مُفتقرة للقدرة على الحركة، ما يجعلها عقيمة، وتُطلق النطاف الناضجة إلى لمعة النُبيبات الناقلة للمني بواسطة خلايا سيرتولي بعمليّة تُدعى بالتنطُّف.
تُنقل النطاف غير القادرة على الحركة إلى البربخ، من خلال سائل خصيويّ تُفرزه خلايا سيرتولي عبر الانقباضات التمعُّجيّة. وتكتسب النطاف في البربخ القدرة على الحركة وتصبح حينها قادرة على التخصيب. ورغم ذلك تُنقل فيما بعد النطاف في بقيّة أجزاء الجهاز التكاثريّ الذكريّ بانقباض العضلات وليس بحركيّة النطاف التي اكتسبتها في البربخ.
دور خلايا سيرتولي

في جميع مراحل التمايز، تكون الخلايا ضمن سلسلة الإنطاف مرتبطة بشكل وثيق بخلايا سيرتولي والتي يُعتقد أنه تُقدّم الدعم الهيكليّ والاستقلابيّ للخلايا النطفيّة المتطوّرة. تمتد خلية سيرتولي من الغشاء القاعديّ إلى لمعة النُبيب المنويّ، رغم صعوبة تمييز النواتئ السيتوبلاسميّة في المجهر الضوئيّ.
تقوم خلايا سيرتولي بعدة وظائف خلال الإنطاف، فهي تدعم الأعراس (التي تخضع لعملية تطوير) بالطرق الآتية:
- تحافظ على البيئة الضروريّة للتطوّر والنضج، من خلال الحاجز الدمويّ الخصيويّ
- إفراز مواد تحرض بدء الانقسام المنصّف
- إفراز السائل الخصيويّ الداعم
- إفراز البروتين الرابط للأندروجين، والذي يقوم بتركيز التستوستيرون بالقرب من الأعراس المتنامية
- هناك حاجة للتستوستيرون بكميات عالية لصيانة السبيل التناسليّ، ويسمح هذا البروتين بمعدل أعلى من الخصوبة
- إفراز هرمونات تؤثر على تحكُّم الغدة النخامية بعملية الإنطاف، ولاسيّما ههرمون عديد الببتيد وهو الإنهيبين
- بلعمة الهَيولى الخلويّة المتبقية من عملية تكوّن النطاف (جزء من عملية الإنطاف)
- إفراز الهرمون المُضاد لمولر وهو هرمون يسبب تراجع قناة مولر[16]
- حماية الأرومات النطفيّة من الجهاز المناعي للذكور، من خلال الحاجز الدموي الخصيويّ
- المساهمة في تخصُّص الخلايا الجذعيّة بزرة النطاف
تمتلك جزيئات الالتصاق بين الخلويّة ICAM-1 وICAM-1 الذائبة تأثيرات مُناهضة للموصلات المُحكَمة مُشكِّلَةً الحاجز الدمويّ الخصيويّ.[17] تنظم جزيئات ICAM-2 التصاق الأرومات النطفيّة على الجانب القميّ من الحاجز (باتجاه اللمعة).[17]
عوامل مؤثرة
تُعتبر عمليّة الإنطاف عملية شديدة الحساسيّة، إذ تتأثر بتقلُّبات البيئة المحيطة بشدّة، لاسيّما الهرمونات ودرجة الحرارة. وتتطلَّب عمليّة الإنطاف تركيز عالٍ من التستوستيرون في الخصية لإتمام هذه العمليّة، ويتم الحفاظ على تركيز عالٍ من التستوستيرون فيها من خلال ربطه بالبروتين الرابط للأندروجين، وهو بروتين موجود في النُبيبات الناقلة للمني. يُذكر أن خلايا لايديغ هي الخلايا التي تقوم بإنتاج التستوستيرون، وهي خلايا بينيّة تتوضّع بالقرب من النُبيبات الناقلة للمني.
كما تكون الظهارة المنويّة شديدة الحساسيّة لارتفاع درجة الحرارة لدى البشر وبعض الأنواع الأُخرى، إذ يتأثر عمل هذه الخلايا إذا ما وصلت درجة حرارة الخصية إلى درجة حرارة الجسم الطبيعيّة، لذلك تقع الخصيتان خارج الجسم في كيس جلديّ يُدعى الصَفن. يتم الحفاظ على درجة الحرارة المثاليّة لعمل الخصيتين وهي أقل من درجة حرارة الجسم الطبيعيّة بدرجتين إلى ثمان درجات مئويّة. تُنظَّم درجة حرارة عبر تنظيم تدفُّق الدم[18] وضبط موقع الخصيتين من الجسم، سواءاً ابتعادهما عن الجسم أو اقترابهما بواسطة العضلة المُشَمِّرَة والعضلة الملساء في السلخ ضمن كيس الصفن.
كما تؤثر حالات العوز الغذائيّ (كعوز فيتامينات B وE وA) والستيرويدات الابتنائيّة والمعادن (كالكادميوم والرصاص) والتعرُّض للأشعة السينيّة والديوكسين والكحول والأمراض المعدية، تؤثر على الإنطاف. بالإضافة إلى ذلك، قد يتعرَّض الخط الجنسيّ (الإنتاشيّ) لأضرار في الحمض النووي الريبوزي منقوص الأوكسجين DNA بالإجهاد التأكسديّ، وقد يكون لهذه الأضرار آثار بارزة محتملة على الإخصاب والحمل.[19] كما قد يؤثّر التعرُّض للمبيدات الحشريّة على الإنطاف.[20]
التحكم الهرموني
يتنوّع التحكُّم الهرمونيّ في الإنطاف بين مختلف الأنواع. فلدى البشر لم تُفهم آلية التحكُّم الهرمونيّ بشكل كامل بعد، ومع ذلك معروفٌ حالياً أن بدء الإنطاف يحدث عند البلوغ بسبب التفاعل بين الوِطاء والغدة النخاميّة وخلايا لايديغ. وحتى إذا أُزيلت الغدة النخاميّة، يمكن بدء الإنطاف بتحريض الهرمون المُنبِّه للجريب FSH والتستوستيرون.[21] وعلى النقيض من الهرمون المُنبّه للجريب، فإن للهرمون المُلوتِن (المنشّط للجسم الأصفر) دورٌ صغير في الإنطاف عدا عن دوره الرئيسيّ في تحريض إنتاج التستوستيرون من الأقناد.[21][22]
يُحفِّزُ الهرمون المُنبه للجريب FSH كلٍّ من إنتاج البروتين الرابط للأندروجين بواسطة خلايا سيرتولي، وتشكيل الحاجز الدمويّ الخصيويّ. يُعتبر البروتين الرابط للأندروجين مهمّاً لزيادة تركيز التستوستيرون إلى تراكيز عالية بما فيه الكفاية لتناسب بدء الإنطاف وتحافظ عليه. تتراوح مستويات التستوستيرون داخل الخصية بين 20 إلى 100 أو 50 إلى 200 مرة أعلى من تركيزه الموجود في الدم، رغم أن هناك تنوُّعاً واختلافاً بين 5 إلى 10 أضعاف بين الرجال الأصحاء.[23][24] رغم أن الهرمون المُنبِّه للجريب FSH يبدأ في احتجاز التستوستيرون في الخصيتين، ولكن بمجرد تطوير التستوستيرون، يغدو التستوستيرون الشرط الوحيد المطلوب لصيانة عمليّة الإنطاف والمحافظة عليها.[21] ومع ذلك، فإن زيادة مستويات الهرمون المُنبِّه للجريب FSH ستزيد إنتاج الحيوانات المنويّة عبر منع موت الخلايا بزرة النطاف من النمط A. ويعمل كذلك هرمون الإنهيبين على إنقاص مستويات الهرمون المُنبّه للجريب FSH. تشير بعض الدراسات على القوارض إلى أن مُوجِّهَات الغدد التناسليّة (الهرمون المُنبّه للجريب FSH والهرمون المُلوتِن LH) تعمل على دعم عمليّة الإنطاف عبر كبت إشارات الموت المُبرمج وبالتالي تدعم بقاء خلايا بزرة النطاف.[25]
تتواسط خلايا سيرتوليّ نفسها أجزاءاً من عمليّة الإنطاف من خلال إنتاج هرمونات. فخلايا سيرتوليّ قادرةٌ على إنتاج هرمونات الإيستراديول والإنهيبين. كما أن خلايا لايديغ أيضاً قادرةٌ على إنتاج الإيستراديول إضافةً إلى منتجها الرئيسيّ وهو التستوستيرون. وقد وُجد أن الإستروجين ضروريّ لعمليّة الإنطاف في الحيوانات.[26][27] ومع ذلك، ففي حالة الرجل المُصاب بمتلازمة عدم الحساسيّة لهرمون الإيستروجين (إذ تكون مستقبلات الإيستروجين من النمط ألفا معيبة) ينتج الرجل عدداً من النطاف أقل من العدد الطبيعيّ، رغم أن انخفاض عدد النطاف بشكل غير طبيعيّ لا يحسم قضية العقم أو لا بشكل نهائيّ.[28] يمكن أن تُضرَّ المستويات المرتفعة جداً من الإيستروجين بعمليّة الإنطاف وذلك بسبب قمع إفراز مُوجّهات الغدد التناسليّة وعبر زيادة إنتاج التستوستيرون داخل الخصية.[29] يبدو أيضاً أن للبرولاكتين دوراً هاماً في الإنطاف.[22]
انظر أيضًا
مراجع
- المُعجم الطبيّ الموحّد
- ترجمة Spermatogenesis حسب بنك باسم للمصطلحات العلمية؛ مدينة الملك عبد العزيز للعلوم والتقنية، تاريخ الوصول: 05 02 2017.
- قاموس المورد، البعلبكي، بيروت، لبنان.
- Sharma S, Hanukoglu A, Hanukoglu I (2018)، "Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa."، Journal of Molecular Histology، 49 (2): 195–208، doi:10.1007/s10735-018-9759-2، PMID 29453757.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "The Spermatozoön, in Gray's Anatomy"، مؤرشف من الأصل في 1 تـمـوز 2018، اطلع عليه بتاريخ 07 أكتوبر 2010.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Song, Ning؛ Liu, Jie؛ An, Shucai؛ Nishino, Tomoya؛ Hishikawa, Yoshitaka؛ Koji, Takehiko (2011)، "Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis"، Acta Histochemica et Cytochemica، 44 (4): 183–90، doi:10.1267/ahc.11027، PMC 3168764، PMID 21927517.
- "scrotum". Encyclopædia Britannica. Encyclopædia Britannica Online. Encyclopædia Britannica Inc., 2015. Web. 14 Jan. 2015 <http://www.britannica.com/EBchecked/topic/530078/scrotum>. نسخة محفوظة 2015-04-29 على موقع واي باك مشين.
- "Effect of increased scrotal temperature on sperm production in normal men"، Fertil. Steril.، 68 (2): 334–9، 1997، doi:10.1016/s0015-0282(97)81525-7، PMID 9240266.
- "Kinetics of the germinal epithelium in man"، Recent Prog Horm Res، 20: 545–571، 1964.
- "The cycle of the seminiferous epithelium in humans: a need to revisit?"، J Androl، 29 (5): 469–487، 2008، doi:10.2164/jandrol.107.004655، PMID 18497337.
- "Elevated germline mutation rate in teenage fathers"، Proc R Soc B، 282: 20142898، 2015، doi:10.1098/rspb.2014.2898، PMC 4345458، PMID 25694621.
- Padubidri, VG؛ Daftary, SN, المحررون (2011)، Shaw's Textbook of Gynaecology (ط. 15th)، ص. 201، ISBN 978-81-312-2548-6.
- "Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production"، Biol. Reprod.، 29 (1): 207–15، 1983، doi:10.1095/biolreprod29.1.207، PMID 6615966.
- Fishelson, Lev؛ Gon, Ofer؛ Holdengreber, Vered؛ Delarea, Yakob (2007)، "Comparative spermatogenesis, spermatocytogenesis, and spermato-zeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei)"، The Anatomical Record، 290 (3): 311–23، doi:10.1002/ar.20412، PMID 17525946.
- Atypical centrioles during sexual reproduction Tomer Avidor-Reiss*, Atul Khire, Emily L. Fishman and Kyoung H. Jo Curr Biol. 2015 Nov 16;25(22):2956-63. doi: 10.1016/j.cub.2015.09.045. Epub 2015 Oct 17. http://journal.frontiersin.org/article/10.3389/fcell.2015.00021/full نسخة محفوظة 16 أبريل 2018 على موقع واي باك مشين.
- Hadley, Mac E.؛ Levine, Jon E. (2007)، Endocrinology (ط. 6th)، Upper Saddle River, NJ: Prentice Hall، ص. 369، ISBN 0-13-187606-6.
- Xiao, X.؛ Mruk, D. D.؛ Cheng, C. Y. (2013)، "Intercellular adhesion molecules (ICAMs) and spermatogenesis"، Human Reproduction Update، 19 (2): 167–86، doi:10.1093/humupd/dms049، PMC 3576004، PMID 23287428.
- Harrison, RG؛ Weiner, JS (1949)، "Vascular patterns of the mammalian testis and their functional significance"، The Journal of Experimental Biology، 26 (3): 304–16, 2 pl، PMID 15407652.
- Lewis, SE؛ Aitken, RJ (2005)، "DNA damage to spermatozoa has impacts on fertilization and pregnancy"، Cell and Tissue Research، 322 (1): 33–41، doi:10.1007/s00441-005-1097-5، PMID 15912407.
- Mehrpour, O؛ Karrari P (2014)، "Occupational exposure to pesticides and consequences on male semen and fertility: A review."، Toxicol Lett، 230: 146–156، doi:10.1016/j.toxlet.2014.01.029، PMID 24487096.
- William J. Kraemer؛ A. D. Rogol (15 أبريل 2008)، The Encyclopaedia of Sports Medicine: An IOC Medical Commission Publication, The Endocrine System in Sports and Exercise، John Wiley & Sons، ص. 286–، ISBN 978-0-470-75780-2، مؤرشف من الأصل في 26 يناير 2020.
- "Effects of drugs on the male and female reproductive systems"، Ann. Clin. Lab. Sci.، 15 (6): 451–8، 1985، PMID 4062226.
- Wolf-Bernhard Schill؛ Frank H. Comhaire؛ Timothy B. Hargreave (26 أغسطس 2006)، Andrology for the Clinician، Springer Science & Business Media، ص. 76–، ISBN 978-3-540-33713-3، مؤرشف من الأصل في 11 مايو 2016.
- Eberhard Nieschlag؛ Hermann M. Behre؛ Susan Nieschlag (26 يوليو 2012)، Testosterone: Action, Deficiency, Substitution، Cambridge University Press، ص. 130–، ISBN 978-1-107-01290-5، مؤرشف من الأصل في 14 أبريل 2019.
- Pareek, Tej K.؛ Joshi, Ayesha R.؛ Sanyal, Amartya؛ Dighe, Rajan R. (2007)، "Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists"، Apoptosis، 12 (6): 1085–100، doi:10.1007/s10495-006-0039-3، PMID 17268770.
- "Estrogen and spermatogenesis"، Endocr. Rev.، 22 (3): 289–318، 2001، doi:10.1210/edrv.22.3.0431، PMID 11399746.
- "Role of estrogens in spermatogenesis"، Front Biosci، 4: 1–11، 2012، PMID 22201851.
- Smith, Eric P.؛ Boyd, Jeff؛ Frank, Graeme R.؛ Takahashi, Hiroyuki؛ Cohen, Robert M.؛ Specker, Bonny؛ Williams, Timothy C.؛ Lubahn, Dennis B.؛ Korach, Kenneth S. (1994)، "Estrogen Resistance Caused by a Mutation in the Estrogen-Receptor Gene in a Man"، New England Journal of Medicine، 331 (16): 1056–1061، doi:10.1056/NEJM199410203311604، ISSN 0028-4793، PMID 8090165.
- Edmund S. Sabanegh, Jr. (20 أكتوبر 2010)، Male Infertility: Problems and Solutions، Springer Science & Business Media، ص. 83–، ISBN 978-1-60761-193-6، مؤرشف من الأصل في 13 يناير 2018.
مراجع للتوسع
- "The testes and spermatogenesis"، University of Wisconsin، 1998، اطلع عليه بتاريخ 27 نوفمبر 2006.[وصلة مكسورة]
- Johnson, L.؛ Blanchard, T.L.؛ Varner, D.D.؛ Scrutchfield, W.L. (1997)، "Factors affecting spermatogenesis in the stallion"، Theriogenology، 48 (7): 1199–216، doi:10.1016/S0093-691X(97)00353-1، PMID 16728209.
- Bardin, C.W. (1991)، "Pituitary-testicular axis"، في Yen, S.S.C.؛ Jaffee, R.B. (المحررون)، Reproductive Endocrinology (ط. 3rd)، Philadelphia: WB Saunders، ISBN 0721632068.
- Chambers, CV؛ Shafer, MA؛ Adger, H؛ Ohm-Smith, M؛ Millstein, SG؛ Irwin Jr, CE؛ Schachter, J؛ Sweet, R (1987)، "Microflora of the urethra in adolescent boys: Relationships to sexual activity and nongonococcal urethritis"، The Journal of Pediatrics، 110 (2): 314–21، doi:10.1016/S0022-3476(87)80180-4، PMID 3100755.
- Czyba, J.C.؛ Girod, C. (1980)، "Development of normal testis"، في Hafez, E.S.E. (المحرر)، Descended and Cryptorchid Testis، The Hague: Martinus Nijhoff، ISBN 9024723337.
- Whitmore Wf, 3rd؛ Karsh, L؛ Gittes, RF (1985)، "The role of germinal epithelium and spermatogenesis in the privileged survival of intratesticular grafts"، The Journal of Urology، 134 (4): 782–6، PMID 2863395.
روابط خارجية
- الإنطاف - الفيزيولوجيا التكاثريّة الذكريّة(بالإنجليزية)
- أنيمايشن لعمليّة الإنطاف(بالإنجليزية)
- بوابة علم الحيوان
- بوابة علم الجنس
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة طب
- بوابة علم الأحياء
- بوابة تشريح