حمض الزرنيخيك
حمض الزرنيخيك مركب كيميائي له الصيغة H3AsO4، كما يكتب على الشكل AsO(OH)3، ويكون على شكل بلورات بيضاء شفافة وعديمة الرائحة لها خاصة استرطاب عالية، لذلك فإنه غالباً ما يوجد على شكل محاليل مائية لصعوبة فصله عن هيدراته. تسمى أملاح حمض الزرنيخيك بالزرنيخات.
| حمض الزرنيخيك | |
|---|---|
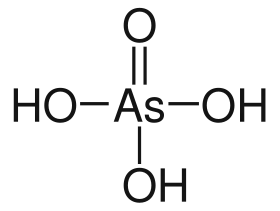 حمض الزرنيخيك | |
| الاسم النظامي (IUPAC) | |
حمض الزرنيخيك | |
| أسماء أخرى | |
حمض الزرنيخ الخماسي | |
| المعرفات | |
| رقم CAS | 7778-39-4 |
| بوب كيم (PubChem) | 234 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H3AsO4 |
| الكتلة المولية | 141.94 غ/مول |
| المظهر | بلورات بيضاء شفافة |
| الكثافة | 2.50 غ/سم3 |
| نقطة الانصهار | 35.5 °س |
| نقطة الغليان | ≥ 100 °س يتفكك |
| الذوبانية في الماء | 16.7 غ/100 مل ماء |
| الذوبانية | الكحول |
| حموضة (pKa) | 2.25 [3] |
| المخاطر | |
| ترميز المخاطر |  T T
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- يعد حمض الزرنيخيك من الأحماض اللاعضوية متوسطة القوة، وهو يقارن بخواصه مع حمض الفوسفوريك. لحمض الزرنيخيك ثلاثة بروتونات، وتكون ثوابت تفكك الحمض كالتالي:
- H3AsO4
 H2AsO−
H2AsO−
4 + H+ (K1 = 10−2.19) - H2AsO−
4 HAsO2−
HAsO2−
4 + H+ (K2 = 10−6.94) - HAsO2−
4 AsO3−
AsO3−
4 + H+ (K3 = 10−11.5)
- ينحل حمض الزرنيخيك في الماء بشكل متوسط، ولبلوراته قدرة على الاسترطاب حيث يشكل الهيدرات H3AsO4 · ½H2O بالإضافة إلى H3AsO4 · 2H2O. والتي يؤدي تسخينها إلى درجات حرارة تتجاوز 100°س إلى نزع جزيئات الماء من البنية،[4] إلا أنه يتفكك إلى أكسيد الزرنيخ الخماسي.
- يكون لحمض الزرنيخيك رباعية السطوح، لها مجموعة تناظر من النمط C3v، وتتراوح طول الرابطة As-O بين 1.66 إلى 1.71 Å.[5]
التحضير
يحضر حمض الزرنيخيك من حلمهة أكسيد الزرنيخ الخماسي، إلا أن التفاعل يكون بطيئاً وينزاح التوازن نحو الجهة اليسرى من التفاعل:
As2O5 + 3H2O ⇌ 2H3AsO4
يمكن إجراء عملية التحضير بطريقة أخرى وذلك بمعالجة فلز الزرنيخ أو أكسيده بحمض النتريك المركز، ونحصل في هذه الحالة على هيدرات حمض الزرنيخيك:
- As + 5HNO3 → H3AsO4 + 5NO2 + H2O
- As2O3 + 2HNO3 + 3H2O → 2H3AsO4.0.5H2O + N2O3
أما الهيدرات الثنائية (H3AsO4 . 2H2O) فلا يُحصل عليها إلا بإجراء عملية التبلور على عدة أيام وعند درجة حرارة منخفضة تصل إلى - 30°س.[6]
الاستخدامات
تنحصر استخدامات حمض الزرنيخيك في المختبرات الكيميائية وذلك نظراً لسميته. فهو يستخدم مثلاً لتحضير بعض مركبات الزرنيخ مثل حمض الأرسانيليك وذلك من التفاعل مع الأنيلين.
المراجع
- العنوان : Arsenic acid — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/234 — تاريخ الاطلاع: 17 نوفمبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/234
- المؤلف: Robert C. Weast — المحرر: Robert C. Weast — الناشر: سي آر سي بريس — الاصدار الأول — ISBN 978-0-8493-0740-9
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Lee, C.; Harrison, W. T. A. (2007)، "Tetraethylammonium dihydrogenarsenate bis(arsenic acid) and 1,4-diazoniabicyclo[2.2.2]octane bis(dihydrogenarsenate) arsenic acid: hydrogen-bonded networks containing dihydrogenarsenate anions and neutral arsenic acid molecules"، Acta Crystallographica، C63 (Pt 7): m308–m311، doi:10.1107/S0108270107023967، PMID 17609552.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 601.
- بوابة الكيمياء