ديورون
ديورون (3-(3،4-ثنائي كلورو فينيل)-1،1-ثنائي ميثيل يوريا) هو مبيد طحالب ومبيد أعشاب من فئة أريلوريا الذي يثبط التمثيل الضوئي. تم تقديمه بواسطة باير في عام 1954 تحت الاسم التجاري ديورون.
| ديورون | |
|---|---|
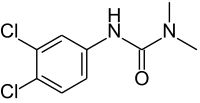 Skeletal formula of DCMU | |
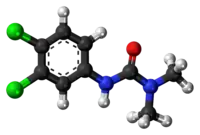 Ball-and-stick model of the DCMU molecule | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
N′-(3,4-Dichlorophenyl)-N,N-dimethylurea | |
| أسماء أخرى | |
3-(3,4-Dichlorophenyl)-1,1-dimethylurea, Karmex, Diuron, Direx | |
| المعرفات | |
| رقم CAS | 330-54-1 |
| بوب كيم (PubChem) | 3120 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C9H10Cl2N2O |
| كتلة مولية | 233.09 غ.مول−1 |
| المظهر | white crystalline solid[1] |
| الكثافة | 1.48 g/cm3 |
| نقطة الانصهار | 158 °س، 431 °ك، 316 °ف |
| نقطة الغليان | 180 °س، 453 °ك، 356 °ف |
| الذوبانية في الماء | 42 mg/L |
| ضغط البخار | 0.000000002 mmHg (20 °C)[1] |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | Warning |
| بيانات الخطر وفق GHS | H302, H351, H373, H400, H410 |
| بيانات وقائية وفق GHS | P201, P202, P260, P264, P270, P273, P281, P301+312, P308+313, P314, P330, P391, P405, P501 |
| نقطة الوميض | noncombustible |
| حد التعرض المسموح به U.S | none[1] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تاريخ
في عام 1952، حصل الكيميائيون في شركة دو بونت دي نيمور وشركاه على براءة اختراع لسلسلة من مشتقات أريل اليوريا كمبيدات أعشاب. تم تسويق العديد من المركبات التي تغطيها هذه البراءة كمبيدات أعشاب: مونورون (4-كلوروفنيل)، كلورتولون (3-كلورو-4-ميثيل فينيل) و ديورون، مثال (3،4-ثنائي كلورو فينيل).[2][3]
بعد ذلك، وصل أكثر من ثلاثين من نظائر اليوريا ذات الصلة بنفس آلية العمل إلى السوق في جميع أنحاء العالم.[4]
تركيب
كما هو موصوف في براءة اختراع دو بونت، فإن المادة الأولية عبارة عن أريل أمين بديل، أنيلين، يتم معالجته بالفوسجين لتكوين مشتق الأيزوسيانات. يتفاعل هذا لاحقًا مع ثنائي ميثيل أمين لإعطاء المنتج النهائي.[2]
- Aryl-NH2 + COCl2 → Aryl-NCO
- Aryl-NCO + NH(CH3)2 → Aryl-NHCON(CH3)2
آلية العمل
الديورون هو مثبط محدد وحساس للغاية لعملية التمثيل الضوئي. إنه يمنع موقع ربط تصفية كامل الجسم كينون صانعي للنظام الضوئي الثاني، مما يمنع تدفق الإلكترون من النظام الضوئي الثاني إلى الكينون الصانعي.[5] يقطع هذا سلسلة نقل الإلكترون في عملية التمثيل الضوئي وبالتالي يقلل من قدرة النبات على تحويل الطاقة الضوئية إلى طاقة كيميائية (أدينوسين ثلاثي الفوسفات وإمكانات الاختزال).
يعمل الديورون فقط على منع تدفق الإلكترون من النظام الضوئي الثاني، وليس له أي تأثير على النظام الضوئي الأول أو التفاعلات الأخرى في عملية التمثيل الضوئي، مثل امتصاص الضوء أو تثبيت الكربون في دورة كالفن.[بحاجة لمصدر]
ومع ذلك، نظرًا لأنه يمنع الإلكترونات الناتجة عن أكسدة الماء في النظام الضوئي الثاني من الدخول إلى تجمع البلاستوكينون، يتم إيقاف عملية التمثيل الضوئي «الخطي» بشكل فعال، حيث لا توجد إلكترونات متاحة للخروج من دورة تدفق الإلكترون في التمثيل الضوئي لتقليل NADP + إلى NADPH. في الواقع، وجد أن الديورون لا يثبط مسار التمثيل الضوئي الدوري فحسب، بل يحفزه بالفعل في ظل ظروف معينة.[6][7]
بسبب هذه التأثيرات، غالبًا ما يستخدم الديورون لدراسة تدفق الطاقة في عملية التمثيل الضوئي.
تسمم
تم وصف الديورون على أنه مادة مسرطنة معروفة/محتملة للإنسان بناءً على التجارب على الحيوانات.[8][9]
مراجع
- "NIOSH Pocket Guide to Chemical Hazards #0247"، المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- US patent 2655445, Todd C.W., "3-(Halophenyl)-1-methyl-1-(methyl or ethyl) ureas and herbicidal compositions and methods employing same", issued 1953-10-13, assigned to E. I. du Pont de Nemours & Co.
- Liu (2010)، "Phenylurea Herbicides"، Hayes' Handbook of Pesticide Toxicology، ص. 1725–1731، doi:10.1016/B978-0-12-374367-1.00080-X، ISBN 9780123743671.
- "Urea herbicides"، alanwood.net، مؤرشف من الأصل في 20 أبريل 2021، اطلع عليه بتاريخ 26 مارس 2021.
- Metz؛ Pakrasi؛ Seibert؛ Arntzer (1986)، "Evidence for a dual function of the herbicide-binding D1 protein in photosystem II"، FEBS Letters، 205 (2): 269، doi:10.1016/0014-5793(86)80911-5، S2CID 84205263.
- HUBER, S.C. EDWARDS, G.E. (1976), Studies on the Pathway of Cyclic Electron Flow in Mesophyll Chloroplasts of a C4 Plant, Biochimica et Biophysica Acta (BBA) - Bioenergetics, Volume 449, Issue 3, 6 December 1976, Pages 420-433, دُوِي:10.1016/0005-2728(76)90153-5
- Hosler؛ Yocum (أبريل 1987)، "Regulation of Cyclic Photophosphorylation during Ferredoxin-Mediated Electron Transport : Effect of DCMU and the NADPH/NADP Ratio"، Plant Physiol.، 83 (4): 965–9، doi:10.1104/pp.83.4.965، PMC 1056483، PMID 16665372.
- "Diuron"، National Center for Biotechnology Information، United States National Library of Medicine، مؤرشف من الأصل في 9 نوفمبر 2021، اطلع عليه بتاريخ 09 نوفمبر 2021.
- Linda؛ Esther (08 مايو 1997)، Carcinogenicity Peer Review of Diuron (PDF) (Memorandum)، Washington, D.C.: United States Environmental Protection Agency، مؤرشف من الأصل (PDF) في 18 مارس 2022.
- بوابة الكيمياء