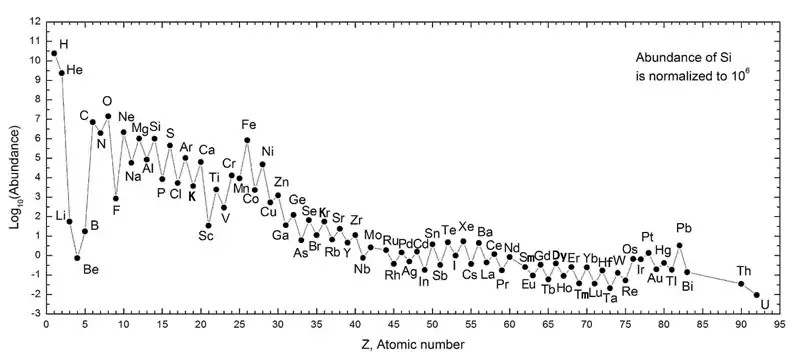
ذروة الحديد
ذروة الحديد هي الحد الأقصى المحلي في محيط (Cr, Mn, Fe, Co and Ni) Fe على الرسم البياني لوفرة العناصر الكيميائية، كما هو موضح أدناه.
بالنسبة لعناصر أخف من الحديد في الجدول الدوري، يطلق الاندماج النووي الطاقة بينما يستهلكها الانشطار. بالنسبة للحديد، ولكل العناصر الأثقل، يستهلك الاندماج النووي الطاقة، لكن الانشطار النووي يطلقه. يتم إنتاج العناصر الكيميائية حتى ذروة الحديد في التخليق الخلوي العادي. يتم إنتاج العناصر الأثقل فقط خلال عملية التركيب النووي للنواة الفائقة. هذا هو السبب في أن لدينا عناصر ذروة الحديد أكثر مما في الجوار.
الطاقة الرابطة
يوضح الرسم البياني أدناه طاقة الربط النووي لكل نواة (إجمالي طاقة الربط الكلية لكل جسيم دون الذري (البروتونات والنيوترونات) لعنصر معين) من عناصر «المفتاح» (لدراسة الانصهار والانشطار) السبعة التي يشار إليها في الرسم البياني باختصاراتها (4 تحوي أكثر من نظير واحد مشار إليه). يمكن اعتبار القيم المتزايدة للطاقة الملزمة بمثابة الطاقة المنبعثة عندما يتم إعادة ترتيب مجموعة من النوى في مجموعة أخرى يكون مجموع طاقات الربط النووي فيها أعلى. كما يتضح، فإن العناصر الضوئية مثل الهيدروجين تطلق كميات كبيرة من الطاقة (زيادة كبيرة في الطاقة الرابطة) عندما يتم دمجها لتشكيل نوى أثقل - عملية الانصهار. وعلى العكس، فإن العناصر الثقيلة مثل طاقة إطلاق اليورانيوم عند تحويلها إلى نوى أخف - عمليات تحلل ألفا والانشطار النووي. ##معادلة## هو الأكثر ملاءمة للديناميكا الحرارية في قلب النجوم عالية الكتلة (انظر أيضًا عملية حرق السيليكون). على الرغم من أن الحديد -58 والنيكل -62 يتمتعان بقدرة ربط أعلى (لكل النوكليون) ، لا يمكن تحقيق تخليقهما بكميات كبيرة لأن العدد المطلوب من النيوترونات لا يتوفر عادة في المواد النووية النجمية.
مراجع
- بوابة الكيمياء
- بوابة علم الفلك
- بوابة علم الكون