سرطانة الرئة صغيرة الخلايا المختلطة
سرطانة الرئة صغيرة الخلايا المختلطة (بالإنجليزية: Combined small-cell lung carcinoma) (يُطلق عليها نادرًا اسم سرطانة الرئة صغيرة الخلايا) هي نوع من سرطان الرئة متعدد الأطوار، والذي يشخّصه اختصاصي علم الأمراض عندما يكون الورم الخبيث الناتج من خلية متحولة في نسيج الرئة حاويًا على مكوّن من سرطانة الرئة صغيرة الخلايا (إس سي إل سي) مع مكون أو أكثر من سرطانة الرئة غير صغيرة الخلايا (إن إس سي إل سي).[1][2][3]
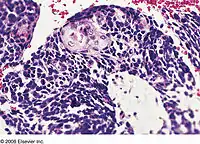
التصنيف
يندرج سرطان الرئة تحت عائلة الأورام الخبيثة عالية التجانس والتغاير. ميّزت مراجعة عام 2004 لنظام التصنيف الخاص بمنظمة الصحة العالمية 2004 («دبليو إتش أو-2004») أكثر من 50 نوعًا مختلفًا نسيجيًا، وهو نظام التصنيف الأوسع استخدامًا.[4] إن العديد من هذه الأنواع نادر، وحديث الوصف، وغير مفهوم بشكل جيد. ولكن بما أن الأنواع المختلفة من الأورام الخبيثة تتمتع بخواص سريرية وبيولوجية وجينية متنوعة، فإن التصنيف الدقيق لحالات سرطان الرئة أمر ضروري للتأكد من أن مرضى سرطان الرئة يتلقون العناية المثلى.[5][5][6]
إن نحو 99% من سرطانات الرئة هي سرطانة (كارسينوما)، وهو مصطلح يعني أن الورم الخبيث يتكون من خلايا من الأرومة الظهارية أو ينحدر منها (أي أنها مشتقة من الأديم الجنيني الباطن، كما في حالة سرطانة الرئة، أو من الأديم الظاهر)، و/أو أن الخلايا الخبيثة تمتلك مزايا تركيبية أو نسيجية أو جزيئية خاصة بالخلايا الظهارية. طبقًا لنظام التصنيف الخاص بمنظمة الصحة العالمية 2004، يمكن تقسيم سرطان الرئة إلى ثمانية تصانيف:[7]
- السرطانة حرشفية الخلايا
- السرطانة صغيرة الخلايا
- السرطانة الغدية
- السرطانة كبيرة الخلايا
- السرطانة الغدية الحرشفية
- السرطانة الساركومية
- الورم السرطاوي (الكارسينويد)
- السرطانة الشبيهة بالغدد اللعابية
تُعتبر سرطانة الرئة صغيرة الخلايا المختلطة أشد الأنواع الرئيسية من سرطان الرئة فتكًا، مع أسوأ إنذار على المدى البعيد وأسوأ معدل بقيا. كنتيجة لذلك، يُنصح بتصنيف أي ورم خبيث متعدد الأطوار في الرئة (أي الأورام التي لها أكثر من نمط نسيجي واحد) يحتوي على أي نسبة من خلايا سرطانة الرئة صغيرة الخلايا المختلطة، على أنه سرطانة رئة صغيرة الخلايا مختلطة، لا كنوع مختلط من أي صورة نسيجية أخرى موجودة في الورم. حاليًا، الاستثناء الوحيد لهذه التوصية هي الحالات التي يكون المكون النسيجي الثاني فيها هو سرطانة الرئة كبيرة الخلايا الكشمية. في هذه الحالات، لا بد من التعرف على 10% على الأقل من الخلايا الخبيثة الحية على أنها خلايا سرطانة الرئة كبيرة الخلايا الكشمية قبل أن يُصنف الورم على أنه سرطانة رئة صغيرة الخلايا مختلط. في نظام تصنيف منظمة الصحة العالمية لعام 2004، سرطانة الرئة صغيرة الخلايا المختلطة هي النوع الوحيد المذكور من سرطانات الرئة صغيرة الخلايا.[8]
تكوين النسيج
تعد الآليات الدقيقة وتكوين الأنسجة لسرطان الرئة من الموضوعات ذات الاهتمام والبحث المكثف. يُعتقد حاليًا أن معظم حالات سرطان الرئة ربما تحدث بعد أن يتسبب تلف الحمض النووي الجيني في تحول خبيث لخلية واحدة متعددة القدرات. هذا الكيان الذي شكل حديثًا، والذي يشار إليه أحيانًا باسم الخلية الجذعية السرطانية، يبدأ بعد ذلك في الانقسام بشكل لا يمكن السيطرة عليه، ما يؤدي إلى ظهور خلايا سرطانية بنت جديدة بطريقة أسية (أو شبه أسية). ما لم يتم التحقق من عملية الانقسام الخلوي الجامح هذا، فإن الورم الظاهر سريريًا سيتشكل في النهاية عندما تصل الكتلة إلى الحجم الكافي لاكتشافها سريريًا، أو تبدأ في التسبب في علامات أو أعراض.[9] تشخص ما يقرب من 98٪ من سرطانات الرئة في النهاية على أنها نوع من أنواع السرطانات النسيجية، وهو مصطلح يشير إلى أن الورم مشتق من الخلايا الظهارية المتحولة، أو الخلايا التي اكتسبت خصائص طلائية نتيجة تمايز الخلايا.[7]
يبدو أن تكوين الأنسجة لـ C-SCLC وأشكال أخرى متعددة الأطوار من سرطان الرئة هي ظاهرة معقدة ومتنوعة. في معظم حالات SCLC، تشير الدراسات الجينومية والكيميائية المناعية إلى أن الاختلاف المورفولوجي للمكونات المنفصلة يحدث عندما يتم تحويل خلية تشبه SCLC إلى خلية لديها القدرة على تطوير خصائص متغيرة لـ NSCLC، وليس العكس. ثم تنقسم الخلايا الابنة لهذه الخلية الشبيهة بـ SCLC بشكل متكرر وتكتسب، تحت التأثيرات البيئية الجينية والخارجية، طفرات إضافية (عملية تعرف باسم تطور الورم). والنتيجة النهائية هي أن الورم يكتسب سمات خلوية ومعمارية محددة تشير إلى مزيج من SCLC و NSCLC.[10]
تشير تحليلات أخرى إلى أنه -في بعض الحالات على الأقل- يمكن للمتغيرات الأكثر تمايزًا من NSCLC (أي السرطانة الغدية) أن تتقدم لتؤدي إلى ظهور مناطق داخل الورم الأولي (الأصلي) (أو النقائل) التي تطور خصائص نسيجية وجزيئية لـ SCLC.[11]
ومع ذلك، تشير دراسات جزيئية أخرى إلى أنه -في عدد قليل على الأقل من الحالات- يحدث التطور المستقل للمكونات في C-SCLC عن طريق الطفرة والتحول في خليتين مختلفتين على مقربة مكانية قريبة من بعضهما البعض، بسبب سرطان المجال. في هذه الحالات ، يؤدي الانقسام المتكرر والتطور الطفري في كل من الخلايا الجذعية السرطانية إلى حدوث ورم ثنائي النسيلة.[12][13]
بغض النظر عن أي من هذه الآليات تؤدي إلى ظهور الورم، تشير الدراسات الحديثة إلى أنه في المراحل اللاحقة من تكوين الورم c-SCLC، ينتج عن التطور الطفري المستمر داخل كل مكون من مكونات الورم أن خلايا الورم المشترك تطور ملامح جزيئية تشبه إلى حد كبير كل منها بخلاف خلايا الأشكال النقية للمتغيرات المورفولوجية الفردية.[14] من المحتمل أن يكون لهذا التقارب الجزيئي الوراثي آثار مهمة في علاج هذه الآفات، نظرًا للاختلافات بين الأنظمة العلاجية القياسية لـ SCLC وNSCLC.
يحدث C-SCLC أيضًا بشكل شائع بعد علاج SCLC النقي مع العلاج الكيميائي و/أو الإشعاع، ربما نتيجة لمجموعة من الطفرات التقدمية الخاصة بجينوم الورم، والظواهر الجينية العشوائية، والطفرات الإضافية التي يسببها العلاج السام للخلايا .[15][16][17][18]
الأشكال الأكثر شيوعًا لـ NSCLC التي تم تحديدها كمكونات داخل C-SCLC هي سرطان الخلايا الكبيرة، والسرطان الغدي، وسرطان الخلايا الحرشفية.[19][20][4] تعد الأنواع النادرة من NSCLC أقل شيوعًا، مثل التوليفات مع الكارسينويد، سرطان خلايا المغزل، وسرطان الخلايا العملاقة. تظهر مكونات سرطان الخلايا العملاقة بشكل أكثر شيوعًا في المرضى الذين خضعوا للإشعاع.[21][22][23] مع الموافقة على واستخدام عوامل مستهدفة جزيئيًا أحدث تكشف عن الكفاءات التفاضلية في أنواع فرعية ومتغيرات محددة من NSCLC، أصبح من المهم أكثر لعلماء الأمراض أن يصنفوا بشكل صحيح عناصر NSCLC ككيانات ورم مميزة، أو كمكونات لـ c-SCLC's.
المراجع
- Travis, William D؛ Brambilla, Elisabeth؛ Muller-Hermelink, H Konrad؛ وآخرون, المحررون (2004)، Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart (PDF)، World Health Organization Classification of Tumours، Lyon: IARC Press، ISBN 978-92-832-2418-1، مؤرشف من الأصل (PDF) في 23 أغسطس 2009، اطلع عليه بتاريخ 27 مارس 2010.
- Gotoh M, Yamamoto Y, Huang CL, Yokomise H (نوفمبر 2004)، "A combined small cell carcinoma of the lung containing three components: small cell, spindle cell and squamous cell carcinoma"، Eur J Cardiothorac Surg، 26 (5): 1047–9، doi:10.1016/j.ejcts.2004.08.002، PMID 15519208، مؤرشف من الأصل في 15 مارس 2020.
- Fouad Ismail M, Mowafy AA, Sameh SI (أبريل 2005)، "A combined small cell carcinoma of the lung containing three components: small cell, spindle cell and squamous cell carcinoma, revisited"، Eur J Cardiothorac Surg، 27 (4): 734, author reply 735، doi:10.1016/j.ejcts.2005.01.003، PMID 15784404، مؤرشف من الأصل في 14 أبريل 2020.
- Roggli VL, Vollmer RT, Greenberg SD, McGavran MH, Spjut HJ, Yesner R (يونيو 1985)، "Lung cancer heterogeneity: a blinded and randomized study of 100 consecutive cases"، Hum. Pathol.، 16 (6): 569–79، doi:10.1016/S0046-8177(85)80106-4، PMID 2987102.
- Brambilla E, Travis WD, Colby TV, Corrin B, Shimosato Y (ديسمبر 2001)، "The new World Health Organization classification of lung tumours"، Eur. Respir. J.، 18 (6): 1059–68، doi:10.1183/09031936.01.00275301، PMID 11829087.
- Vincent MD (أغسطس 2009)، "Optimizing the management of advanced non-small-cell lung cancer: a personal view"، Curr Oncol، 16 (4): 9–21، doi:10.3747/co.v16i4.465، PMC 2722061، PMID 19672420.
- Travis WD, Travis LB, Devesa SS (يناير 1995)، "Lung cancer"، Cancer، 75 (1 Suppl): 191–202، doi:10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y، PMID 8000996.
- Nicholson SA, Beasley MB, Brambilla E, وآخرون (سبتمبر 2002)، "Small cell lung carcinoma (SCLC): a clinicopathologic study of 100 cases with surgical specimens"، Am. J. Surg. Pathol.، 26 (9): 1184–97، doi:10.1097/00000478-200209000-00009، PMID 12218575.
- Croce CM (يناير 2008)، "Oncogenes and cancer"، N. Engl. J. Med.، 358 (5): 502–11، doi:10.1056/NEJMra072367، PMID 18234754، S2CID 8813076.
- Wagner PL, Kitabayashi N, Chen YT, Saqi A (مارس 2009)، "Combined small cell lung carcinomas: genotypic and immunophenotypic analysis of the separate morphologic components"، Am. J. Clin. Pathol.، 131 (3): 376–82، doi:10.1309/AJCPYNPFL56POZQY، PMID 19228643، مؤرشف من الأصل في 30 يونيو 2018.
- Alam N, Gustafson KS, Ladanyi M, وآخرون (سبتمبر 2010)، "Small-cell carcinoma with an epidermal growth factor receptor mutation in a never-smoker with gefitinib-responsive adenocarcinoma of the lung"، Clin Lung Cancer، 11 (5): E1–4، doi:10.3816/CLC.2010.n.046، PMID 20837450.
- Buys TP, Aviel-Ronen S, Waddell TK, Lam WL, Tsao MS (فبراير 2009)، "Defining genomic alteration boundaries for a combined small cell and non-small cell lung carcinoma"، J Thorac Oncol، 4 (2): 227–39، doi:10.1097/JTO.0b013e3181952678، PMID 19179901، S2CID 24769703.
- Knudson AG (نوفمبر 2001)، "Two genetic hits (more or less) to cancer"، Nat. Rev. Cancer، 1 (2): 157–62، doi:10.1038/35101031، PMID 11905807، S2CID 20201610.
- D'Adda T, Pelosi G, Lagrasta C, وآخرون (أبريل 2008)، "Genetic alterations in combined neuroendocrine neoplasms of the lung"، Mod. Pathol.، 21 (4): 414–22، doi:10.1038/modpathol.3801014، PMID 18204434، S2CID 6595074.
- Morinaga R, Okamoto I, Furuta K, وآخرون (ديسمبر 2007)، "Sequential occurrence of non-small cell and small cell lung cancer with the same EGFR mutation"، Lung Cancer، 58 (3): 411–3، doi:10.1016/j.lungcan.2007.05.014، PMID 17601631.
- Mangum MD, Greco FA, Hainsworth JD, Hande KR, Johnson DH (مايو 1989)، "Combined small-cell and non-small-cell lung cancer"، J. Clin. Oncol.، 7 (5): 607–12، doi:10.1200/JCO.1989.7.5.607، PMID 2540288.[وصلة مكسورة]
- Benfield JR, Russell LA (1996)، "Lung carcinomas"، في Baue A, Geha A, Hammond G, Lakes H, Naunheim K (المحررون)، Glenn's thoracic and cardiovascular surgery (ط. 6th)، Norwalk CT: Appleton & Lange، ص. 357–389.
- Brambilla E, Moro D, Gazzeri S, وآخرون (يناير 1991)، "Cytotoxic chemotherapy induces cell differentiation in small-cell lung carcinoma"، J. Clin. Oncol.، 9 (1): 50–61، doi:10.1200/JCO.1991.9.1.50، PMID 1702146.[وصلة مكسورة]
- Ruffini E, Rena O, Oliaro A, وآخرون (نوفمبر 2002)، "Lung tumors with mixed histologic pattern. Clinico-pathologic characteristics and prognostic significance"، Eur J Cardiothorac Surg، 22 (5): 701–7، doi:10.1016/S1010-7940(02)00481-5، PMID 12414033.
- Gotoh M, Yamamoto Y, Huang CL, Yokomise H (نوفمبر 2004)، "A combined small cell carcinoma of the lung containing three components: small cell, spindle cell and squamous cell carcinoma"، Eur J Cardiothorac Surg، 26 (5): 1047–9، doi:10.1016/j.ejcts.2004.08.002، PMID 15519208.
- Erenpreisa J, Ivanov A, Wheatley SP, وآخرون (سبتمبر 2008)، "Endopolyploidy in irradiated p53-deficient tumour cell lines: persistence of cell division activity in giant cells expressing Aurora-B kinase"، Cell Biol. Int.، 32 (9): 1044–56، doi:10.1016/j.cellbi.2008.06.003، PMC 2570184، PMID 18602486.
- Illidge TM, Cragg MS, Fringes B, Olive P, Erenpreisa JA (2000)، "Polyploid giant cells provide a survival mechanism for p53 mutant cells after DNA damage"، Cell Biol. Int.، 24 (9): 621–33، doi:10.1006/cbir.2000.0557، PMID 10964452، S2CID 22391794.
- Higashi K, Clavo AC, Wahl RL (مايو 1993)، "In vitro assessment of 2-fluoro-2-deoxy-D-glucose, L-methionine and thymidine as agents to monitor the early response of a human adenocarcinoma cell line to radiotherapy"، J. Nucl. Med.، 34 (5): 773–9، PMID 8478710، مؤرشف من الأصل في 19 أكتوبر 2021.
- بوابة طب