سرطان الغدة الدرقية النخاعي
سرطان الغدة الدرقية النخاعي (باختصار MTC) هو شكل من أشكال سرطان الغدة الدرقية ينشأ من الخلايا المجاورة للجريب (الخلايا C)، التي تنتج هرمون الكالسيتونين.[1] هذا النوع من السرطان وأورام النخاع بشكل عام هو ثالث أكثر أنواع سرطانات الغدة الدرقية شيوعًا ويشكل حوالي 3 ٪ من جميع حالات سرطان الغدة الدرقية.[2] تم وصف MTC لأول مرة في عام 1959.[3]
| سرطان الغدة الدرقية النخاعي | |
|---|---|
| Medullary thyroid cancer | |
 سرطان الغدة الدرقية النخاعي | |
| تسميات أخرى | MTC |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | سرطان الغدة الدرقية الجريبي، ومرض الدرقية، وسرطانة نخاعية، ومرض |
ما يناهز 25 ٪ من حالات سرطان الغدة الدرقية النخاعي هي وراثية بطبيعتها، ناتجة عن طفرة في طليعة الجين الورميRET. عندما يحدث سرطان الغدة الدرقية النخاعي يطلق عليه سرطان الغدة الدرقية النخاعي المتقطع (SMTC). يظهر سرطان الغدة الدرقية النخاعي لدى الأشخاص الذين يعانون من أورام الغدد الصماء المتعددة من النوع 2 أ و 2 ب. عندما يحدث سرطان الغدة الدرقية النخاعي دون أورام الغدد الصماء الأخرى، يطلق عليه سرطان الغدة الدرقية النخاعي العائلي (FMTC).
العلامات والأعراض
في وقت مبكر من بدء سرطان الغدة الدرقية النخاعي، لا توجد أي أعراض عادة، ويكاد السرطان لا يسبب فرط نشاط الغدة الدرقية (زيادة وظيفة الغدة الدرقية) أو قصور الغدة الدرقية (انخفاض وظيفة الغدة الدرقية)، كما أنه لا يجعل المصابين يشعرون بالتعب أو بأي اختلاف.[4] وعلى هذا النحو، عادة ما يتم العثور على تشخيص سرطان الغدة الدرقية النخاعي في الأفراد الذين ليس لديهم أي أعراض على الإطلاق. في الغالب، لا تسبب معظم سرطانات الغدة الدرقية النخاعية في بدايتها أعراضًا، حيث أنها تكون عديمة الأعراض تمامًا.[5] لذلك، فإن تشخيص سرطان الغدة الدرقية النخاعي يكون أكثر شيوعًا عن طريق الصدفة في التقييم لأسباب أخرى. عادة ما يتم الاكتشاف المبكر عن سرطان الغدة الدرقية النخاعي (غير الوراثي) من قبل المريض بمحض الصدفة أو شخص آخر يمكن أن يلاحظ وجود كتلة غير عادية في الرقبة أو الحلق، أو من قبل الطبيب الذي يشعر بالكتلة أو العقيدات عند فحص الغدة الدرقية للمريض. قد تسبب العقيدات الكبيرة جدًا أعراضًا انضغاطية تشمل صعوبة البلع، أو قد يشعر المصابون بأن الطعام «يعلق» عند البلع، وضغط أو ضيق في النفس خاصة عند الاستلقاء.[5] في حالات السرطان المتقدم الذي ينمو ويغزو الهياكل المحيطة، قد يعاني المرضى من بحة في الصوت. يجب على المرضى الذين يعانون من أعراض انضغاطية وتلك المذكورة آنفاً البحث عن التقييم الطبي على الفور.[5] نظرًا لأن سرطان الغدة الدرقية النخاعي المتقطع في وقت مبكر لا يظهر مع أي أعراض، فمن الصعب تقييم مدة نمو الورم.[6]
على الرغم من ندرة حدوث ذلك مع سرطانات الغدة الدرقية الأخرى، إلا أن أورام الغدة الدرقية النخاعية قد تكون طرية عند اللمس ويمكن أن تكون مؤلمة أيضًا سواء نشأت في الغدة الدرقية أو حيث انتشرت في العقد اللمفاوية في الرقبة. ولكن، لا تنتج جميع أنواع السرطان تقريبًا التي تنتشر إلى العقد اللمفاوية في الرقبة أي إزعاج ملحوظ.[6]
يبدأ سرطان الغدة الدرقية النخاعي كنمو خلايا سرطانية غير طبيعية داخل الغدة الدرقية. يُطلق على هذه الخلايا الخاصة اسم الخلايا المجاورة للجريب (الخلايا C). في الشكل الوراثي لسرطان الغدة الدرقية النخاعي، يرجع نمو هذه الخلايا إلى طفرة في جين RET الموروث. قد يُنتِج هذا الجين المتحور (الطفري) أولاً حالة ما قبل سرطانية خبيثة تسمى تضخم (فرط تنسج) الخلايا C. تبدأ الخلايا C المجاورة للجريب في الغدة الدرقية بالنمو بشكل غير المنظم. في الأشكال الموروثة من سرطان الغدة الدرقية النخاعي، قد تشكل الخلايا C النامية نتوءًا أو عقيدة في أي جزء من الغدة الدرقية. مع هذا النوع من السرطان، قد لا يتم تشخيص المرضى ما لم يكن السرطان قد انتشر إلى العقد اللمفاوية في الرقبة.[4]
بالنسبة للمرضى الذين يعانون من شكل متقطع (غير وراثي) من سرطان الغدة الدرقية النخاعي، قد يتشكل نتوء أو «عقيدة» داخل الغدة الدرقية غالبًا ما تخرج من جانب الغدة الدرقية أو أمامها. لذلك، يتم تشخيص معظم سرطانات الغدة الدرقية النخاعية، مثل جميع سرطانات الغدة الدرقية الأخرى، بعد أن يشعر الطبيب برقبة المريض أو الموجات فوق الصوتية أو غيرها من الأشعة السينية تلاحظ وجود كتلة داخل الغدة الدرقية.
ينتج سرطان الغدة الدرقية النخاعي العديد من البروتينات ويلقي مواد أخرى قد تؤدي إلى أعراض شائعة أخرى لسرطان الغدة الدرقية النخاعي المتقدم - كالإسهال. قد ينشأ الإسهال من تفاعل العديد من العوامل بما في ذلك زيادة الكالسيتونين والبروستاجلاندين ووجود العديد من المواد الأخرى. يمكن إدارة هذا الإسهال إما عن طريق الاستئصال الجراحي للورم (وأي عقد ليمفاوية معنية) و/أو الأدوية المناسبة. لذا يمكن القول بأن الأعراض السريرية الرئيسية لسرطان الغدة الدرقية النخاعي هي الإسهال. في بعض الأحيان يكون لدى المريض نوبات من التورد. يحدث كلاهما بشكل خاص في حال وجود ورم خبيث في الكبد، وقد يكون أحد هذه الأعراض هو أول مظهر للمرض. لا يمكن تمييز التورد الذي يحدث في سرطان الغدة الدرقية النخاعي عن ذلك المرتبط بمتلازمة الورم السرطاوي. في السرطان الدرقي النخاعي، يحدث التورد والإسهال والحكة بسبب ارتفاع مستويات منتجات جين الكالسيتونين (الكالسيتونين أو الببتيد المرتبط بجين الكالسيتونين).[7] وفي المقابل، فإن التورد والإسهال في متلازمة الورم السرطاوي ناتج عن ارتفاع مستويات السيروتونين.[6]
قد ينتج سرطان الغدة الدرقية النخاعي أيضًا عقيدة درقية وتضخم الغدد الليمفاوية العنقية (الرقبية).[8]
تشمل مواقع انتشار سرطان الغدة الدرقية النخاعي العقد الليمفاوية الموضعية في الرقبة والغدد الليمفاوية في الجزء المركزي من الصدر (المنصف) والكبد والرئة والعظام. قد يحدث الانتشار على مواقع أخرى مثل الجلد أو الدماغ ولكنه غير شائع.
التشخيص
عند اكتشاف عقيدة الغدة الدرقية، يجب إجراء فحص جسمي كامل. عند احراء الفحص، يبحث الطبيب عن عوامل خطر الإصابة بالسرطان والتي تشمل: تاريخ عائلي للإصابة بسرطان الغدة الدرقية، وتاريخ التعرض الإشعاعي للرأس والرقبة و/أو الصدر، وعمر أقل من 20 عامًا، وعمر أكبر من 70 عامًا، وجنس المصاب والعقيدات الصلبة جدًا والعقد الليمفاوية المتضخمة و/أو بحة في الصوت. بعد ذلك، يجب فحص مستوى TSH لمعرفة ما إذا كان لدى المريض سوي الدرقية (أي وظيفة الغدة الدرقية العادية) أو فرط نشاط الغدة الدرقية أو قصور الغدة الدرقية. بشكل عام، من غير المعتاد أن يصاب مرضى فرط نشاط الغدة الدرقية بالسرطان بينما قد يكون لدى مرضى قصور الغدة الدرقية معدل إصابة بسرطان الدرقية بنسبة أعلى قليلاً. معظم مرضى سرطان الغدة الدرقية هم في حالة سوي الدرقية. في حالة الاشتباه بالإصابة بسرطان الغدة الدرقية النخاعي، يجب فحص مستويات الكالسيتونين وCEA. من المرجح أن تكون مستويات الكالسيتونين أعلى من المعتاد في المرضى الذين يعانون من سرطان الغدة الدرقية النخاعي ويمكن استخدامها كمقياس تقريبي لكمية المرض الموجودة في الجسم. بشكل عام، كلما زاد الكالسيتونين، كلما زاد المرض. قد تكون المستويات العالية من CEA (أي المستضد السرطاني المضغي) علامة على شكل أكثر عدوانية من سرطان الغدة الدرقية النخاعي.
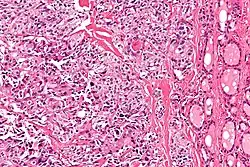
يتم إجراء التشخيص في المقام الأول عن طريق الخزعة بالإبرة الدقيقة لآفة الغدة الدرقية لتمييزها عن أنواع أخرى من آفات الغدة الدرقية.[9] سيظهر الفحص المجهري سدى نشواني مع تضخم في الخلايا المجاورة للجريب.
العلاج
تاريخياً، كانت الجراحة والعلاج الإشعاعي العلاجات الرئيسية لسرطان الغدة الدرقية النخاعي. لايزال هذا العلاج يوصى به لحد الآن. على عكس سرطانات الغدة الدرقية الحليمية والجريبية، هناك القليل من الجدل حول أفضل طريقة لعلاج سرطان الغدة الدرقية النخاعي. بعد أن يتم تقييم وعلاج أية مشاكل مشابهة مرتبطة بالغدد الصماء، مثل ورم القواتم، يخضع جميع المرضى لاستئصال الغدة الدرقية الكامل حيث تتم إزالة جميع الغدد الليمفاوية والأنسجة الدهنية في المنطقة الوسطى من الرقبة. مجرد وجود تضخم في الغدد الليمفاوية لا يعني انتشار سرطان الغدة الدرقية النخاعي. ستتم إزالة العقد الليمفاوية على جانب العنق فقط إذا كان هناك خلايا سرطانية مؤكدة أو ورمًا كبيرًا جدًا.[4] يجب فحص مستوى البلازما من الميتانيفرين قبل إجراء استئصال الغدة الدرقية الجراحي لتقييم وجود ورم القواتم حيث أن 25 ٪ من الأشخاص الذين تبين أنهم مصابون بسرطان الغدة الدرقية النخاعي لديهم الشكل الموروث من متلازمة MEN2A. يؤدي ورم القواتم غير المُشخص إلى خطر مرتفع للغاية أثناء العملية من نوبة ارتفاع ضغط الدم، وربما الموت.
الجراحة
يعد استئصال الغدة الدرقية الكامل مع التشريح الثنائي الجانب للرقبة هو المعيار الذهبي لعلاج سرطان الغدة الدرقية النخاعي، وهو الوسيلة الأكثر تحديدًا لتحقيق علاج في المرضى الذين ليس لديهم انبثاث بعيد أو تسرطن عقيدي واسع النطاق. تشمل مخاطر الجراحة فقدان التحكم الصوتي أو تلف الأعصاب الذي لا يمكن إصلاحه أو الوفاة أو الحاجة إلى إجراء عملية ثانية لتنظيف العقد الليمفاوية المصابة المتبقية إذا كانت نتيجة خزعة العقدة الخافرة إيجابية للانتشار السرطاني. يمكن أن تكون الجراحة الموسعة فعالة عندما يتم اكتشاف الحالة مبكرًا ولكن يبقى خطر تكرارها، خاصةً في المرضى الذين يعانون من العديد من الغدد الليمفاوية الإيجابية أو الغزو خارج المحفظة.[10][11] حوالي نصف المرضى لديهم ورم خبيث في العقد الليمفاوية الموضعية في وقت التشخيص.[12]
نشرت الجمعية الأوروبية لجراحي الغدد الصماء توصيات لإدارة هذه الحالة في الإشخاص الحاملين للجينات المسببة للمرض.[13] يعتمد توقيت الجراحة على نوع الطفرة الموجودة. بالنسبة لأولئك في المجموعة الأكثر عرضة للخطر، يُنصح بإجراء الجراحة في السنة الأولى من العمر. في الحالات الأقل خطورة، قد تتأخر الجراحة حتى سن عشر سنوات، ويعتمد التوقيت الدقيق على الطفرة وعوامل أخرى.

الأشعة
يوصى بالعلاج الإشعاعي (غالباً العلاج بحُزم الإشعاع الخارجي) عندما يكون هناك خطر كبير لتكرار تشكل السرطان الموضعي، حتى بعد العلاج الجراحي الأمثل.[14]
المآل
تستند إحصائيات المآل على دراسة مجموعات لا على التعيين من مرضى السرطان الدرقي النخاعي. لا يمكن لهذه الإحصائيات التنبؤ بمستقبل المريض على المستوى الفردي، لكنها يمكن أن تكون مفيدة عند النظر في العلاج والمتابعة الأكثر ملاءمة للمريض. اعتمادًا على المصدر، يبلغ معدل البقاء الكلي لسرطان الغدة الدرقية لمدة 5 سنوات 80٪،[15][16] 83٪ [17] أو 86٪، [18] ومعدل البقاء على قيد الحياة لمدة 10 سنوات هو 75٪.[15]
فيما يخص المراحل الإجمالية للسرطان النخاعي في المراحل من الأولى إلى الرابعة، فإن معدل البقاء لمدة 5 سنوات هو 100٪ في المرحلة الأولى، و 98٪ في المرحلة الثانية، و 81٪ في المرحلة الثالثة و 28٪ في المرحلة الرابعة. يعتبر مآل سرطان الدرقية النخاعي أسوء مقارنةً بسرطان الغدة الدرقية الجريبي والحليمي عندما ينتشر خارج الغدة الدرقية.
انظر أيضًا
المراجع
- Rena (2005)، Pediatric Oncology، Boston, MA: Springer US، ص. 155–166، ISBN 978-0-387-24470-9، مؤرشف من الأصل في 24 مايو 2020.
- STAMATAKOS, MICHAEL؛ PARASKEVA, PANORAIA؛ STEFANAKI, CHARIKLEIA؛ KATSARONIS, PARASKEVAS؛ LAZARIS, ANDREAS؛ SAFIOLEAS, KONSTANTINOS؛ KONTZOGLOU, KONSTANTINOS (23 نوفمبر 2010)، "Medullary thyroid carcinoma: The third most common thyroid cancer reviewed"، Oncology Letters، 2 (1): 49–53، doi:10.3892/ol.2010.223، ISSN 1792-1074، مؤرشف من الأصل في 24 مايو 2020.
- Dionigi, G.؛ Bianchi, V.؛ Rovera, F.؛ Boni, L.؛ Annoni, M.؛ Castano, P.؛ Villa, F.؛ Dionigi, R. (2007-12)، "Genetic alteration in hereditary colorectal cancer"، Surgical Oncology، 16: 11–15، doi:10.1016/j.suronc.2007.10.020، ISSN 0960-7404، مؤرشف من الأصل في 24 مايو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Medullary Thyroid Cancer: Overview"، EndocrineWeb (باللغة الإنجليزية)، مؤرشف من الأصل في 8 مايو 2020، اطلع عليه بتاريخ 05 يونيو 2020.
- "Medullary Thyroid Cancer | Columbia University Department of Surgery"، columbiasurgery.org، مؤرشف من الأصل في 23 ديسمبر 2019، اطلع عليه بتاريخ 05 يونيو 2020.
- "Medullary Thyroid Cancer: Overview"، EndocrineWeb (باللغة الإنجليزية)، مؤرشف من الأصل في 8 مايو 2020، اطلع عليه بتاريخ 04 يونيو 2020.
- Lee؛ Schafer, Andrew I. (2012)، Goldman's Cecil Medicine، Elsevier، ص. vii، ISBN 978-1-4377-1604-7، مؤرشف من الأصل في 4 يونيو 2020.
- Lee-Goldman, Russell (2011-08)، "No as a discourse marker"، Journal of Pragmatics، 43 (10): 2627–2649، doi:10.1016/j.pragma.2011.03.011، ISSN 0378-2166، مؤرشف من الأصل في 4 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Thyroid Cancer Treatment (Adult) (PDQ®)–Health Professional Version - National Cancer Institute"، www.cancer.gov (باللغة الإنجليزية)، 15 مايو 2020، مؤرشف من الأصل في 11 أبريل 2020، اطلع عليه بتاريخ 04 يونيو 2020.
- Rena (2005)، Pediatric Oncology، Boston, MA: Springer US، ص. 155–166، ISBN 978-0-387-24470-9، مؤرشف من الأصل في 11 يونيو 2018.
- Schlumberger, Martin؛ Carlomagno, Francesca؛ Baudin, Eric؛ Bidart, Jean Michel؛ Santoro, Massimo (2008-01)، "New therapeutic approaches to treat medullary thyroid carcinoma"، Nature Clinical Practice Endocrinology & Metabolism، 4 (1): 22–32، doi:10.1038/ncpendmet0717، ISSN 1745-8366، مؤرشف من الأصل في 06 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Goldman's Cecil medicine (ط. 24th edition)، Philadelphia، ISBN 9781437727883، OCLC 771939469، مؤرشف من الأصل في 06 يونيو 2020.
{{استشهاد بكتاب}}:|edition=has extra text (مساعدة) - Niederle, Bruno؛ Sebag, Frédéric؛ Brauckhoff, Michael (03 ديسمبر 2013)، "Timing and extent of thyroid surgery for gene carriers of hereditary C cell disease—a consensus statement of the European Society of Endocrine Surgeons (ESES)"، Langenbeck's Archives of Surgery، 399 (2): 185–197، doi:10.1007/s00423-013-1139-5، ISSN 1435-2443، مؤرشف من الأصل في 8 يونيو 2018.
- Rossella (2016)، Thyroid Cancer، New York, NY: Springer New York، ص. 899–910، ISBN 978-1-4939-3312-9، مؤرشف من الأصل في 14 يونيو 2018.
- Biersack, H.-J.؛ Grünwald, F., المحررون (2005)، "Thyroid Cancer"، doi:10.1007/3-540-27845-1، مؤرشف من الأصل في 18 يونيو 2018.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - H.-J.؛ Grünwald, F. (10 يونيو 2005)، Thyroid Cancer (باللغة الإنجليزية)، Springer Science & Business Media، ISBN 978-3-540-22309-2، مؤرشف من الأصل في 6 يونيو 2020.
- Barbet, Jacques؛ Campion, Loïc؛ Kraeber-Bodéré, Françoise؛ Chatal, Jean-François (2005-11)، "Prognostic Impact of Serum Calcitonin and Carcinoembryonic Antigen Doubling-Times in Patients with Medullary Thyroid Carcinoma"، The Journal of Clinical Endocrinology & Metabolism، 90 (11): 6077–6084، doi:10.1210/jc.2005-0044، ISSN 0021-972X، مؤرشف من الأصل في 23 يونيو 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Thyroid Cancer Treatment (Adult) (PDQ®)–Health Professional Version - National Cancer Institute"، www.cancer.gov (باللغة الإنجليزية)، 15 مايو 2020، مؤرشف من الأصل في 11 أبريل 2020، اطلع عليه بتاريخ 06 يونيو 2020.
روابط خارجية
- سرطان الغدة الدرقية في DMOZ
- دليل إدارة السرطان: سرطان الغدة الدرقية والغدة الدرقية
- إرشادات الإدارة للمرضى الذين يعانون من عقيدات الغدة الدرقية وسرطان الغدة الدرقية المتمايز فرقة العمل للخطوط التوجيهية لرابطة الغدة الدرقية الأمريكية (2015).
- بوابة طب