بيركلورات
البيركلورات أو فوق الكلورات هي المركبات المشتقة من حمض البيركلوريك (HClO4). وعادة ما تكتب البيركلورات الموجودة في محلول من البيركلورات على شكل شاردة قطبية سالبة بالشكل CLO4-. يتم إنتاج البيركلورات طبيعياً كما يمكن إنتاجها صناعياً. تستخدم على نطاق واسع في صناعة الألعاب النارية. كما تستخدم فوق كلورات الأمونيوم كأحد مكونات الوقود الصلب المستخدم في الصواريخ. تستخدم فوق كلورات الليثيوم، والتي تتفكك ناشرة للحرارة معطيةً الأوكسيجين، كشمعات أوكسيجينية في السفن الفضائية والغواصات وغيرها من الأماكن التي تتطلب وجود مصدر أوكسيجين داعم. جميع البيركلورات ذوّابة في الماء عدا بيركلورات البوتاسيوم والتي تعتبر الأقل ذوبانية بين بيركلورات المعادن القلوية (1.5 غ / 100 مل ماء على درجة 25°س). أجريت دراسات موسعة للأثر التلوث بالبيركلورات على البيئة والإنسان. وتم ربطها بأثرها السلبي على الدرقية.
| بيركلورات | |
|---|---|
 بيركلورات | |
 بيركلورات |
 بيركلورات |
| الاسم النظامي (IUPAC) | |
بيركلورات[1] | |
| أسماء أخرى | |
فوق كلورات | |
| المعرفات | |
| رقم CAS | 14797-73-0 |
| بوب كيم (PubChem) | 123351 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
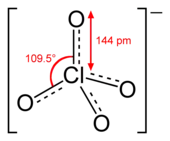
| الصيغة الجزيئية | ClO4− |
| الكتلة المولية | 99.451 غ مول−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الإنتاج والاستخدام
تنتج أملاح البيركلورات صناعياً بأكسدة محلول من كلورات الصوديوم عن طريق التحليل الكهربائي. تستعمل هذه الطريقة في تحضير بيركلورات الصوديوم. الاهتمام التجاري الرئيسي يقع على أربع بيركلورات هي: بيركلورات الأمونيوم (NH4ClO4) وحمض البيركلوريك (HClO4) وبيركلورات البوتاسيوم (KClO4) وبيركلورات الصوديوم (NaClO4). والاستخدام الرئيسي لها هو لوقود الصواريخ.[2] تنتج البيركلورات تجارياً على شكل أملاح صوديوم وأمونيوم وبوتاسيوم صلبة؛ وتستخدم كمؤكسد في المادة الدافعة للصواريخ والألعاب النارية وبعض الذخائر كما تستخدم في أعواد الثقاب. كانت بيركلورات البوتاسيوم تستخدم كعلاج لفرط الغدة الدرقية الناجم عن الدراق الجحوظي.[3] ومازالت البيركلورات محطاً للقلق بسبب عدم اليقين من سميتها وآثارها الصحية عند وجودها بمستويات ضئيلة في ماء الشرب، وأثرها على الأنظمة البيئية، وطرق التعرض غير المباشر لها عن طريق تراكمها في الخضار.[3]
خواصها كمؤكسد
نشاط شاردة البيركلورات في الأكسدة أقل منه في الكلورات. يبدو هذا تناقضاً بالنظر إلى عدد الأكسدة الأكبر والذي يوحي بمؤكسد أقوى، وأقل استقراراً. يظهر في الجدول الذي يبين إمكانيات الإرجاع، أن البيركلورات -على عكس المتوقع- هي أضعف المؤكسدات من بين الأربعة المذكورة في الماء. كما تظهر هذه البيانات أن البيركلورات والكلورات تزداد قوتها كمؤكسد في وسط حمضي مقارنة بقوتها في وسط قلوي.[4]
| الشاردة | التفاعل الحمضي | E° (V) | التفاعل القلوي/الحيادي | E° (V) |
|---|---|---|---|---|
| تحت كلوريت | H+ + HOCl + e− → ½Cl2(g) + H2O | 1.63 | ClO− + H2O + 2e− → Cl− + 2OH− | 0.89 |
| كلوريت | 3H+ + HOClO + 3e− → ½Cl2(g) + 2H2O | 1.64 | ClO2− + 2H2O + 4e− → Cl− + 4OH− | 0.78 |
| كلورات | 6H+ + ClO3− + 5e− → ½Cl2(g) + 3H2O | 1.47 | ClO3− + 3H2O + 6e− → Cl− + 6OH− | 0.63 |
| بيركلورات | 8H+ + ClO4− + 7e− → ½Cl2(g) + 4H2O | 1.42 | ClO4− + 4H2O + 8e− → Cl− + 8OH− | 0.56 |
قياسات الطور الغازي لذرجة حرارة التفاعل (والذي يسمح بحساب ΔHf°) لأكاسيد الكلور المختلفة يبين أن Cl2O7 -كما هو متوقع- تعطي أكبر قيمة ماصة للحرارة لـ ΔHf° وهي (238.1 كيلو جول/مول) في حين أن Cl2O يعطي أقل قيمة ماصة للحرارة لـ ΔHf° وهي (80.3 كيلو جول/مول).[5] ذرة الكلور في شاردة البيركلورات مكتفية مدارياً بالإلكترونات ومحمية جيداً بأربع ذرات من الأوكسيجين، لذا فالبيركلورات تتفاعل ببطء. معظم مركبات البيركلورات، خاصة أملاح المعادن الكهرجابية مثل بيركلورات الصوديوم أوبيركلورات البوتاسيوم خاملة وتتفاعل ببطء مع المركبات العضوية. وهذه الخاصة مفيدة في كثير من التطبيقات كالنجمات المستخدم في الألعاب النارية، حيث يتطلب حدوث التفاعل إشعالها أولاً. لكن بيركلورات الأمونيوم خطيرة، كما حدث في كارثة بيبكون، والتي دمرت معمل إنتاج كبيرة لبيركلورات الأمونيوم.
في الأحياء الدقيقة
تم الحصول على أكثر من 40 نوع من الأحياء الدقيقة المختلفة أيضياً وجينياً والتي تنتج البيركلورات منذ عام 1996. منها بعض المتقلبات ونوعين مكتشفين حديثاً من متينات الجدار، وهما Moorella perchloratireducens و Sporomusa sp.[6]
المراجع
- "Perchlorate - PubChem Public Chemical Database"، The PubChem Project، USA: National Center for Biotechnology Information، مؤرشف من الأصل في 27 أبريل 2014.
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. دُوِي:10.1002/14356007.a06_483
- Sridhar Susarla, C. W. Collette, A. W. Garrison, N. L. Wolfe, S. C. McCutcheon "Perchlorate Identification in Fertilizers" in Environmental Science and Technology 1999, American Chemical Society. دُوِي:10.1021/es990577k
- قالب:Cotton&Wilkinson5th
- Wagman, D. D.; Evans, W. H.; Parker, V. P.; Schumm, R. H.; Halow, I.; Bailey, S. M.; Churney, K. L.; Nuttall, R. L. J. Phys. Chem. Ref. Data Vol. 11(2); &169;1982 by the American Chemical Society and the American Institute of Physics.
- John D. Coates, Laurie A. Achenbach (2004)، "Microbial perchlorate reduction: rocket-fuelled metabolism"، Nature Reviews Microbiology، 2 (7): 569–580، doi:10.1038/nrmicro926، PMID 15197392.
- بوابة الكيمياء