كلورات الصوديوم
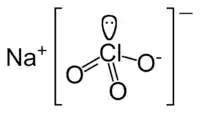
كلورات الصوديوم هو مركب كيميائي له الصيغة NaClO3، يكون على شكل بلورات عديمة اللون والرائحة، أو على شكل مسحوق بلوري أبيض.
| كلورات الصوديوم | |
|---|---|
 كلورات الصوديوم | |
| الاسم النظامي (IUPAC) | |
كلورات صوديوم | |
| المعرفات | |
| رقم CAS | 7775-09-9 |
| بوب كيم | 516902 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | NaClO3 |
| الكتلة المولية | 106.44 غ/مول |
| المظهر | مسحوق بلوري أبيض |
| الكثافة | 2.49 غ/سم3 |
| نقطة الانصهار | 255 °س |
| نقطة الغليان | يتفكك حوالي 300 °س |
| الذوبانية في الماء | 100 غ/100 مل ماء |
| المخاطر | |
| ترميز المخاطر |  Xn Xn
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
ينحل مركب كلورات الصوديوم بشكل جيد جداً بالماء 100 غ / 100 مل ماء، كما أنه ينحل بشكل جيد أيضاً بالغليسيرين، لكنه ضعيف الانحلال بالإيثانول.
وجود كلوريد الصوديوم يقلل من انحلالية كلورات الصوديوم بالماء بشكل كبير.
التحضير
يحضر كلورات الصوديوم عملياً بالتحليل الكهربائي لمحلول مركز من كلوريد الصوديوم في خلايا تحليل كهربائي لا تحوي على حجاب (Diaphragm) أو غشاء (Membrane) بين كل من قطبي الخلية الأنود والكاثود، بحيث أن غاز الكلور المتشكل عند الأنود يتفاعل بشكل مباشر مع شوارد (أيونات) الهيدروكسيل، فينتج لدينا كلورات الصوديوم بالإضافة إلى هيبوكلوريت الصوديوم وذلك حسب التفاعلات التالية
نتيجة وجود شوارد الصوديوم في المحلول نحصل على كلورات الصوديوم.

الاستخدامات
- يستخدم بشكل واسع في عمليات التبييض في صناعة الورق.
- يستخدم لتحضير كلوريت الصوديوم ولتحضير الكلورات الأخرى مثل كلورات البوتاسيوم.
- يساعد في صنع مادة EDC والمستخدمة في صناعة البلاستك.
المصادر
- وصلة : مُعرِّف "بَب كِيم" (PubChem CID) — الرخصة: محتوى حر
- المحرر: إدارة الأغذية والأدوية — العنوان : Unique Ingredient Identifier — مُعرِّف المُكوِّن الفريد (UNII): https://fdasis.nlm.nih.gov/srs/unii/T95DR77GMR — تاريخ الاطلاع: 14 فبراير 2018
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- بوابة الكيمياء
