حمض أميني مولد للبروتين
حمض أميني مولد للبروتين[1] هي عبارة عن أحماض أمينية تشترك في التصنيع الحيوي للبروتينات أثناء عملية الترجمة. إن مصطلح «بروتيني» يعني «تخليق البروتين». خلال الحياة هناك 22 شفرة وراثية لأحماض أمينية بروتينية، 20 منها موجودة في الشفرة الجينية واثنان إضافيان يمكن أن تترجم عن طريق آليات الترجمة الخاصة.[2]
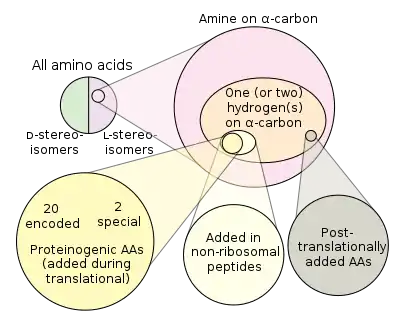
على النقيض من ذلك فإن الأحماض الأمينية غير البروتينية هي عبارة عن أحماض أمينية لا تدخل في تكوين البروتين مثل (حمض الغاما-أمينوبيوتيريك، ليفودوبا، ثلاثي يود الثيرونين)، تنتج عن طريق الخطأ بدلاً من الأحماض الأمينية ذات الشفرة الجينية، أو لا تصنع بطريقة مباشرة أو بالفصل الذي يتم عن طريق آليات الخلية مثل (برولين الهيدروكسيل). هذا الأخير غالباً يكون ناتجا من التعديل الذي يحدث للبروتين بعد عملية الترجمة. تشترك بعض الأحماض الأمينية غير البروتينية في تصنيع البيبتيدات اللاريبوسومية وتصنع من خلال انزيمات صانعة للبيبتيدات اللاريبوزومية.
يمكن لكل من حقيقيات النواة وبدائيات النواة أن تدمج سيلينوسيستين في بروتيناتها من خلال تتابع نيوكليوتيدي يعرف باسم عنصرSECIS، الذي يوجه الخلية لترجمة أقرب كود UGA إلى سيلينوسيستين (عادة ما يكون UGA هو كود التوقف). في بعض بدائيات النواة المصنعة للميثان، يمكن أيضاً ترجمة UGA (عادة كود التوقف) إلى بيرولايسين.[3]
في حقيقيات النواة هناك فقط 21 حمض أميني بروتيني 20 من الشفرة الجينية الأساسية بالإضافة إلى السيلينوسيستين. يمكن للبشر تصنيع 12 من هذه الأحماض من بعضها البعض أو من جزيئات أخرى ناتجة من عملية الأيض. يجب استهلاك التسعة الآخرين (عادة كمشتقاتهم البروتينية)، ولذلك يطلق عليهم الأحماض الأمينية الأساسية. الأحماض الأمينية الأساسية هي هيستيدين، إيزولوسين، لايسين، ليوسين، ميثيونين، فينيل ألانين، ثريونين، تريبتوفان، وفالين (H، I، L، K، M، F، T، W، V).[4]
وجد أن الأحماض الأمينية البروتينية ذات صلة بمجموعة الأحماض الأمينية التي يمكن التعرف عليها بواسطة الأنظمة الريبوزومية للأسيلة الأوتوماتيكية لتحويل الحمض الأميني إلى أسيل.[5] وهكذا، فإن الأحماض الأمينية غير البروتينية قد استبعدت عن طريق نجاح التطور الطارئ للأشكال المختلفة المعتمدة على النيوكليوتيدات. تم تقديم أسباب أخرى لتفسير لماذا لا تدخل الأحماض الأمينية غير البروتينية في تكوين البروتينات بشكل عام. على سبيل المثال الأورثونين والهوموسيرين يلتف عكس التسلسل الأساسي للبيبتيد ويفصل البروتين مع نصف عمر قصير نسبياً، بينما البعض الآخر يكون ساماً لأنه يمكن دمجه عن طريق الخطأ في البروتينات مثل نظير الأرجينين الكانافانين.
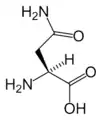
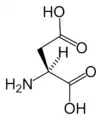
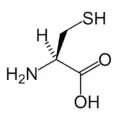
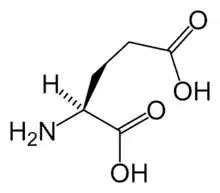
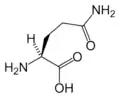
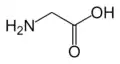
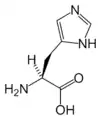
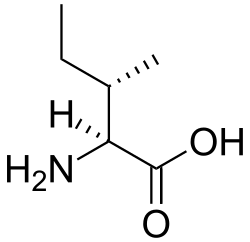
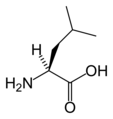
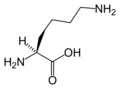
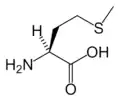
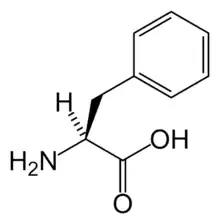
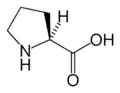
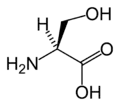
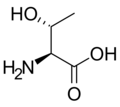
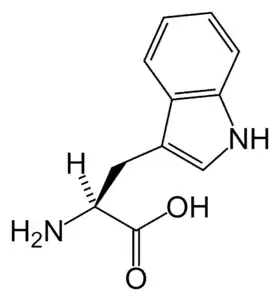
البنية الكيميائية للأحماض الألفا-أمينية المكونة للبروتينات
في ما يلي الصيغة الكيميائية ورموز الأحماض الألفا-أمينية العشرين المشفرة في المعلومة الوراثية للكائنات الحية، والأكثر استعمالا في تخليق البروتينات Protein synthesis.
|
|
مراجع
- "Al-Qamoos القاموس - English Arabic dictionary / قاموس إنجليزي عربي"، www.alqamoos.org، مؤرشف من الأصل في 31 أكتوبر 2018، اطلع عليه بتاريخ 31 أكتوبر 2018.
- Brown, Kalyn A.؛ Deiters, Alexander (01 سبتمبر 2015)، "Genetic Code Expansion of Mammalian Cells with Unnatural Amino Acids"، Current Protocols in Chemical Biology، John Wiley & Sons, Inc.، ص. 187–199، ISBN 9780470559277، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 15 سبتمبر 2018
- Stafforst, Thorsten (20 ديسمبر 2013)، "The Selenocysteine Incorporation Machinery Allows the Dual Use of Sense Codons: A New Strategy for Expanding the Genetic Code?"، ChemBioChem، 15 (3): 356–358، doi:10.1002/cbic.201300735، ISSN 1439-4227، مؤرشف من الأصل في 18 ديسمبر 2019.
- Young, Vernon R. (01 أغسطس 1994)، "Adult Amino Acid Requirements: The Case for a Major Revision in Current Recommendations"، The Journal of Nutrition، 124 (suppl_8): 1517S–1523S، doi:10.1093/jn/124.suppl_8.1517s، ISSN 0022-3166، مؤرشف من الأصل في 14 مارس 2020.
- Erives, Albert (22 يوليو 2011)، "A Model of Proto-Anti-Codon RNA Enzymes Requiring l-Amino Acid Homochirality"، Journal of Molecular Evolution، 73 (1–2): 10–22، doi:10.1007/s00239-011-9453-4، ISSN 0022-2844، مؤرشف من الأصل في 20 سبتمبر 2018.
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة صيدلة
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
.png.webp)