قشرة نانوية
القشرة النانوية (بالإنجليزية: Nanoshell) هي نوع من الجسيمات النانوية كروية الشكل والتي تتألف من نواةٍ عازلةٍ مغطاةٍ بقشرةٍ معدنيةٍ رقيقةٍ (في الغالب تكون من ذهب).[1] وتشتمل تلك القشرة النانوية على شبه جسيم (بالإنجليزية: quasiparticle)يطلق عليه بلازمون (بالإنجليزية: plasmon) والذي يعبر عن إثارة جماعية أو تذبذب البلازما الكمية (بالإنجليزية: quantum plasma oscillation )حيث تتذبذب الإلكترنات بصورةٍ تلقائيةٍ مع مراعاة كل الأيونات.
|
جزء من سلسلة من المقالات حول |
|
اقرأ أيضا |
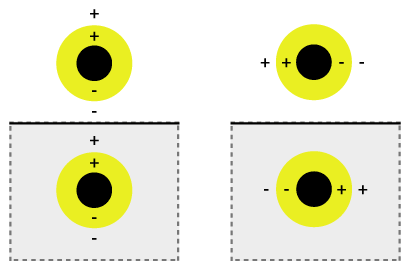
ومن الممكن أن نطلق على التذبذب التلقائي عملية تهجين البلازمون(بالإنجليزية: plasmon hybridization )حيث يصاحب ضبط التذبذب بخليطٍ من القشرة الداخلية والخارجية تتهجن لإنتاج طاقة أقل أو طاقة أعلى. وتتزاوج أو تتجمع تلك الطاقة الأقل بصورةٍ قويةٍ للضوء الساقط، في حين تعد الطاقة الأعلى غير قابلة أو مضادة للارتباط وتتجمع أو تُدمَج بصورةٍ ضعيفةٍ للضوء الساقط. كما يعد تفاعل الهجين أقوى مع طبقات القشرة الأرق، ومن ثم، تحدد سماكة القشرة وشعاع الجسيم الكلي أي طول موجي للضوء تندمج وتتزاوج معه.[2] هذا بالإضافة إلى أن القشور النانوية تتنوع وتختلف عبر نطاقٍ واسعٍ من الطيف الضوئي والذي يمتد عبر المناطق المرئية والقريبة من الأشعة تحت الحمراء. ويؤثر تفاعل الضوء مع الجسيمات النانوية على مواضع الشحنات والتي تؤثر على تجميع القوة. وينتج الاستقطاب العمودي عن الضوء الساقط المستقطب بصورةٍ متوازيةٍ نحو الركيزة كما في الشكل (1b)، ومن ثم تكون الشحنات أبعد من سطح الركيزة التي تعطي تفاعلاً أقوى فيما بين القشرة والمحور. وإلا تتشكل عملية استقطاب متوازي والتي تسفر عن حدوث طاقة بلازمون منحرفة مسببةً تفاعلاً وتجمعاً أضعف.
التركيب
تتكون قشرة النانو من خلال عملية متعددة المراحل:[2]
- الحصول على جزيئات سيليكا نانوية داخل المحلول (غالباً حمض رباعي كلوروأوريكtetrachloroauric acid وعامل مختزل).
وتتكون مرحلة المحلول تلك من تجميع جسيمات الذهب النانوية من خلال الاختزال باستخدام حمض رباعي كلوروأوريك tetrachloroauric acid نتيجة استخدام عامل مختزل. وتوجد مجموعة مختلفة من العوامل المختزلة المستخدمة وكلها قد تؤثر بصورةٍ كبيرةٍ على تناسق الجسيم النانوي.
- وصل بذرة غروانية صغيرة جداً على هذه الجسيمات النانوية العازلة ومنها (سيلنيد الزنك zinc selenide، الياقوت sapphire، والزجاج glass) مما ينتج القشرة الغير متواصلة.
- نمو قشرة متصلة من خلال استخدام الاختزال الكيميائي للمعدن المتصل بالجسيمات النانوية العازلة للكهرباء.
ووإن تعذر الحصول على قشرة متناسقة، فإنها قد تؤثر بصورةٍ كبيرةٍ على الخصائص البصرية للقشرة النانوية. ومثال جيد على هذا يتمثل في البيضة النانوية nanoegg، هي عبارة عن قشرة نانوية معدنية والتي ليس لها سماكة منتظمة. وتسفر خاصية عدم الانتظام عن حدوث أصداء إضافية للبلازمون التهجيني hybridized Plasmon في الطيف مما يجعل من عملية الاقتران غير فعالة.
التطبيقات
نتيجة أن للقشرة النانوية خصائص وسمات بصرية وكيميائية مفضلة بصورةٍ كبيرةٍ، فإنها غالباً ما تستخدم في التصوير الطبي الحيويbiomedical imaging، التطبيقات العلاجية، تعزيزات الفلوريسين للبواعث الجزيئية الضعيفة، مطياف رامان السطحي المحسن، وكذلك في المطياف السطحي المحسن لامتصاص الأشعة تحت الحمراء.[1]
علاج السرطان
يمكن الاستفادة من قشور الذهب النانوية في علاج الأورام السرطانية حيث تنغمس في الأورام من خلال استخدام البلعمة phagocytosis حيث تبتلع البالعات (خلايا تبتلع الأجسام الغريبة) phagocytes قشور النانو من خلال غشاء الخلية لتشكيل اليبلوع phagosome أو الخلية البالعة الكبيرة macrophage. وبعد هذه المرحلة تنغمس داخل الخلية وغالباً ما تستخدم الإنزيمات في عملية تمثيلها وإخراجها مرةً أخرى خارج الخلية. ولا يتم تمثيل هذه القشور النانوية ومن ثم لتصبح فعالة فهي في حاجة إلى أن تكون داخل خلايا الورم السرطانية ويستخدم «موت الخلية بالإشعاع الضوئي»photoinduced cell death في إزالة خلايا الورم. وقد تم توضيح هذا المخطط في شكل رقم 2.
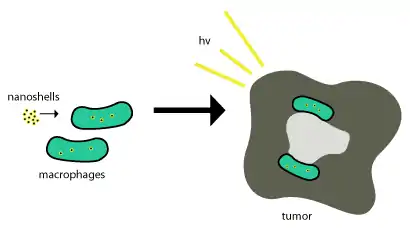
كما تم توصيل العلاجات القائمة على الجسيمات النانوية إلى داخل الأورام بنجاح من خلال الاستفادة من القدرة النفاذية المحسنة enhanced permeability وبقاء الأثر retention effect، وهو يعبر عن خاصية تسمح للهياكل والأجسام النانوية المقياس ليتم سحبها إلأى أعلى داخل الأورام بدون مساعدة الأجسام المضادة. [4] إلا أن عملية توصيل قشور النانو إلى داخل تلك المناطق الهامة بالأورام قد يمثل صعوبةً بالغةً. حيث هنا تحاول معظم قشور النانو الاستفادة من التوظيف الطبيعي للورم للوحيدات monocytes في عملية التوصيل كما تم ملاحظته في الشكل السابق (شكل 2). ويطلق على هذا النظام في التوصيل «حصان طروادة».[3]
وتعد تلك الطريقة ناجحة في علاج الأورام بسبب أن الأورام عبارة عن ¾ خلايا بالغة كبيرة وبمجرد دخول الخلايا الوحيدة monocytes إلى داخل الورم، فإنها تتميز بتحولها إلى خلايا بالغة ملتهمة أيضاً macrophages والتي ستكون في حاجةٍ حينئذٍ إلى الحفاظ على شحنة الجسيمات النانوية. وبعد وصول قشور النانو إلى مركز النخرية، فإن الإضاءة بالأشعة تحت الحمراء- القريبة تستخدم لتدمير الخلايا البالعة الكبيرة macrophages المصاحبة للورم.
وبما أنه من السهل ضبط قشور النانوو بصرياً لتصبح قادرة على امتصاص الضوء بالمنطقة القريبة أوالمجاورة تحت الحمراء، حيث يوجد امتصاص بصري منخفض المدى في النسيج، فإن عملية الاختراقٍ باستخدام الإشعاع وسيلة الأمثل في علاج الأنسجة الأعمق. كما أنه قبل التعرض لأية إضاءة، فإن القشرة النانوية تكون خاملة داخل الخلية. وغالباً ما تتم عملية الإضاءة باستخدام أشعة الليزر، وهذا الضوء يوجه إلى داخل القشرة النانوية ويتحول إلى حرارة والتي تزيد من درجة حرارة القشرة النانوية لما يزيد عن 30 درجة حرارة مئوية. وقد أثبتت عملية العلاج الاستئصالي الضوء حراري القائم على قشور النانو nanoshell-based photothermal ablation therapy نجاحاً في معالجة الفئران التي تعاني من تقليص متورم ذات معدلات أعلى من 90%.[3]
التصوير الطبي الحيوي
وفرت تقنيات قشور النانو جودةٍ عاليةٍ في دقة الصورة بالإضافة إلى القدرة على التصوير الوظيفي الغير غازٍ للأنسجة noninvasive functional imaging of tissues بأسعارٍ زهيدةٍ. إلا أنه ولسوء الحظ، فإن التصوير الطبي ليس بمتقدمٍ جداً بسبب أنها (التقنيات) تعاني من ضعف الإشارات البصرية والاختلافات الطيفية الخفية بين الأنسجة السليمة والمريضة. في حين يوجد اهتمامٌ متزايدٌ بالتقنيات البصرية ذات العوامل المتناقضة الخارجية الجديدة، والتي صممت من أجل تحديد الدلائل الجزيئية الخاصة بالأورام السرطانية، وذلك بهدف تحسين حدود الاكتشاف والفعالية العلاجية للتصوير البصري.[3]
الخصائص الكهروكيميائية المعززة
وتتحسن مؤشرات رامان السطحية المحسنة وعملية امتصاص الأشعة تحت الحمراء السطحية المسحنة كذلك بسبب مجموعةٍ سداسيةٍ محكمة الغلق وثنائية الأبعاد من قشور النانو a two dimensional hexagonal close-packed array of nanoshells ذات فجواتٍ نانويةٍ بين الجسيمات النانوية. وقد ساد المعتقد أن آلية التحسن المسيطرة هي كهرومغناطيسية، حيث توفر الركيزة التحسينات القوية، والمتمثلة في عملية الإشراق القصوى superradiance. وعملية الإشراق تلك هي مزاوجةٍ بين الأنظمة المتجاورة الرنانة والتي ينتج عنها تخميدٍ إشعاعيٍ محسنٍ enhanced radiative damping. ويسفر تأثير «قضيب البرق» عن التحسنات التي تحدث في المجال والتي تلاحظ مع منتصف صدى أو رنين الأشعة تحت الحمراء. ويحدث هذا التأثير عندما تصبح المعادن موصلاتٍ فعالةٍ ومن ثم تطلق حقلاً كهربائياً من داخل المعادن والتي تمثل القناة الموصلة للمجال الكهربائي إلى داخل الوصلة بين كل قشرة نانوية، مما يسفر عن إنتاج كثافاتٍ ميدانيةٍ هائلةٍ.[4]
اطلع على
المصادر
- Loo, C; Lin, A; Hirsch, L; Lee, Mh; Barton, J; Halas, N; West, J; Drezek, R (فبراير 2004)، "Nanoshell-enabled photonics-based imaging and therapy of cancer"، Technology in cancer research & treatment، 3 (1): 33–40، PMID 14750891، مؤرشف من الأصل (Free full text) في 23 أكتوبر 2007.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Brinson, Be; Lassiter, Jb; Levin, Cs; Bardhan, R; Mirin, N; Halas, Nj (نوفمبر 2008)، "Nanoshells Made Easy: Improving Au Layer Growth on Nanoparticle Surfaces"، Langmuir، 24: 14166، doi:10.1021/la802049p، PMID 19006344.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Choi, Mr; Stanton-Maxey, Kj; Stanley, Jk; Levin, Cs; Bardhan, R; Akin, D; Badve, S; Sturgis, J; Robinson, Jp; Bashir, R; Halas, Nj; Clare, Se (ديسمبر 2007)، "A cellular Trojan Horse for delivery of therapeutic nanoparticles into tumors"، Nano letters، 7 (12): 3759–65، doi:10.1021/nl072209h، PMID 17979310.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Le, F; Brandl, Dw; Urzhumov, Ya; Wang, H; Kundu, J; Halas, Nj; Aizpurua, J; Nordlander, P (أبريل 2008)، "Metallic nanoparticle arrays: a common substrate for both surface-enhanced Raman scattering and surface-enhanced infrared absorption"، ACS nano، 2 (4): 707–18، doi:10.1021/nn800047e، PMID 19206602.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
انظر أيضا
- التقانة النانوية الحيوية
- جسيم نانوي
- علم الاحياء النانوي
- تقانة نانوية
- جسيم نانوي مغناطيسي
- الهلام النانوي
- بوابة علوم
- بوابة تقانة
- بوابة تقنية النانو