جسم بلعمي
في علم الأحياء الخلوي، الجسيم البلعمي[1][2] أو اليبلوع أو الفجوة الغذائية (بالإنجليزية: Phagosome) هي الفجوة الناتجة من عملية إحاطة الجسم المراد ابتلاعه بواسطة الخلايا البلعمية. تتحد الجسيمات الحالة مع اليبلوع لهضم وتحليل الجسم الموجود في الداخل.
| علم الأحياء الخلوي | |
|---|---|
| الخلية الحيوانية | |
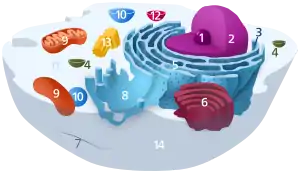 مكونات الخلية الحيوانية النموذجية:
| |
تتشكل حويصلة حول جزيء غمرته الخلايا البلعمية عن طريق عملية البلعمة ليتشكل لدينا ما يعرف بالجسم البلعمي (اليبلوع). تشمل الخلايا البلعمية المتخصصة البلاعم الكبيرة والعدلات والخلايا التغصنية (دي سي). يتكون الجسم البلعمي من اندماج غشاء الخلية حول الكائنات الدقيقة، أو عند تعرض الخلايا لظاهرة الهرم أو ظاهرة الموت الخلوي المبرمج. تحتوي الأجسام البلعمية على بروتينات مرتبطة بالغشاء من أجل دمجها مع الليزوزومات لتشكيل الجسيم الحال البلعمي الناضج. تحتوي الليزوزومات على إنزيمات وأنواع أكسجين تفاعلية (آر أو إس) تقتل وتحلل العوامل الممرضة. يمكن تشكل الخلايا البالعة غير المتخصصة، ولكنها غير قادرة على ابتلاع سوى نطاق صغير من الجزيئات، ولا تحتوي على أنواع الأكسجين التفاعلية (آر أو إس). تُنقل المواد المفيدة (مثل الأحماض الأمينية) من الجسيمات المهضومة إلى السيتوزول، وتُفرز الخلايا المخلفات لإزالتها. تشكيل الجسم البلعمي أمر بالغ الأهمية من أجل تحقيق التوازن ضمن الأنسجة وفي دفاعات المضيف الفطرية والتكيفية على حد سواء من أجل مواجهة مسببات الأمراض.
تستغل بعض البكتيريا البلعمة بالرغم من ذلك كاستراتيجية للغزو بطريقتين: إما أنها تتكاثر داخل الجسم البلعمي (مثل جرثومة الكوكسيلا على سبيل المثال)،[3] أو تهرب نحو السيتوبلازم قبل اندماج الجسيم البلعمي مع الليزوزوم (مثل جرثومة الريكيتسيا).[4] يمكن للعديد من المتفطرات، بما في ذلك المتفطرة السلية[5][6] ونظيرة السل المتفطرة،[7] التعامل مع البلاعم المضيفة من أجل منع الليزوزومات من الاندماج مع الجسيم البلعمي وخلق الجسيم الحال البلعمي الناضج. يحافظ النضوج غير المتكمل للجسيم البلعمي على بيئة مناسبة للعوامل الممرضة الموجودة بداخله.[8]
التكوين
يعتبر الجسم البلعمي كبيرًا بما يكفي لتحطيم البكتيريا بأكملها، أو الخلايا الهرمة والمتعرضة للموت الخلوي المبرمج، والتي يبلغ قطرها عادة 0.5 ميكرومتر.[9] يعني هذا أن الجسم البلعمي أكبر من الإندوزوم (الدخلول)، والذي يقاس حجمه بالنانومترات.
يتشكل الجسم البلعمي عند ارتباط العوامل الممرضة أو الأوبسونين بمستقبلات الغشاء، والتي توُزع عشوائياً على سطح الخلية البالعة. تؤدي الإشارات «من الداخل للخارج» عند الارتباط إلى إطلاق بلمرة الأكتين وتكوين الغشاء الذي يحيط وينصهر خلف الكائنات الحية الدقيقة. تكون هناك حاجة لبروتين كيناز سي وفوسفوينوسيتيد 3-كيناز وفوسفوليباز سي (بي إل سي) من أجل الإشارة والتحكم في تطبيع الجسيمات.[10] يمكن لمستقبلات سطح الخلية أن ترتبط أكثر بالجسيمات في آلية تشبه «السحّاب أو السوستة» إذ تحيط بالعامل الممرض من كل الاتجاهات، ما يزيد من ملاءمة الربط.[11] تنقسم مستقبلات البلعمة لـ : مستقبلات إف سي (إف سي آر) والمستقبلات التكميلية (سي آر) ومستقبلات المانوز والديكتين-1، ما يعني إمكانية تحفيز البلعمة في حال عُبر عنها ضمن الخلايا غير البلعمية مثل الخلايا الليفية على سبيل المثال.[12] تشارك بروتينات أخرى مثل مستقبلات «تول-لايك» في التعرف على أنماط العوامل الممرضة وغالبًا ما تُدمج مع البلعوم لكنها لا تؤدي للبلعمة في الخلايا غير البلعمية على وجه التحديد، لذلك لا تعتبر مستقبلات بلعمية.
الإعداد للبلعمة
يُصنف الأبسون على أنه واسمة جزيئية مثل الأجسام المضادة والمكملات التي ترتبط بالعوامل الممرضة وتنظم وتسهل عملية البلعمة. يعتبر الغلوبولين المناعي آي جي جي (IgG) النوع الرئيسي من الأجسام المضادة الموجودة في المصل. وهو جزء من الجهاز المناعي التكيفي، لكنه يرتبط أيضاً بالاستجابة الفطرية عن طريق تجنيد البلاعم من أجل بلعمة العوامل الممرضة. يرتبط الجسم المضاد بالميكروبات ذات مجال «فاب» المتغير، ويرتبط مجال Fc بمستقبلات Fc (FcR) من أجل الحث على البلعمة.
للاستيعاب الداخلي المتمم نتوءات غشائية قليلة الأهمية، لكن، تتقارب إشارة التيار لكلا المسارين من أجل تنشيط عائلة الـ آر إتش أو Rho المنشطة لـ [13]GTPases كي يتم التحكم في بلمرة الأكتين وهو أمر مطلوب حتى تندمج البلعمة مع الإندوسومات والليزوزومات.
الخلايا غير البلعمية
تمتلك الخلايا البلعمية غير المتخصصة الأخرى درجة من نشاط البلعمة، مثل الخلايا الظهارية الدرقية والمثانية التي يمكن أن تبتلع كريات الدم الحمراء بالإضافة للخلايا الظهارية في شبكية العينوالتي تستوعب قضبان الشبكية.[9] ومع ذلك، فإن الخلايا البلعمية غير المتخصصة لا تعبر عن مستقبلات بلعمية معينة مثل FcR ولها معدل داخلي أقل بكثير.
يمكن لبعض البكتيريا الغازية أن تحفز البلعمة في الخلايا غير البلعمية للمساعدة على امتصاص المضيف. على سبيل المثال: يمكن للشيغيلا أن تفرز سمومًا تغير من تركيب الهيكل الخلوي للمضيف وتدخل إلى الجانب الوحشي للخلايا المعوية.[14]
البنية
نظرًا إلى أن غشاء الجسم البلعمي يتكون من اندماج غشاء البلازما، فإن التركيب الأساسي للطبقة الفوسفولبيدية الثنائية هو نفسه. ثم تندمج الإندوسومات والليزوزومات مع الجسم البلعمي للإسهام في تكوين الغشاء، خاصة عندما يكون الجسيم الغارق كبيرًا جدًا، مثل الطفيليات.[15] بالإضافة لتوفيرها مختلف البروتينات الغشائية للبلعوم وتعديلها للبنية الخلوية.
تستطيع الأجسام البلعمية أن تبتلع حبات اللاتكس الاصطناعية منخفضة الكثافة ثم تنقى على طول معامل تركيز السكروز، ما يسمح بدراسة التركيب والبنية.[16] يمكن تمييز عملية النضج أيضًا عن طريق تنقية الأجسام البلعمية في نقاط زمنية مختلفة. تتميز البلعميات المبكرة بـ Rab5، والتي تصبح Rab7 في البلعميات المتأخرة.
عملية النضج
يصبح البلعم الناشئ أكثر حموضة من درجة الحموضة 6.5 إذ تصبح درجة حموضته 4 عند نضوجه، ويكتسب علامات البروتين المميزة والإنزيمات المائية. مع التأكيد على أنه لا يصنف كجرثوم بطبيعته. تعمل الإنزيمات المختلفة في درجات حموضة مثلى مختلفة لكل منها، وتشكل نطاقًا يعمل كل منها من خلاله في مراحل صغيرة ومختصرة من عملية النضج. يمكن ضبط نشاط الإنزيم عن طريق تعديل مستوى الأس الهيدروجيني، ما يتيح مرونة أكبر. يتحرك الجسم البالع على طول الأنابيب الدقيقة للهيكل الخلوي، حيث يندمج مع الإندوسومات والليزوزومات بشكل متتابع بطريقة «التقبيل والفرار» الديناميكية.[17] يعتمد هذا النقل داخل الخلايا على حجم الأجسام البلعمية. تُنقل العضيات الكبيرة (التي يبلغ قطرها حوالي 3 ميكرومتر) بثبات شديد من محيط الخلية باتجاه المنطقة المحيطة بالنواة، بينما تُنقل العضيات الأصغر (التي يبلغ قطرها حوالي 1 ميكرومتر) بشكل ثنائي الاتجاه من الأمام والخلف بين مركز ومحيط الخلية.[18] تُسلم مضخات البروتون الفراغية (v-ATPase) إلى البلعم لتحمض الحجرة العضوية، ما يخلق بيئة أكثر عدائية للعوامل الممرضة مع تسهيل تدهور البروتين. تُغير طبيعة البروتينات البكتيرية في درجات الحموضة المنخفضة ويصبح الوصول إلى البروتياز والذي لا يتأثر بالبيئة الحمضية أكثر سهولة. يُعاد تدوير الإنزيمات من الجسم البلعمي في وقت لاحق وقبل الابتلاع حتى لا تضيع. يتغير تكوين الغشاء الفوسفولبيدي أيضًا مع نضوج البلعوم.[16]
يستغرق الانصهار من دقائق إلى ساعات حسب محتويات الجسم البلعمي؛ تدوم عملية الـ FcR أو الاندماج باستخدام مستقبلات المانوز أقل من 30 دقيقة، أما الأجسام البلعمية التي تحتوي على حبات اللاتكس فتستغرق عدة ساعات حتى تندمج مع الليزوزومات.[9] يقترح أن تكوين الغشاء البلعمي يؤثر على معدل النضج. تحتوي المتفطرات السلية على جدار خلايا كاره للماء للغاية، والذي يُفترض أنه يمنع إعادة تدوير الغشاء وتوظيف عوامل الانصهار، وبالتالي لا ينغمس الجسم البلعمي بالليزوزومات وتتجنب البكتيريا التدهور.[19]
تُنقل الجزيئات ذات اللمعة الأصغر عن طريق الاندماج أسرع من الجزيئات الأكبر حجمًا، ما يشير إلى أن قناة مائية صغيرة تتشكل بين الجسم البلعمي والحويصلات الأخرى أثناء عملية «التقبيل والفرار»، والتي يُسمح فيها فقط بتبادل محدود للخلايا.[9]
انظر أيضًا
مراجع
- معجم مرعشي الطبي نسخة محفوظة 07 فبراير 2015 على موقع واي باك مشين.
- سمبل دكشنري؛ تاريخ الولوج 15 نوفمبر 2014 نسخة محفوظة 29 نوفمبر 2014 على موقع واي باك مشين.
- Hackstadt T, Williams JC (مايو 1981)، "Biochemical stratagem for obligate parasitism of eukaryotic cells by Coxiella burnetii"، Proceedings of the National Academy of Sciences of the United States of America، 78 (5): 3240–4، doi:10.1073/pnas.78.5.3240، PMC 319537، PMID 6942430.
- Winkler HH (1990)، "Rickettsia Species (As Organisms)"، Annual Review of Microbiology، 44: 131–153، doi:10.1146/annurev.micro.44.1.131.
- MacMicking JD, Taylor GA, McKinney JD (أكتوبر 2003)، "Immune control of tuberculosis by IFN-gamma-inducible LRG-47"، Science، 302 (5645): 654–9، Bibcode:2003Sci...302..654M، doi:10.1126/science.1088063، PMID 14576437.
- Vandal OH, Pierini LM, Schnappinger D, Nathan CF, Ehrt S (أغسطس 2008)، "A membrane protein preserves intrabacterial pH in intraphagosomal Mycobacterium tuberculosis"، Nature Medicine، 14 (8): 849–54، doi:10.1038/nm.1795، PMC 2538620، PMID 18641659.
- Kuehnel MP, Goethe R, Habermann A, Mueller E, Rohde M, Griffiths G, Valentin-Weigand P (أغسطس 2001)، "Characterization of the intracellular survival of Mycobacterium avium ssp. paratuberculosis: phagosomal pH and fusogenicity in J774 macrophages compared with other mycobacteria"، Cellular Microbiology، 3 (8): 551–66، doi:10.1046/j.1462-5822.2001.00139.x، PMID 11488816.
- Tessema MZ, Koets AP, Rutten VP, Gruys E (نوفمبر 2001)، "How does Mycobacterium avium subsp. paratuberculosis resist intracellular degradation?"، The Veterinary Quarterly، 23 (4): 153–62، doi:10.1080/01652176.2001.9695105، PMID 11765232.
- Aderem A, Underhill DM (أبريل 1999)، "Mechanisms of phagocytosis in macrophages"، Annual Review of Immunology، 17 (1): 593–623، doi:10.1146/annurev.immunol.17.1.593، PMID 10358769.
- Aderem A (يونيو 2003)، "Phagocytosis and the inflammatory response"، The Journal of Infectious Diseases، 187 Suppl 2 (s2): S340-5، doi:10.1086/374747، PMID 12792849.
- Dupuy AG, Caron E (يونيو 2008)، "Integrin-dependent phagocytosis: spreading from microadhesion to new concepts"، Journal of Cell Science، 121 (11): 1773–83، doi:10.1242/jcs.018036، PMID 18492791.
- Underhill DM, Ozinsky A (أبريل 2002)، "Phagocytosis of microbes: complexity in action"، Annual Review of Immunology، 20 (1): 825–52، doi:10.1146/annurev.immunol.20.103001.114744، PMID 11861619.
- Kaplan G (أغسطس 1977)، "Differences in the mode of phagocytosis with Fc and C3 receptors in macrophages"، Scandinavian Journal of Immunology، 6 (8): 797–807، doi:10.1111/j.1365-3083.1977.tb02153.x، PMID 561436.
- Köhler H, Rodrigues SP, McCormick BA (مارس 2002)، "Shigella flexneri Interactions with the Basolateral Membrane Domain of Polarized Model Intestinal Epithelium: Role of Lipopolysaccharide in Cell Invasion and in Activation of the Mitogen-Activated Protein Kinase ERK"، Infection and Immunity، 70 (3): 1150–8، doi:10.1128/IAI.70.3.1150-1158.2002، PMC 127798، PMID 11854195.
- Desjardins M, Houde M, Gagnon E (أكتوبر 2005)، "Phagocytosis: the convoluted way from nutrition to adaptive immunity"، Immunological Reviews، 207 (1): 158–65، doi:10.1111/j.0105-2896.2005.00319.x، PMID 16181334.
- Desjardins M, Celis JE, van Meer G, Dieplinger H, Jahraus A, Griffiths G, Huber LA (ديسمبر 1994)، "Molecular characterization of phagosomes"، The Journal of Biological Chemistry، 269 (51): 32194–200، PMID 7798218.
- Gotthardt D, Warnatz HJ, Henschel O, Brückert F, Schleicher M, Soldati T (أكتوبر 2002)، "High-resolution dissection of phagosome maturation reveals distinct membrane trafficking phases"، Molecular Biology of the Cell، 13 (10): 3508–20، doi:10.1091/mbc.E02-04-0206، PMC 129962، PMID 12388753.
- Keller S, Berghoff K, Kress H (ديسمبر 2017)، "Phagosomal transport depends strongly on phagosome size"، Scientific Reports، 7 (1): 17068، Bibcode:2017NatSR...717068K، doi:10.1038/s41598-017-17183-7، PMC 5719076، PMID 29213131.
- de Chastellier C, Thilo L (سبتمبر 1997)، "Phagosome maturation and fusion with lysosomes in relation to surface property and size of the phagocytic particle"، European Journal of Cell Biology، 74 (1): 49–62، PMID 9309390.
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي