كوبالتوسين
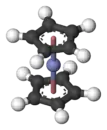
الكوبالتوسين مركب عضوي فلزي له الصيغة C10H10Co والتي يمكن أن تكتب Co(η5C5H5)2، وهو من المعقدات التساندية وينتمي إلى الميتالوسينات، التي تعد صنفاً من المركبات الشطيرية، ويكون على شكل بلورات سوداء.
| كوبالتوسين | |
|---|---|
 كوبالتوسين |
 كوبالتوسين |
| الاسم النظامي (IUPAC) | |
مضاعف حلقي بنتادينيل الكوبالت | |
| أسماء أخرى | |
كوبالتوسين | |
| المعرفات | |
| الاختصارات | Cp2Co |
| رقم CAS | 1277-43-6 |
| بوب كيم (PubChem) | 92884 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | Co(η5C5H5)2 |
| الكتلة المولية | 189.12 غ/مول |
| المظهر | بلورات سوداء |
| نقطة الانصهار | 176-180 °س يتفكك |
| الذوبانية في الماء | غير منحل بالماء |
| الذوبانية | ينحل في المحلات غير القطبية |
| المخاطر | |
| ترميز المخاطر |  F F |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
- مركب الكوبالتوسين حساس تجاه الهواء فهو يتأكسد بسهولة بأكسجين الهواء إلى الكاتيون + Cp2Co ذي اللون الأصفر، لذا يجب حفظه تحت جو من غاز خامل.
- لا ينحل الكوبالتوسن في الماء، لكنه ينحل جيداً في المحلات غير القطبية مثل الهكسان أو التولوين.
- يتفاعل الكوبالتوسين مع غاز أحادي أكسيد الكربون مشكلاً Co(C5H5)(CO)2، وهو عبارة عن سائل قابل للتقطير، ولديه ثباتية تجاه الهواء.
البنية
يكون للكوبالتوسين البنية النمطية لمركبات الميتالوسين الشطيرية، حيث تتوسط ذرة فلز مركزية الفراغ بين حلقتي بنتادينيل متوازيتين.[4] وفي حالة الكوبالتوسين تكون الذرة المركزية عبارة عن ذرة كوبالت، حالة أكسدتها +2. يمتلك الكوبالتوسين في بنيته 19 إلكترونا تكافؤياً، 7 من ذرة الكوبالت، و6 من كل حلقة بنتادينيل، فيكون المجموع 7 + 12 = 19، وهو بذلك لديه إلكتروناً واحداً زيادة عن قاعدة 18-إلكترون، والتي تنطبق عادة على أغلب معقدات الفلزات الانتقالية العضوية. يشغل الإلكترون الفائض مداراً ذرياً غير رابط وذلك بالنسبة للرابطة Co-C، بالتالي تكون الروابط بين الكوبالت وذرات الكربون أطول قليلاً من تلك التي بين الحديد والكربون في الفرّوسين الذي يحقق قاعدة 18 إلكترون، بحيث أن المسافة بين حلقتي البنتادينيل Cp-Cp تكون 340 بيكومتر في الكوبالتوسين، مقابل 332 بيكومتر في الفروسين.
إن العديد من التفاعلات الكيميائية للكوبالتوسين تتأثر بوجود هذا الإلكترون الفائض، بحيث أن المعقد يميل إلى منح هذا الإلكترون مشكلاً كاتيون الكوبالتوسينيوم.
2Co(C5H5)2 + I2 → 2[Co(C5H5)2]+ + 2I− 19e−18e−
تفاعلات أكسدة-اختزال
يعد الكوبالتوسين من العوامل المختزلة التي تقوم على تبادل إلكترون واحد. تكون القدرة الاختزالية للكوبالتوسين أقل من تلك التي لمركب عشاري ميثيل الكوبالتوسين، Co(C5Me5)2، الذي يتخلى عن الإلكترون الفائض بصورة أسهل، نتيجة الكثافة الإلكترونية العالية التي تقدمها مجموعات الميثيل. يمتاز الكوبالتوسين ومشتقه الميثيلي بأنهما من الأمثلة النادرة للعوامل المختزلة التي تنحل في المحلات غير القطبية. تحوي القائمة أدناه كمونات الاختزال لهذه المركبات مع استخدام زوج فروسين-فروسينيوم كمعيار:
- Fe(C5H5)2+/Fe(C5H5)2: 0 V
- Fe(C5Me5)2+/Fe(C5Me5)2: -0.59 V
- Co(C5H5)2+/Co(C5H5)2: -1.33 V
- Co(C5Me5)2+/Co(C5Me5)2: -1.94 V
التحضير
يحضر الكوبالتوسين من تفاعل حلقي بنتادينيد الصوديوم NaC5H5 مع كلوريد الكوبالت الثنائي اللامائي أو مع سداسي أمين كلوريد الكوبالت الثنائي في وسط من رباعي هيدرو الفوران THF، حيث يتشكل ملح كلوريد الصوديوم كناتج ثانوي، ويفصل الكوبالتوسين بالتسامي تحت الفراغ.[5]
- CoCl2 + 2NaCp → CoCp2 + 2NaCl
- Co(NH3)Cl2 + 2NaCp → CoCp2 + 2NaCl + 6NH3
الاستخدامات
يستخدم الكوبالتوسين بشكل شائع في المختبرات كعامل اختزال يقوم على أساس تبادل إلكترون واحد.[6] يمتاز الزوج الناتج عن تفاعلات الأكسدة-اختزال بثباتيته، لذلك يستخدم أحيانا كمعيار داخلي في الفولتية الدورية Cyclic voltammetry.
المراجع
- العنوان : Bis(cyclopentadienyl)cobalt — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/92884 — تاريخ الاطلاع: 14 أكتوبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/92884
- Bis(cyclopentadienyl)cobalt(II) | Sigma-Aldrich نسخة محفوظة 5 أكتوبر 2020 على موقع واي باك مشين.
- C. Elschenbroich, A. Salzer ”Organometallics : A Concise Introduction” (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- King, R. B. “Organometallic Syntheses” Volume 1: Academic Press: New York, 1965.
- N. G. Connelly, W. E. Geiger (1996)، "Chemical Redox Agents for Organometallic Chemistry"، Chem. Rev.، 96: 877–910، doi:10.1021/cr940053x.
- بوابة الكيمياء