حلقي البنتاديين
حلقي البنتاديين (أو 3,1-حلقي البنتاديين)[3] هو مركب عضوي من مجموعة الألكينات الحلقية، له الصيغة الكيميائية C5H6، ويكون على شكل سائل عديم اللون.
| حلقي البنتاديين | |
|---|---|
 حلقي البنتاديين |
 حلقي البنتاديين |
 حلقي البنتاديين | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Cyclopenta-1,3-diene | |
| أسماء أخرى | |
1,3-Cyclopentadiene | |
| المعرفات | |
| رقم CAS | 542-92-7 |
| بوب كيم (PubChem) | 7612 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C5H6 |
| الكتلة المولية | 66.10 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.80 غ/سم3 |
| نقطة الانصهار | −97 °س |
| نقطة الغليان | 40 °س |
| الذوبانية في الماء | غير منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تتكون بنية المركب من حلقة خماسية حاوية على رابطتين مضاعفتين، وهو بذلك ينتمي إلى مركبات الديينات. يسمّى الأنيون الذي يحصل عليه من المركب باسم أيون حلقي البنتاديينيل، ويرمز له عادة Cp.
التحضير
يحضر حلقي البنتاديين مخبرياً من التفكك الحراري لمركب ثنائي حلقي البنتاديين، وذلك عادة بوجود حفاز من الحديد وبإجراء عملية تقطير.[4]
أما عملياً فيتم الحصول عليه من ثنائي حلقي البنتاديين من خلال عملية تكسير بالبخار للنافثا.[5]
الخواص
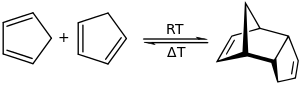
يوجد المركب على شكل سائل عديم اللون، إلا أنه عند درجة حرارة الغرفة يخضع المركب لتفاعل ديمرة من خلال تفاعل ديلز-ألدر؛ ويمكن الحد من تفاعل الديمرة بتخزين حلقي البنتاديين لدرجات حرارة أدنى من −20 °س.[5] تعود سهولة الديمرة وفق تفاعل ديلز-ألدر إلى غياب الإعاقة الفراغية بالمقارنة مع الديينات الأخرى.[6]
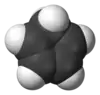
لمركب حلقي البنتاديين بنية مستوية.[7]
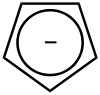
حلقي البنتاديينيل
يمتلك حلقي البنتاديين خواصاً حمضية غير شائعة بالنسبة للهيدروكربونات (pKa = 16)، ويعود ذلك إلى الثباتية العالية لأيون حلقي البنتاديينيل (يرمز لها اختصاراً عادةً Cp) بسبب الرنين في الصيغ الكيميائية (ميزوميرات). يمكن إجراء عملية نزع بروتون من المركب باستخدام هيدريد الصوديوم أو ن-بوتيل الليثيوم أو بالاستخدام المباشر لفلز قلوي مثل البوتاسيوم:
يستطيع أيون حلقي البنتاديينيل تشكيل معقدات تناسقية مع كاتيونات الفلزات ويشكل مركبات شطيرية، أشهرها معقدات ميتالوسين مع الفلزات الانتقالية.[8]
الاستخدامات
يستخدم حلقي البنتاديين بشكل رئيسي في الكيمياء العضوية الفلزية كربيطة في المعقدات التناسقية.[9]
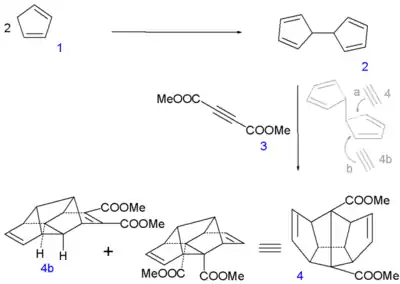
بالإضافة إلى استخدامه كمادة بادئة في تحضير مركب دوديكاهيدران؛[10] وذلك بإجراء ديمرة اختزالية للمركب للحصول على ثنائي هيدرو الفولفالين كخطوة أولى:
طالع أيضاً
المراجع
- العنوان : Cyclopentadiene — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/7612 — تاريخ الاطلاع: 6 أكتوبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/7612
- ترجمة 1,3 - Cyclopentadiene حسب بنك باسم للمصطلحات العلمية؛ مدينة الملك عبد العزيز للعلوم والتقنية، تاريخ الوصول: 21-02-2017..
- Moffett(1962)."Cyclopentadiene and 3-Chlorocyclopentene". Org. Synth.; Coll. Vol. 4: 238.
- Hönicke, Dieter; Födisch, Ringo; Claus, Peter; Olson, Michael (2005), "Cyclopentadiene and Cyclopentene", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, DOI=10.1002/14356007.a08_227
- Levandowski؛ Houk (2015)، "Theoretical Analysis of Reactivity Patterns in Diels–Alder Reactions of Cyclopentadiene, Cyclohexadiene, and Cycloheptadiene with Symmetrical and Unsymmetrical Dienophiles."، J. Org. Chem.، 80 (7): 3530–3537، doi:10.1021/acs.joc.5b00174.
- Faustov؛ Egorov؛ Nefedov؛ Molin (2000)، "Ab initio G2 and DFT calculations on electron affinity of cyclopentadiene, silole, germole and their 2,3,4,5-tetraphenyl substituted analogs: structure, stability and EPR parameters of the radical anions"، Phys. Chem. Chem. Phys.، 2 (19): 4293–4297، doi:10.1039/b005247g.
- Girolami؛ Rauchfuss؛ Angelici (1999)، Synthesis and Technique in Inorganic Chemistry، Mill Valley, CA: University Science Books، ISBN 0-935702-48-2.
- Hartwig, J. F. (2010)، Organotransition Metal Chemistry: From Bonding to Catalysis، New York, NY: University Science Books، ISBN 1-891389-53-X.
- Paquette؛ Wyvratt (1974)، "Domino Diels–Alder reactions. I. Applications to the rapid construction of polyfused cyclopentanoid systems"، J. Am. Chem. Soc.، 96 (14): 4671–4673، doi:10.1021/ja00821a052.
- بوابة كيمياء عضوية
- بوابة الكيمياء