تآصل الفوسفور
يقصد بتعبير تآصل الفوسفور وجود عنصر الفوسفور في الطبيعة على شكل متآصل، أي وجوده على عدة أشكال نظراً لاختلاف البنية.
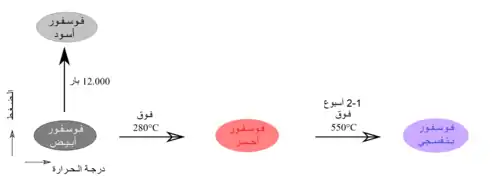
أشهر متآصلات الفوسفور الصلبة هي الفوسفور الأبيض والأحمر والأسود والبنفسجي. يمكن أن يوجد الفوسفور في الحالة الغازية على شكل ثنائي الفوسفور.
الفوسفور الأبيض

الفوسفور الأبيض هو الاسم الذي يطلق على الشكل عندما يكون فيه الفوسفور مرتبطاً بشكل رباعي P4، حيث تحتل ذرات الفوسفور رؤوس رباعي سطوح. يعاني رباعي الفوسفور على هذا الشكل من إجهاد الحلقة لذلك يكون غير مستقراً. وهذا يفسر النشاط الكيميائي للفوسفور على هذا الشكل. توجد البنية البلورية للفوسفور الأبيض على هيئتين؛ الأولى هي الهيئة ألفا (α)، وهي الحالة القياسية للعنصر، إلا أنها شبه مستقرة تحت الشروط القياسية؛[1] وهي تتبع النظام البلوري المكعب مركزي الجسم، وتتحول بشكل عكوس إلى الهيئة بيتّا (β) عند الدرجة 195.2 كلفن، وهي تتبع النظام البلوري السداسي.[2]

يستحصل على الفوسفور الأبيض صناعياً من صخر الفوسفات بالتسخين في فرن بوجود الكربون أو السيليكا.[3]
يحترق الفوسفور الأبيض تلقائياً عند التماس مع أكسجين الهواء، حيث يتشكل أكسيد الفوسفور الخماسي:
الفوسفور الأحمر

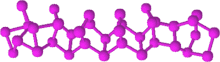
يمكن الحصول على الفوسفور الأحمر من تسخين الفوسفور الأبيض بمعزل عن أكسجين الهواء إلى درجات حرارة تصل إلى 300 °س؛ أو بتعريض الفوسفور الأبيض إلى أشعة الشمس. تتكون البنية الداخلية من الفوسفور الأبيض من شبكة لابلورية؛ وهو أكثر استقراراً من الفوسفور الأبيض، لكنه أقل استقراراً من الفوسفور الأسود، أكثر أشكال الفوسفور استقراراً. تبلغ قيمة الحرارة القياسية للتكوين -17.6 كيلوجول/مول.[1]
يمكن أن يستخدم الفوسفور الأحمر حفازاً ضوئياً عنصرياً لتشكل الهيدروجين من الماء؛[4] خاصة أن معدلات تشكل الهيدروجين وفق تلك العملية تكون ثابتة.[5]
الفوسفور البنفسجي

يعرف الفوسفور البنفسجي أيضاً باسم فوسفور هيتورف الفلزي،[6][7] وذلك نسبة إلى العالم يوهان فيلهلم هيتورف، الذي استحصله أول مرة سنة 1865، وذلك من تسخين الفوسفور الأحمر في أنبوب محكم الإغلاق إلى درجات حرارة وصلت إلى 530 °س؛ في حين بقي القسم الأعلى من الأنبوب عند حوالي 450°س، مما أدى إلى الحصول على بلورات من الفوسفور البنفسجي. يمكن الحصول على الفوسفور البنفسجي بطريقة أخرى، وذلك بإذابة الفوسفور الأبيض في مصهور الرصاص في أنبوب مغلق عند درجات حرارة تصل إلى 500°س، ثم بالتبريد البطيء. يمكن استخلاص الفوسفور البنفسجي بإذابة الرصاص في حمض النتريك الممدد، ثم بالتسخين في حمض الهيدروكلوريك المركز.[8]
يعد الفوسفور البنفسجي مستقراً، وهو لا يتفاعل مع الأكسجين عند درجات حرارة أقل من 300°س، كما لا ينحل في المذيبات.
الفوسفور الأسود

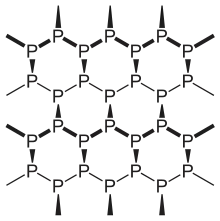
يعد الفوسفور الأسود أكثر أشكال الفوسفور المعروفة استقراراً؛ حيث تبلغ قيمة الحرارة القياسية للتكوين -39.3 كيلوجول/مول.[1] حضر بيرسي ويليامز بريجمان هذا الشكل من الفوسفور سنة 1914 بتسخين الفوسفور الأبيض تحت ضغوط مرتفعة.[9] للفوسفور أسود بنية ثنائية المستوى، وهو بذلك يشبه الغرافيت من حيث البنية ومن حيث الشكل، فهو أيضاً يوجد على شكل قشور سوداء.[10] بسبب البنية ثنائية المستوى على شكل حلقات سداسية متراصة مثل قرص النحل، فإن الفوسفور الأسود خامل نسبياً بالمقارنة مع الأشكال الأخرى من الفوسفور، إذ أن كل ذرة فوسفور تكون مرتبطة بثلاث ذرات أخرى.[11][12] يعد هذا الشكل من الفوسفور موصلاً للكهرباء، وله خواص مميزة تؤهله للدخول في عدد من التطبيقات الإلكترونية.[13]
بسبب التشابه بين الفوسفور الأسود والغرافيت فقد جرى التفكير بتطوير طريقة تحضير رقائق من الفوسفور الأسود ثنائية المستوى بشكل يشبه الغرافين؛ والتي أطلق عليها اسم فوسفورين (Phosphorene)؛ والتي وجد أن لها خواص كهربائية وحرارية وبصرية مميزة.[14][15][16][17]
وجد أن رقائق الفوسفورين تتسامى تحت الفراغ عند درجات حرارة تقارب 400°س.[18] كما وجد أن تتأكسد بسهولة بوجود الأكسجين أو الهواء الرطب؛ الأمر الذي قد يحد من تطبيقاتها العملية.[19][20]
ثنائي الفوسفور
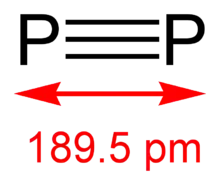
يستحصل على ثنائي الفوسفور (P2) بالأحوال العادية تحت شروط قاسية؛ أو يمكن الحصول عليه تحت شروط معتدلة بوجود حفاز من معقدات لبعض الفلزات الانتقالية مثل التنغستن أو النيوبيوم.[21]
مراجع
- Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 392. ISBN 978-0-13-039913-7
- Durif, M.-T. Averbuch-Pouchot; A. (1996)، Topics in phosphate chemistry، Singapore [u.a.]: World Scientific، ص. 3، ISBN 978-981-02-2634-3.
- Threlfall, R.E., (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd
- Applied Catalysis B: Environmental, 2012, 111-112, 409-414.
- Angewandte Chemie International Edition, 2016, 55, 9580-9585.
- Curry, Roger (08 يوليو 2012)، "Hittorf's Metallic Phosphorus of 1865"، LATERAL SCIENCE، مؤرشف من الأصل في 12 سبتمبر 2017، اطلع عليه بتاريخ 16 نوفمبر 2014.
- Monoclinic phosphorus formed from vapor in the presence of an alkali metal U.S. Patent 4٬620٬968
- Hittorf, W. (1865)، "Zur Kenntniss des Phosphors"، Annalen der Physik، 202 (10): 193–228، Bibcode:1865AnP...202..193H، doi:10.1002/andp.18652021002، مؤرشف من الأصل في 24 ديسمبر 2019.
- Bridgman, P. W. (01 يوليو 1914)، "Two New Modifications of Phosphorus"، Journal of the American Chemical Society، 36 (7): 1344–1363، doi:10.1021/ja02184a002، ISSN 0002-7863.
- Korolkov, Vladimir V.؛ Timokhin, Ivan G.؛ Haubrichs, Rolf؛ Smith, Emily F.؛ Yang, Lixu؛ Yang, Sihai؛ Champness, Neil R.؛ Schröder, Martin؛ Beton, Peter H. (09 نوفمبر 2017)، "Supramolecular networks stabilise and functionalise black phosphorus"، Nature Communications، 8 (1): 1385، Bibcode:2017NatCo...8.1385K، doi:10.1038/s41467-017-01797-6، ISSN 2041-1723، PMC 5680224، PMID 29123112.
- Brown, A.؛ Rundqvist, S. (1965)، "Refinement of the crystal structure of black phosphorus"، Acta Crystallographica، 19 (4): 684–685، doi:10.1107/S0365110X65004140.
- Cartz, L.؛ Srinivasa, S. R.؛ Riedner, R. J.؛ Jorgensen, J. D.؛ Worlton, T. G. (1979)، "Effect of pressure on bonding in black phosphorus"، The Journal of Chemical Physics، 71 (4): 1718، Bibcode:1979JChPh..71.1718C، doi:10.1063/1.438523.
- Allain, A.; Kang, J.; Banerjee, K.; Kis, A., Electrical contacts to two-dimensional semiconductors. Nat. Mater. 2015, volume 14, pp. 1195-1205. دُوِي:10.1038/nmat4452
- "Black Phosphorus Powder and Crystals"، Ossila، مؤرشف من الأصل في 23 أغسطس 2019، اطلع عليه بتاريخ 23 أغسطس 2019.
- Zhang, Yuanbo؛ Chen, Xian Hui؛ Feng, Donglai؛ Wu, Hua؛ Ou, Xuedong؛ Ge, Qingqin؛ Ye, Guo Jun؛ Yu, Yijun؛ Li, Likai (مايو 2014)، "Black phosphorus field-effect transistors"، Nature Nanotechnology، 9 (5): 372–377، arXiv:1401.4117، doi:10.1038/nnano.2014.35، ISSN 1748-3395، مؤرشف من الأصل في 29 نوفمبر 2019.
- Kang, J.؛ Ke, M.؛ Hu, Y. (2017)، "Ionic Intercalation in Two-Dimensional van der Waals Materials: In Situ Characterization and Electrochemical Control of the Anisotropic Thermal Conductivity of Black Phosphorus"، Nano Letters، 17 (3): 1431–1438، Bibcode:2017NanoL..17.1431K، doi:10.1021/acs.nanolett.6b04385، PMID 28231004.
- Smith, B.؛ Vermeersch, B.؛ Carrete, J.؛ Ou, E.؛ Kim, J.؛ Li, S. (2017)، "Temperature and Thickness Dependences of the Anisotropic In-Plane Thermal Conductivity of Black Phosphorus"، Adv Mater، 29 (5): 1603756، doi:10.1002/adma.201603756، PMID 27882620.
- Liu, Xiaolong D.؛ Wood, Joshua D.؛ Chen, Kan-Sheng؛ Cho, EunKyung؛ Hersam, Mark C. (09 فبراير 2015)، "In Situ Thermal Decomposition of Exfoliated Two-Dimensional Black Phosphorus"، Journal of Physical Chemistry Letters، 6 (5): 773–778، arXiv:1502.02644، doi:10.1021/acs.jpclett.5b00043، PMID 26262651.
- Wood, Joshua D.؛ Wells, Spencer A.؛ Jariwala, Deep؛ Chen, Kan-Sheng؛ Cho, EunKyung؛ Sangwan, Vinod K.؛ Liu, Xiaolong؛ Lauhon, Lincoln J.؛ Marks, Tobin J.؛ Hersam, Mark C. (07 نوفمبر 2014)، "Effective Passivation of Exfoliated Black Phosphorus Transistors against Ambient Degradation"، Nano Letters، 14 (12): 6964–6970، arXiv:1411.2055، Bibcode:2014NanoL..14.6964W، doi:10.1021/nl5032293، PMID 25380142.
- Wu, Ryan J.؛ Topsakal, Mehmet؛ Low, Tony؛ Robbins, Matthew C.؛ Haratipour, Nazila؛ Jeong, Jong Seok؛ Wentzcovitch, Renata M.؛ Koester, Steven J.؛ Mkhoyan, K. Andre (01 نوفمبر 2015)، "Atomic and electronic structure of exfoliated black phosphorus"، Journal of Vacuum Science & Technology A، 33 (6): 060604، doi:10.1116/1.4926753، ISSN 0734-2101.
- Piro, Na؛ Figueroa, Js؛ Mckellar, Jt؛ Cummins, Cc (2006)، "Triple-bond reactivity of diphosphorus molecules"، Science، 313 (5791): 1276–9، Bibcode:2006Sci...313.1276P، doi:10.1126/science.1129630، PMID 16946068.
- بوابة الكيمياء