مثنوي البيريميدين
مثنوي البيريميدين هي روابط جزيئية تتشكل بين قواعد الثايمين أو السايتوسين المتجاورة نتيجة تفاعلات كيمياء ضوئية [1][2]، حيث تسبب الأشعة فوق البنفسجية تشكل روابط تساهمية بتفاعلات تحدث في الروابط C=C المزدوجة.[3] يمكن أن تتراكم مثنويات اليوراسيل في الرنا مزدوج السلاسل كنتيجة لإشعاعات فوق بنفسجية، ناتِجا الأشعة فوق البنفسجية الأكثر شيوعا هما: مثنويات البيريميدين حلقي البوتان (CPDs)، بما في ذلك مثنويات الثيميدين) والمنتجات الضوئية (4,6). تغير هذه الروابط المطفرة بنية الدنا وكنتيجة لذلك تمنع البوليميرازات من العمل وتعطل التضاعف، يمكن ترميم المثنويات بواسطة الاستنشاط الضوئي أو ترميم استئصال النوكليوتيد، لكن المثنويات غير المرممة مطفِّرة. مثنويات البيريميدين هي السبب الرئيسي للميلانوما لدى البشر.
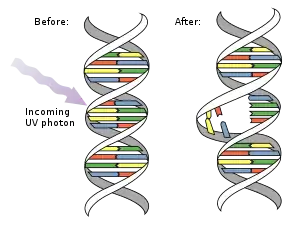
أنواع المثنويات
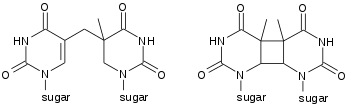
مثنوي البيريميدين حلقي البوتان (CPD) يحتوي حلقة رباعية الذرات تنتج من تزواج رابطتي C=C مزدوجتين للبيريميدَيْن [4][5][6]، هذه المثنويات تتدخل في ترابط القواعد أثناء تضاعف الدنا مسببة طفرات.
المنتجات الضوئية (4,6)، أو 4,6 بيريميدين-بيريميدونات تظهر بمعدل ثلث ظهور مثنويات البيريميدين حلقي البوتان لكنها أكثر تطفيرا.[7] يقدم لياز بوغ الناتج الضوئي مسارا إنزيميا لترميم مثنويات الثايمين المنتجة بفعل الضوء.[8]
تطفير
تُحدِث بوليمرازات الترجمة بشكل شائع طفرات عند مثنويات البيريميدين، لدى كل من بدائيات (استجابة SOS) وحقيقيات النوى. كون مثنويات البيريميدين حلقي البوتان ثايمين-ثايمين (مثنويات الثايمين) هي الروابط الأكثر تواترا التي تسببها الأشعة فوق البنفسجية فإن بوليمرازات الترجمة منحازة نحو تقديم جزيئات أدينين، لكي تتم مضاعفة مثنويات TT بشكل صحيح، لكن من جهة أخرى أي تواجد لمثنويات السايتوسين يعرضها لنزع الأمين وهذا يسبب انتقال C إلى T.[9]
ترميم الدنا

تسبب مثنويات البيريميدين تغيرات محلية في بنية الدنا، وهذا يسمح لإنزيمات الترميم بالتعرف على على الروابط وإصلاحها.[10] يمكن لدى معظم الكائنات (باستثناء المشيميات مثل الإنسان) ترميم المثنويات بواسطة الاستنشاط الضوئي [11]، وهي عملية تقوم فيها إنزيمات لياز الضوء (فوتولياز) بعكس مثنويات البيريميدين حلقي البوتان مباشرة عبر تفاعلات كيمياء ضوئية، حيث تتعرف هذه الإنزيمات على الروابط، ويتبع ذلك امتصاص لأمواج الضوء > 300 نانومتر (كمثال الفلورية، أشعة الشمس)، يمكِّن هذا الامتصاص تفاعلات الضوء الكيميائية من الحدوث ما ينتج عنه إزالة لمثنويات البيريميدين وإعادتها إلى حالتها الأصلية.[12]
ترميم استئصال النوكليوتيد هي آلية أكثر عمومية لإصلاح الروابط، حيث تقوم الآلية بإزالة مثنويات البيريميدين واصطناع دنا جديد لاستبداله في المنطقة المتضررة بالجزيء.[12] جفاف الجلد المصطبغ هو مرض جيني لدى البشر تتسبب فيه قلة أو انعدام ترميم استئصال النوكليوتيد وينتج عنه تغير في لون الجلد والعديد من الأورام عند التعرض للأشعة فوق البنفسجية. مثنويات البيريميدين غير المرممة تسبب الميلانوما لدى البشر.[13]
مراجع
- David S. Goodsell (2001)، "The Molecular Perspective: Ultraviolet Light and Pyrimidine Dimers"، The Oncologist، 6 (3): 298–299، doi:10.1634/theoncologist.6-3-298، PMID 11423677، مؤرشف من الأصل في 30 أبريل 2009.
- E. C. Friedberg؛ G. C. Walker؛ W. Siede؛ R. D. Wood؛ R. A. Schultz؛ T. Ellenberger (2006)، DNA repair and mutagenesis، Washington: ASM Press، ص. 1118، ISBN 978-1-55581-319-2.
- S. E. Whitmore؛ C. S. Potten؛ C. A. Chadwick؛ P. T. Strickland؛ W. L. Morison (2001)، "Effect of photoreactivating light on UV radiation-induced alterations in human skin"، Photodermatol. Photoimmunol. Photomed.، 17 (5): 213–217، doi:10.1034/j.1600-0781.2001.170502.x، PMID 11555330.
- R. B. Setlow (1966)، "Cyclobutane-Type Pyrimidine Dimers in Polynucleotides"، Science، 153 (3734): 379–386، doi:10.1126/science.153.3734.379، PMID 5328566.
- Expert reviews in molecular medicine (02 ديسمبر 2002)، "Structure of the major UV-induced photoproducts in DNA." (PDF)، Cambridge University Press، مؤرشف من الأصل (PDF) في 21 مارس 2005.
- Christopher Mathews؛ K.E. Van Holde (1990)، Biochemistry (ط. 2nd)، Benjamin Cummings Publication، ص. 1168، ISBN 978-0-8053-5015-9، مؤرشف من الأصل في 17 ديسمبر 2019.
- Van Holde, K. E.؛ Mathews, Christopher K. (1990)، Biochemistry، Menlo Park, Calif: Benjamin/Cummings Pub. Co.، ISBN 0-8053-5015-2، مؤرشف من الأصل في 17 ديسمبر 2019.
- Jeffrey M. Buis؛ Jennifer Cheek؛ Efthalia Kalliri؛ Joan B. Broderick (2006)، "Characterization of an Active Spore Photoproduct Lyase, a DNA Repair Enzyme in the Radical S-Adenosylmethionine Superfamily"، Journal of Biological Chemistry، 281 (36): 25994–26003، doi:10.1074/jbc.M603931200، PMID 16829680.
- J. H. Choi؛ A. Besaratinia؛ D. H. Lee؛ C. S. Lee؛ G. P. Pfeifer (2006)، "The role of DNA polymerase iota in UV mutational spectra"، Mutat. Res.، 599 (1–2): 58–65، doi:10.1016/j.mrfmmm.2006.01.003، PMID 16472831.
- Kemmink Johan؛ Boelens Rolf؛ Koning Thea M.G.؛ Kaptein Robert؛ Van, der Morel Gijs A.؛ Van Boom Jacques H. (1987)، "Conformational Changes in the oligonucleotide duplex d(GCGTTGCG)•d(GCGAAGCG) induced by formation of a cis–syn thymine dimer"، European Journal of Biochemistry، 162: 31–43، doi:10.1111/j.1432-1033.1987.tb10538.x، PMID 3028790.
- "Light-driven DNA repair by photolyases"، Cell Mol Life Sci، 63 (11): 1266–77، 2006، doi:10.1007/s00018-005-5447-y، PMID 16699813.
- Friedberg, Errol C. (23 January 2003) "DNA Damage and Repair". Nature 421, 436-439. دُوِي:10.1038/nature01408
- Vink Arie A.؛ Roza Len (2001)، "Biological consequences of cyclobutane pyrimidine dimers"، Journal of Photochemistry and Photobiology B: Biology، 65 (2–3): 101–104، doi:10.1016/S1011-1344(01)00245-7.
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي