مطيافية الكتلة
مطياف الكتلة (بالإنجليزية: Mass spectrometry) هو تقنية تحليلية لتحديد العناصر المكونة لمادة أو جزيء ما. ويستخدم أيضا لتوضيح البنى الكيميائية للجزيئات، مثل الببتيدات والمركبات الكيميائية الأخرى.

يعتمد مبدأ عمل مطياف الكتلة على تشريد المركبات الكيميائية لتوليد جزيئات مشحونة وقياس نسبة كتلتها إلى شحنتها.[1] تجرى العملية في مطياف الكتلة بوضع العينة في الجهاز، حيث تأين المركبات بطرق مختلفة (مثلا بنسفها بحزمة إلكترونية)، مما يشكل الأيونات المشحونة. تحسب نسبة الكتلة للشحنة لهذه الجزيئات من حركة هذه الأيونات ضمن حقول كهرومغناطيسية.
يتكون جهاز مطياف الكتلة من ثلاث وحدات: منبع للأيونات يشطر جزيئات العينة إلى أيونات. وجهاز تحليل يفرز الأيونات بحسب كتلتها عن طريق تطبيق حقول كهرومغناطيسية. ومكشاف لقياس قيمة مؤشر الكمية وبذلك تعطي بيانات لحساب وفرة الأيونات الملتقطة.
ولمطياف الكتلة استخدامات كمية ونوعية، تشمل تحديد هوية المركبات المجهولة، وتحديد التركيب النظائري للعناصر في الجزيء، وتحديد بنية المركب بمراقبة شظاياه. كما يستخدم في تحديد كمية مركب ما في العينة أو لدراسة كيمياء الأيونات في الطور الغازي (كيمياء الأيونات والجسيمات الحيادية في الفراغ). يستخدم مطياف الكتلة حاليا في مخابر التحليل التي تدرس الخصائص الفيزيائية والكيميائية والبيولوجية لطيف واسع من المركبات.
مطياف الكتلة هو جهاز اخترعه فرانسيس أستون ويعتمد مبدأ عمله على أن الجسيمات المشحونة عندما تدخل مجالا مغناطيسيا منتظما، بحيث يعامد اتجاهه اتجاه حركتها، فإنها تأخذ مسارات دائرية تتناسب أنصاف أقطارها مع كتلة الجسيم المشحون. ويمكن بواسطة هذا الجهاز قياس نسبة الكتلة للشحنة وفصل الجسيمات المختلفة بهذا المقدار عن بعضها سواء كانت ذرات أو أيونات أو جزيئات. و هو يسمح بقياس q/m لذرة متأينة (حيث m كتلة الايون و q شحنته) وبتحديد كتلة الذرة، وقد لعبت المطيافية دورا كبيرا في دراسة النظائر. يتكون المطياف من :
- منبع أيونات Ion source
- محلل الكتلة Mass Analyzer
- كاشف Detector

مثال توضيحي
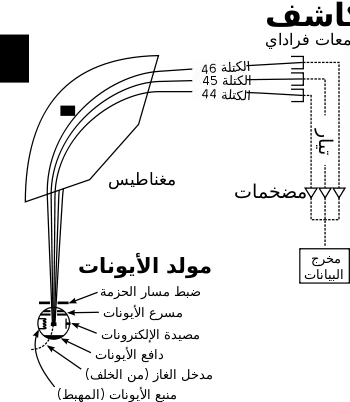
المثال التالي يوضح مبدأ عمل مطياف الكتلة. لنضع عينة من كلوريد الصوديوم (ملح الطعام) في منبع الأيونات، فتتبخر (تتحول إلى غاز) وتتأين (تتحول إلى جزئيات مشحونة كهربائيا) فتتحول إلى أيونات الصوديوم (Na+) والكلور (Cl-). ذرات وأيونات الصوديوم هي نظائر أحادية، بكتلة مساوية 23 amu. لذرات وأيونات الكلور نظيرين بكتل مساوية تقريبا لـ 35 amu (بتوافر طبيعي حوال 25 %). يحتوي محلل الكتلة في المطياف على حقول كهربائية ومغناطيسية تؤثر بقوى على الأيونات المارة خلال هذه الحقول. يمكن زيادة أو إنقاص سرعة الجزيء المشحون خلال مروره ضمن الحقل الكهربائي، بينما يمكن تعديل الاتجاه بتعديل الحقل المغناطيسي. يتعلق مقدار الانعطاف في مسار الأيون بنسبة كتلته إلى شحنته. ووفق قانون نيوتن الثاني للحركة، فإن الأيونات الأخف تنحرف أكثر من الأيونات الأثقل نتيجة تأثير القوى المغناطيسية. تمر تيارات الأيونات المتولدة من محلل الكتلة إلى الكاشف، الذي يسجل التوافر الطبيعي النسبي لكل نوع من الأيونات. تستخدم هذه المعلومات لتحديد التركيب الكيميائي للعناصر المكونة للعينة المدرسة، والتركيب النظائري لمكوناتها (نسبة 35Cl إلى 37Cl)
اقرأ أيضا
المراجع
- Sparkman, O. David (2000)، Mass spectrometry desk reference، Pittsburgh: Global View Pub، ISBN 0-9660813-2-3.
- بوابة كيمياء فيزيائية
- بوابة الكيمياء
- بوابة الفيزياء
- بوابة الكيمياء الحيوية