نقيلة عظمية
نقيلة العظام (بالإنجليزية: Bone metastasis) هي نوع من أنواع انتشار الأورام الخبيثة والذي ينتج من غزو الورم السرطاني للعظام.
الأورام الخبيثة التي تنشأ بالعظام مثل الساركوما العظمية -الغرن العظمي- أو الساركوما الغضروفية –الغرن الغضروفي- أو غرن يوينغ هي امراض نادره. وعلى عكس سرطانات الدم والتي يكون منشأها الأولي هو الدم وليس الأعضاء الأخري فأن نقيلة العظام تنشأ دوما من السرطانات الظهارية والمكونات الداخليه للعظام. نقيلة العظام تسبب آلام لا تحتمل تتميز بأنها آلام كليلة مع وجع دائم ذو صرخات دوريه من الآلام الكبيرة.[1]
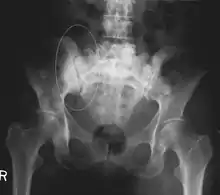
مصادرها
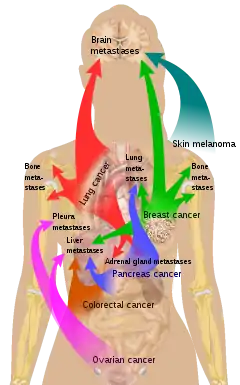
العظام هي أكثر ثالث مكان يصاب بالنقيلات السرطانية بعد الرئة والكبد. وفي الوقت نفسة يستطيع أي ورم سرطاني ان يكون نقيلة بالعظام حيث ان البيئة الدقيقة لنخاع العظام تميل إلى تفضيل أنواع معينه من الأورام السرطانية تتضمنسرطانات البروستاتا وسرطان الثدي وسرطان الرئه. خاصة سرطان البروستاتا والذي لا يستطيع تكوين نقيلة سرطانيه الا في العظام. واشهرالأماكن لانتشار تلك الأورام في العظام هي العمود الفقري وعظمة الحوض والجزء العلوي من عظمة الفخذ.[1][2][3][4][5]
أنواعها
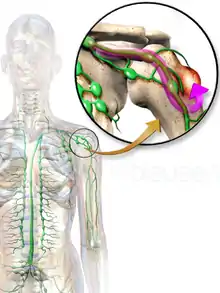
في الظروف الطبيعية تُعدل العظام نفسها عن طريق إعادة الأمتصاص بواسطة خلايا العظام الناقضه واعاده التكوين عن طريق الخلايا المكونه للعظام.
هذه العمليات تتم بدقة متناهيه كي تحافظ على بنية العظام وكذلك الكالسيوم في بيئة الجسم المتوازنة حيث ان أي خلل يحدثه السرطان في تلك العمليات يؤثر على الخلايا الناقضة للعظام وكذلك الخلايا البانيه للعظام مما يؤدي للتأثير بالسلب على العمليات التي تؤديها تلك الخلايا.
في الغالب يكون الورم المؤثر علي الناقضة أكثر عدوانية من الورم المؤثر على الخلايا البانيه والذي يتبع غالبا منحى بطيء. وبغض النظر عن الأنواع فأن النقيلة العظمية تسبب تضخم وانتشار للخلايا الناقضة للعظام.[6]
الأورام الأوليه المسببه للنقيلة
من اأهم الأورام المسببة لسرطان النقيلة العظمية:
- أورام الخلايا البانية
- أورام البروستاتا
- أورام الخلايا الناقضة
- أورام الرئة
- أورام الغده الدرقيه
- أورام الكلية
- أورام مختلطه
الأعراض
النقيلة العظمية واحده من الأمراض المقلقة التي تحظى بأهتمام بالغ حيث انه يمكنها التسبب في آلام عظيمة، منها كسور في العظام، ضغط على النخاع الشوكي –إذا اصابت العمود الفقاري-، ارتفاع نسبة الكالسيوم في الدم، انيميا، اهتزاز الحبل الشوكي، صعوبة القدرة على الحركة، مما يحدث تغيير حاد ومدمر في جودة الحياة بالنسبة للمرضى.
ويصف المرضى آلام المرض على انها آلام كليلة ذات فترات تصاعديه من الآلام الصارخة. حتي في وجود مسكنات الألم هذه الفترات من الألم الصارخ لا تزال تؤرق المريض حيث تظهر فجأة وبدون اية مقدمات في مرات عديده اثناء النهار وكذلك تسوء الحالة اثناء الليل، وتتحسن نسبياً بالحركة.
النقيلات العظميه التي تصيب العظام الكبيره غالبا ما تكون سريعة الظهور وسريعة التأثير مقارنة بالآلام التي تصيب العظام المسطحه أو العظام الصغيره مثل الضلوع.[1][7][8][9]
آثار النقيلة العظمية
- آلام حاده
- كسور بالعظام
- ضغط النخاع الشوكي
- زياده نسبة الكالسيوم في الدم
- انيميا حاده
- اهتزاز النخاع الشوكي
- عدم القدرة على الحركة
أسباب الأعراض
الحماض (حمضية الدم والأنسجة)
الحماض هو زيادة الحمضية في مكان معين سواء كانت في الدم أو البول أو الأنسجة، حيث تطلق الخلايا الناقضة للعظام بروتونات خارج الخلية، فتقلل من الرقم الهيدروجيني للوسط خارج الخلية الناقضة للعظام مما يؤدي لإثارة مراكز الألم في المخ نتيجه للحماض.
الخطأ في هيكلة العظام
ان عدم التناغم بين الخلايا البانية والخلايا الناقضة للعظام يؤدي الي خلل في تكوين العظام. فينتج عظاماً مشوهة والتي لا تكون قادرة على التحمل في الأعمال اليومية المختلفة.مما يؤدي الي كسور في العظام وضغوط علي الحبل الشوكي وكذلك اهتزاز الحبل الشوكي.
كذلك تعتبر العظام المشوهه مسبب رئيسي في الآلام للعظام نفسها وكذلك الأنسجة المحيطة.[10][11]
العلاج
اهداف العلاج تشمل التحكم في الآلام وتقليلها وكذلك منع وعلاج كسور العظام، والحفاظ على نشاط المريض، والتحكم في الورم المسبب. وتعتمد اختيارات العلاج على حالة المريض، والعمر المتوقع له، وكذلك تأثير المرض على جودة حياته، والحالة العامة وتأثير المرض.[5]
التحكم في الألم
ان مستويات الألم التي وضعتها منظمة الصحة العالمية صممت للتحكم في الآلام المصاحبة للسرطان، وتتضمن في الأساس مستويات متعدده من الأفيونات. كذلك الألم المتوسط والخفيف يمكن معالجته باستخدام مضادات الألتهاب الغير استروديه. هناك تقنيات علاج أخرى تستخدم الاسترويدات والعلاج بالأشعه.
جراحة زراعة العظام بالمناظير تستهدف زرع مادة العظام لتقلل الآلام وكذلك تجنب كسر العظام.
في العلاج المسكن، يكون العلاج عن طريق الأشعة أو ادويه مشعه داخل الجسم.
الأشعه فوق السمعية المُركَزه ذات السرعة العاليه حازت على تصريح للتصنيع في أوروبا من اجل العلاج المسكن في علاج النقيله العظميه، وهناك أيضا العديد من العلاجات في مرحلة الأختبار لأستخلاص المعلومات اللازمة عن كفاءة العلاج من اجل استخراج تراخيص العلاج في دول مثل الولايات المتحده.
حقن شهريه من كلوريد الراديوم والمعروف ب (Xofigo) حازت على تصريح منظمه الغذاء والدواء (FDA) لعلاج سرطان البروستاتا والنقيلة العظمية المصاحبة. في تقرير لكوكرين عن الكالسيتونين لعلاج آلام النقيله العظميه، صرحت بانه بلا أي فائده سواء في تقليل الآلام، أو المضاعفات أو حتى جودة الحياه.[1][12][13][14]
انظر أيضا
المصادر
- Jimenez-Andrade JM, Mantyh WG, Bloom AP, Ferng AS, Geffre CP, Mantyh PW (يونيو 2010)، "Bone cancer pain"، Annals of the New York Academy of Sciences، 1198: 173–81، doi:10.1111/j.1749-6632.2009.05429.x، PMID 20536932.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - List of included entries and references is found on main image page in Commons: Commons:File:Metastasis sites for common cancers.svg#Summary
- Vigorita, Vincent (2007)، Orthopaedic Pathology، Lippincott Williams & Wilkins، ص. 527، ISBN 0781796709.
- Guise T (أكتوبر 2010)، "Examining the metastatic niche: targeting the microenvironment"، Semin. Oncol.، 37 (Suppl 2): S2–14، doi:10.1053/j.seminoncol.2010.10.007، PMID 21111245، مؤرشف من الأصل في 12 ديسمبر 2018.
- Jacofsky, David (2004)، "Metastatic Disease to Bone"، Hospital Physician.
- Halvorson KG, Sevcik MA, Ghilardi JR, Rosol TJ, Mantyh PW (سبتمبر 2006)، "Similarities and differences in tumor growth, skeletal remodeling and pain in an osteolytic and osteoblastic model of bone cancer"، Clin J Pain، 22 (7): 587–600، doi:10.1097/01.ajp.0000210902.67849.e6، PMID 16926574، مؤرشف من الأصل في 3 أكتوبر 2018.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Coleman RE (أكتوبر 2006)، "Clinical features of metastatic bone disease and risk of skeletal morbidity"، Clin. Cancer Res.، 12 (20 Pt 2): 6243s–9s، doi:10.1158/1078-0432.CCR-06-0931، PMID 17062708، مؤرشف من الأصل في 15 ديسمبر 2019.
- Mercadante S (يناير 1997)، "Malignant bone pain: pathophysiology and treatment"، Pain، 69 (1–2): 1–18، doi:10.1016/S0304-3959(96)03267-8، PMID 9060007، مؤرشف من الأصل في 12 ديسمبر 2018.
- Zeppetella G (مارس 2009)، "Impact and management of breakthrough pain in cancer"، Current Opinion in Supportive and Palliative Care، 3 (1): 1–6، doi:10.1097/SPC.0b013e3283260658، PMID 19365156، مؤرشف من الأصل في 24 مايو 2013.
- Teitelbaum SL (فبراير 2007)، "Osteoclasts: what do they do and how do they do it?"، Am. J. Pathol.، 170 (2): 427–35، doi:10.2353/ajpath.2007.060834، PMC 1851862، PMID 17255310، مؤرشف من الأصل في 11 ديسمبر 2018.
- Julius D, Basbaum AI (سبتمبر 2001)، "Molecular mechanisms of nociception"، Nature، 413 (6852): 203–10، doi:10.1038/35093019، PMID 11557989.
- Anselmetti, Giovanni Carlo (يونيو 2010)، "Osteoplasty: Percutaneous Bone Cement Injection beyond the Spine"، US National Library of Medicine: National Institutes of Health، 27: 199–208، doi:10.1055/s-0030-1253518، PMC 3036518، PMID 21629409.
- Criteria for Palliation of Bone Metastases – Clinical Applications from International Atomic Energy Agency. Retrieved November 2011 نسخة محفوظة 09 مارس 2017 على موقع واي باك مشين.
- Martinez-Zapata, MJ (2012)، "Calcitonin used to treat metastatic bone pain"، Cochrane Database Syst Rev، مؤرشف من الأصل في 18 مايو 2015.
- بوابة علم الأحياء
- بوابة طب