Agmatina
La agmatina, conocida también como (4-aminobutil)guanidina, es una aminoguanidina descubierta en 1910 por Albrecht Kossel.[3] La agmatina es un compuesto químico que se produce naturalmente en los organismos a partir del aminoácido arginina. Esta molécula ha demostrado ejercer acciones modulatorias en múltiples dianas moleculares, notablemente en sistemas de neurotransmisores, canales iónicos, síntesis de óxido nítrico (NO) y metabolismo de poliaminas, lo cual provee las bases para futuras investigaciones en potenciales aplicaciones.
| Agmatina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1-(4-Aminobutil)guanidina[1] | ||
| General | ||
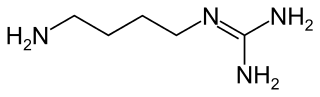
| Fórmula estructural |
| |
| Fórmula molecular | C5H14N4 | |
| Identificadores | ||
| Número CAS | 306-60-5[2] | |
| ChEBI | 17431 | |
| ChEMBL | 58343 | |
| ChemSpider | 194 | |
| DrugBank | 08838 | |
| PubChem | 199 | |
| UNII | 70J407ZL5Q | |
| KEGG | C00179 | |
|
NCCCC[nH]:c(:[nH]):[nH2]
| ||
| Propiedades físicas | ||
| Masa molar | 130,122 g/mol | |
| Punto de fusión | 102 °C (375 K) | |
| Punto de ebullición | 281 °C (554 K) | |
| Propiedades químicas | ||
| Alcalinidad | 0.52 pKb | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Historia
La agmatina fue descubierta en 1910 por Albrecht Kossel. Tomó más de 100 años encontrar cual era la exacta función de este compuesto químico. El nombre se origina a partir de A- (por amino-) + g- (por guanidina) + -ma- (por ptomaina) + el sufijo -in (alemán)/-ine (inglés)/-ina (español) con la inserción de una -t- aparentemente para mantener la eufonía.[4] Un año después de su descubrimiento, se encontró que la agmatina podía aumentar el flujo sanguíneo en conejos;[5] sin embargo, la relevancia fisiológica de estos descubrimientos fueron cuestionadas debido a las altas concentraciones requeridas (en el rango superior de los μM).[6] En los años 1920, algunos investigadores en la clínica de diabetes de Oskar Minkowski demostraron que la agmatina podía ejercer efectos hipoglucemiantes leves.[7] En 1994, se produce el descubrimiento de la síntesis endógena de agmatina en mamíferos.[8]
Vías metabólicas
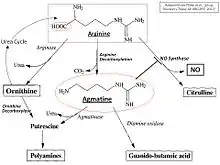
La biosíntesis de la agmatina a partir de la descarboxilación de la arginina se encuentra bien posicionada para competir con las principales vías dependientes de arginina: el ciclo de la urea, y la síntesis de poliaminas y óxido nítrico. La degradación de la agmatina ocurre principalmente por hidrólisis, proceso catalizado por la enzima agmatinasa, para producir urea y putrescina, el precursor diamina de la síntesis de poliaminas. Una vía alternativa, principalmente en tejidos periféricos, es la oxidación a aldehído de agmatina, catalizada por la enzima diamina oxidasa, el cual luego es convertido por la aldehído deshidrogenasa en guanidinobutirato y secretado por los riñones.
Mecanismos de acción
Se ha encontrado que la agmatina ejerce acciones modulatorias directa e indirectamente a nivel de varias dianas moleculares clave en el control celular, de cardinal importancia en la salud y la enfermedad. Se considera que es capaz de ejercer sus acciones modulatorias simultáneamente en diferentes dianas:[9]
- Receptores de neurotransmisores y ionóforos receptores: Nicotínicos, imidazolínicos I1, I2; α2-adrenérgicos, glutamato, NMDA, serotoninérgicos 5-HT2A y 5HT-3.
- Canales iónicos, entre ellos: canales de potasio sensibles a ATP, canales de calcio dependientes de voltaje y canales iónicos sensores de acidez.
- Transportadores de membrana. Sitios específicos de recaptación de agmatina, transportadores de cationes orgánicos (principalmente del tipo OCT2), transportadores de monoaminas extraneuronales (ENT), transportadores de poliaminas, y sistemas transportadores específicos de agmatina mitocondriales.
- Modulación de la síntesis de óxido nítrico. Se ha reportado que la agmatina produce la inhibición diferencial de todas las formas de la Óxido nítrico sintasa.
- Metabolismo de las poliaminas. La agmatina es precursora de la síntesis de poliaminas, inhibidor competitivo del transportador de poliaminas, inductora de la SSAT (espermidina/espermina acetiltransferasa), e inductora de las antizimas.
- ADP-ribosilación de proteínas. Inhibición de la ADP-ribosilación de la arginina de proteínas.
- metaloproteasas de matriz (MMPs). Regulación a la baja indirecta de las enzimas MMP2 y MMP9.
- Formación de productos finales de glicación avanzada (AGE). Produce el bloqueo directo de la formación de AGEs.
- NADPH oxidasa. Activación de la enzima lo que conduce a la producción de H
2O
2.[10]
Consumo alimentario
La inyección de sulfato de agmatina puede aumentar la ingesta de comida, con preferencia por carbohidratos, en ratas saciadas, pero no en ratas hambrientas y sus efectos podrían estar mediados por neuropéptidos.[11] Sin embargo la suplementación en el agua para la bebida de las ratas conduce a una reducción en la ingesta de agua y una ganancia de peso.[12] La alimentación forzada con agmatina durante el desarrollo de las ratas conduce a una reducción en la ganancia de peso.[13] Muchos alimentos fermentados contienen agmatina.[14][15]
Farmacología
La agmatina se encuentra presente en pequeñas cantidades en alimentos de origen animal y vegetal, y la producción microbiana intestinal es una fuente adicional. La agmatina incorporada por vía oral se absorbe rápidamente en el tracto gastointestinal y rápidamente distribuida a través de todo el organismo.[16] La rápida eliminación de la agmatina ingerida sin metabolizar por vía renal provoca que la vida media de esta sustancia en sangre sea de aproximadamente dos horas.[17] La agmatina, además, es un neurotransmisor, lo que significa que es una sustancia química que permite la comunicación entre las células nerviosas en el cerebro.[15]
Investigaciones
Se han sugerido un gran número de aplicaciones médicas potenicales para la agmatina:[18]
Cardiovascular
La agmatina produce reducciones leves en el ritmo cardíaco y en la presión sanguínea, aparentemente activando tanto los sistemas de control central como los periféricos por medio de la modulación de varias de sus dianas moleculares entre las que se incluyen: varios receptores imidazolínicos, liberación de norepinefrina y producción de NO.[19]
Regulación de la glucosa
Los efectos hipoglucemiantes de la agmatina son el resultado de la modulación simultánea de varios mecanismos moleculares involucrados en la regulación sanguínea de la glucosa.[9]
Funciones renales
La agmatina ha demostrado aumentar la tasa de filtración glomerular y ejercer efectos nefroprotectores.[20]
Neurotransmisión
Se ha discutido la función de la agmatina como neurotransmisor putativo. Se sintetiza en el cerebro, se almacena en vesículas sinápticas, se acumula por recaptación, se libera con la despolarización de membrana, y se inactiva por acción de la agmatinasa. La agmatina se une a sitios específicos en los receptores α2-adrenérgicos e imidazolínicos, y bloquéa a los receptores NMDA y a otros canales iónicos catiónicos activados por voltaje. Salvo porque aún no se ha demostrado la existencia de sus propios receptores postsinápticos, la agmatina, de hecho, cumple con los criterios de Henry Dale para un neurotransmisor, y por lo tanto, se lo considera un neuromodulador y cotransmisor. La existencia teórica de sistemas neuronales agmatinérgicos aún no ha sido demostrada, aunque la existencia de tales receptores está implícita debido a su acción prominente en la modulación de los sistemas nerviosos central y periférico.[9] Las investigaciones centradas en la búsqueda de vías y receptores específicos para la agmatina continúa. Debido a su capacidad para pasar a través de los canales catiónicos abiertos, también se ha utilizado a la agmatina como unidad de medida sustituta para el flujo iónico total hacia el interior de los tejidos nerviosos bajo estimulación.[21] Cuando el tejido neuronal se incuba con agmatina y se aplica un estímulo externo, solo las células con canales abiertos incorporan la agmatina, permitiendo la identificación de cuales son las células sensibles a ese estímulo y el grado en que abren sus canales durante el período de estimulación.
Modulación opioide
La agmatina sistémica puede potenciar la analgesia opioide y prevenir la tolerancia crónica a la morfina en ratones de laboratorio.
Systemic agmatine can potentiate opioid analgesia and prevent tolerance to chronic morphine in laboratory rodents. Desde entonces, la evidencia acumulada muestra ampliamente que la agmatina inhibe la dependencia a los opioides y la recaída en varias especies animales.[22]
Referencias
- «agmatine (CHEBI:17431)». Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 15 de agosto de 2008. Main. Consultado el 11 de enero de 2012.
- Número CAS
- Kossel A (1910). «Über das Agmatin». Zeitschrift für Physiologische Chemie (en alemán) 66: 257-261. doi:10.1515/bchm2.1910.66.3.257.
- «agmantine». Oxford English Dictionary (2.ª edición). Oxford University Press. 1989.
- Engeland R, Kutscher F (1910). «Ueber eine zweite wirksame Secale-base.». Z Physiol Chem (en alemán) 57: 49-65.
- Dale HH, Laidlaw PP (1911). «Further observations on the action of beta-iminazolylethylamine». J. Physiol. (Lond.) 43 (2): 182-95. PMC 1512691. PMID 16993089. doi:10.1113/jphysiol.1911.sp001464.
- Frank E, Nothmann M, Wagner A (1926). «über Synthetisch Dargestellte Körper mit Insulinartiger Wirkung Auf den Normalen und Diabetischen Organismus». Klinische Wochenschrift (en alemán) 5 (45): 2100-2107. doi:10.1007/BF01736560.
- Li G, Regunathan S, Barrow CJ, Eshraghi J, Cooper R, Reis DJ (1994). «Agmatine: an endogenous clonidine-displacing substance in the brain». Science 263 (5149): 966-9. PMID 7906055. doi:10.1126/science.7906055.
- Piletz JE, Aricioglu F, Cheng JT, Fairbanks CA, Gilad VH, Haenisch B, Halaris A, Hong S, Lee JE, Li J, Liu P, Molderings GJ, Rodrigues AL, Satriano J, Seong GJ, Wilcox G, Wu N, Gilad GM (2013). «Agmatine: clinical applications after 100 years in translation». Drug Discov. Today 18 (17–18): 880-93. PMID 23769988. doi:10.1016/j.drudis.2013.05.017.
- Demady DR, Jianmongkol S, Vuletich JL, Bender AT, Osawa Y (2001). «Agmatine enhances the NADPH oxidase activity of neuronal NO synthase and leads to oxidative inactivation of the enzyme». Molecular Pharmacology 59 (1): 24-9. PMID 11125020.
- Taksande BG, Kotagale NR, Nakhate KT, Mali PD, Kokare DM, Hirani K, Subhedar NK, Chopde CT, Ugale RR (2011). «Agmatine in the hypothalamic paraventricular nucleus stimulates feeding in rats: involvement of neuropeptide Y». Br. J. Pharmacol. 164 (2b): 704-18. PMC 3188911. PMID 21564088. doi:10.1111/j.1476-5381.2011.01484.x.
- Gilad GM, Gilad VH (2013). «Evidence for oral agmatine sulfate safety--a 95-day high dosage pilot study with rats». Food Chem. Toxicol. 62: 758-62. PMID 24140462. doi:10.1016/j.fct.2013.10.005.
- Nissim I, Horyn O, Daikhin Y, Chen P, Li C, Wehrli SL, Nissim I, Yudkoff M (2014). «The molecular and metabolic influence of long term agmatine consumption». J. Biol. Chem. 289 (14): 9710-29. PMC 3975019. PMID 24523404. doi:10.1074/jbc.M113.544726.
- Galgano, Fernanda; Caruso, Marisa; Condelli, Nicola; Favati, Fabio (7 de junio de 2012). «Focused Review: Agmatine in Fermented Foods». Frontiers in Microbiology 3. ISSN 1664-302X. PMC 3369198. PMID 22701114. doi:10.3389/fmicb.2012.00199.
- Wang, Che-Chuan. "Beneficial Effect of Agmatine on Brain Apoptosis, Astrogliosis, and Edema after Rat Transient Cerebral Ischemia." BMC Pharmacology. BioMed Central, 6 Sept. 2010. Web. 03 Mar. 2016.
- Haenisch B, von Kügelgen I, Bönisch H, Göthert M, Sauerbruch T, Schepke M, Marklein G, Höfling K, Schröder D, Molderings GJ (2008). «Regulatory mechanisms underlying agmatine homeostasis in humans». Am. J. Physiol. Gastrointest. Liver Physiol. 295 (5): G1104-10. PMID 18832451. doi:10.1152/ajpgi.90374.2008.
- Huisman H, Wynveen P, Nichkova M, Kellermann G (2010). «Novel ELISAs for screening of the biogenic amines GABA, glycine, beta-phenylethylamine, agmatine, and taurine using one derivatization procedure of whole urine samples». Anal. Chem. 82 (15): 6526-33. PMID 20586417. doi:10.1021/ac100858u.
- Halaris A, Plietz J (2007). «Agmatine : metabolic pathway and spectrum of activity in brain.». CNS Drugs 21 (11): 885-900. PMID 17927294. doi:10.2165/00023210-200721110-00002.
- Raasch W, Schäfer U, Chun J, Dominiak P (2001). «Biological significance of agmatine, an endogenous ligand at imidazoline binding sites». Br. J. Pharmacol. 133 (6): 755-80. PMC 1572857. PMID 11454649. doi:10.1038/sj.bjp.0704153.
- Satriano J (2004). «Arginine pathways and the inflammatory response: interregulation of nitric oxide and polyamines: review article». Amino Acids 26 (4): 321-9. PMID 15290337. doi:10.1007/s00726-004-0078-4.
- Marc, RE (28 de abril de 1999). «Mapping glutamatergic drive in the vertebrate retina with a channel-permeant organic cation.». The Journal of Comparative Neurology 407 (1): 47-64. PMID 10213187. doi:10.1002/(sici)1096-9861(19990428)407:1<47::aid-cne4>3.0.co;2-0.
- Su RB, Li J, Qin BY (julio de 2003). «A biphasic opioid function modulator: agmatine». Acta Pharmacol. Sin. 24 (7): 631-6. PMID 12852826. Archivado desde el original el 8 de noviembre de 2020. Consultado el 25 de mayo de 2017.
Lecturas adicionales
- Wilcox, G.; Fiska, A.; Haugan, F.; Svendsen, F.; Rygh, L.; Tjolsen, A.; Hole, K. (2004). «Central sensitization: The endogenous NMDA antagonist and NOS inhibitor agmatine inhibits spinal long term potentiation (LTP)». The Journal of Pain 5 (3): S19. doi:10.1016/j.jpain.2004.02.041.