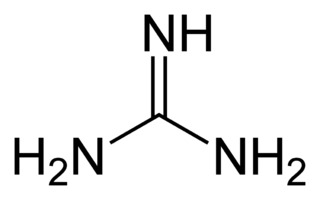
Guanidina
La guanidina es un compuesto puro cristalino muy alcalino, formado a partir de la oxidación de la guanina. Se encuentra de manera natural en la orina como un producto normal del metabolismo de las proteínas. Su acumulación en el cuerpo, como en casos de enfermedad renal crónica, está asociada con neurotoxicidad. Se usa en la fabricación de plásticos, cauchos y explosivos. No se debe confundir con la guanina, una de las bases que forman el ADN, ni con la guanosina, su nucleósido.
| Guanidina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Guanidina | ||
| General | ||
| Fórmula molecular | CH5N3 | |
| Identificadores | ||
| Número CAS | 113-00-8[1] | |
| ChEBI | 42820 | |
| ChEMBL | CHEMBL821 | |
| ChemSpider | 3400 | |
| DrugBank | 00536 | |
| PubChem | 3520 | |
| UNII | JU58VJ6Y3B | |
| Propiedades físicas | ||
| Masa molar | 5907 g/mol | |
| Punto de fusión | 323,15 K (50 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Catión guanidinio
Con una constante de disociación ácida pKa de 12.5, la guanidina está protonada en condiciones fisiológicas, con una carga de +1. Este ácido conjugado de la guanidina se llama catión guanidinio, [CH6N3]+.
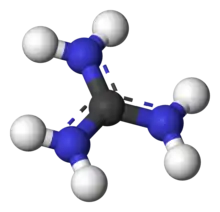
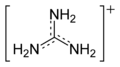
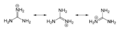
Formas canónicas
Entre las sales importantes se incluye el hidrocloruro de guanidina, con propiedades caotrópicas, usado para desnaturalizar proteínas. Empíricamente se sabe que el hidrocloruro de guanidina desnaturaliza las proteínas en relación lineal entre su concentración y la energía libre de desplegado.
Derivados de la guanidina
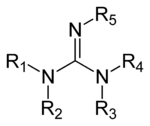
Las guanidinas son un grupo de sustancias orgánicas con un grupo funcional común que tienen una estructura general del tipo (R1R2N)(R3R4N)C=N-R5. El enlace central dentro de este grupo corresponde a una imina; los otros son aminales. Ejemplos de guanidinas son el triazabiciclodeceno y la saxitoxina.
Uso como combustible alternativo
Actualmente se está analizando la posibilidad de utilizar la guanidina como un combustible alternativo. En presencia de un catalizador, un mol de guanidina se combina con 2 moles de agua para dar 3 moles de amoníaco y 1 mol de dióxido de carbono. El amoníaco se puede usar directamente como combustible en motores de combustión interna, o ser descompuesto en nitrógeno e hidrógeno para su uso en celdas combustible.
La guanidina se puede suministrar pura como un combustible sólido (punto de fusión ~ 50 °C) o en una mezcla con urea con un punto de fusión eutéctico menor.