Aminación reductora
La aminación reductora, o aminación reductiva, es una reacción química que implica la conversión de un grupo carbonilo de una cetona o aldehído en una amina.
Mecanismo de reacción
En esta reacción orgánica, la amina primero reacciona con el grupo carbonilo, de manera reversible, para formar la imina, acompañada de la pérdida de una molécula de agua. El equilibrio entre aldehído/cetona e imina puede ser desplazado hacia la formación de imina separando el agua que se forma del medio de reacción.
Este intermedio imina puede ser a continuación aislado y reducido con un agente reductor apropiado (por ejemplo, borohidruro de sodio o hidruro de litio y aluminio). Esto sería una aminación reductora indirecta, y requiere que la imina sea aislable. Tiene la ventaja que en el caso de las aminas primarias se evita, de serlo, el problema de la dialquilación de la amina.
Es habitual, sin embargo, llevar a cabo la misma reacción toda en un único recipiente, (amina, compuesto carbonílico y reductor juntos), con la formación de la imina y su reducción sucediendo al mismo tiempo. Esto sería una aminación reductora directa, donde se usan agentes reductores que son más reactivos con las iminas que con el grupo carbonilo y estables al pH ácido que requiere la formación de aquellas, siendo en este caso adecuado el cianoborohidruro de sodio, lo que permite llevar a cabo la síntesis en una única etapa. Otro reductor también usado en este tipo de síntesis es el triacetoxiborohidruro de sodio NaBH(OAc)3, que no tiene los problemas de toxicidad del NaBH3CN.
También es posible el empleo de la catálisis heterogénea con metales para llevar a cabo la hidrogenación de la imina.
En el caso de aminas secundarias el intermedio sería el ion iminio.
Modificaciones
Existen diversas reacciones que parten del principio de la aminación reductiva, utilizando reductores en condiciones más suaves.
Reacción de Mignonac
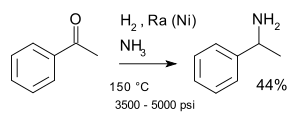
Una reacción clásica es la aminación reductiva de Mignonac(1921)[1] la cual emplea una cetona en amoniaco, llevándose a cabo simultáneamente una hidrogenación catalítica con níquel. Un ejemplo es la síntesis de la 1-feniletilamina a partir de acetofenona:[2]
En la industria, las aminas terciarias como trietilamina y diisopropiletilamina son elaboradas a partir de cetonas con una mezcla gaseosa de amoniaco, hidrógeno y un catalizador.
Reacción de Leuckart
La reacción de Leuckart es una aminación reductiva que parte de aldehídos o cetonas y formiato de amonio como fuente de aminación (catión amonio) y como reductor (anión formiato).[3] La reportó por primera vez el químico alemán Rudolf Leuckart.[4]
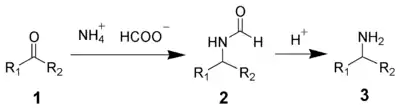
Se pueden utilizar formamidas en lugar de formato de amonio.[5]
Reacción de Leuckart–Wallach
La reacción de Leuckart–Wallach es un método especial de aminación reductiva que emplea como sustratos una cetona, una amina y un exceso esquiométrico de ácido fórmico, el cual funciona como fuente de protones y como fuente de electrones al donar grupos hidruro.[6][7]
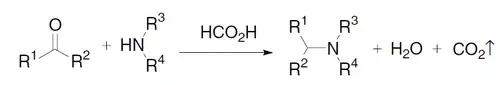
El mecanismo de la reacción consiste en tres etapas fundamentales:
- a) Formación de un hemiaminal por adición del nitrógeno de la amina al carbonilo de la cetona.
- b) Eliminación de agua en el hemiaminal para formar un catión iminio.
- c) Reducción del catión iminio, siendo el mismo ácido fórmico la fuente de hidruro. En este paso se forma la amina.
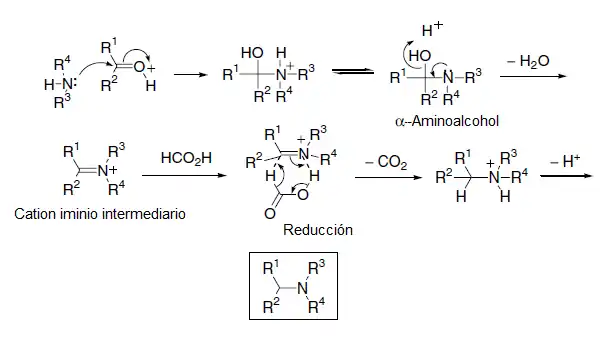
Reacción de Eschweiler–Clarke
En este método se logra una metilación por aminación reductiva entre una amina primaria y formaldehído en ácido fórmico. .[8][9][10][11]
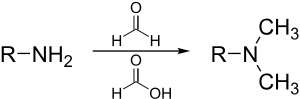
El mecanismo procede con la primera metilación, en donde primero se forma la formimina a partir del formaldehído. De la misma manera que en la reacción de Leuckart–Wallach, el ácido fórmico funge simultáneamente como ácido y como reductor. La fuerza motriz de la reacción es la formación de bióxido de carbono a partir del ácido fórmico. Espontáneamente procede la segunda metilación por el mismo mecanismo, aunque con una velocidad menor.
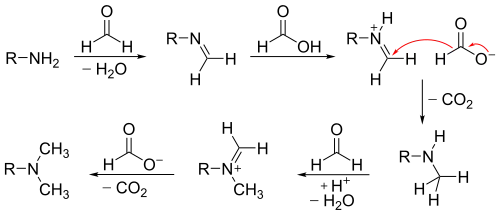
Las aminas quirales típicamente no sufren racemización bajo estas condiciones.[12]
Aminación reductiva biológica
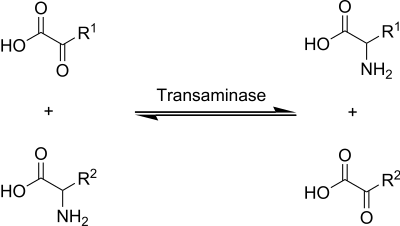
En el metabolismo de aminoácidos existe un proceso denominado transaminación, que consiste básicamente en una aminación reductiva reversible entre un aminoácido y un α-cetoácido, en la que el grupo amino es transferido de aquel a éste, con la consiguiente conversión del aminoácido en su correspondiente α-cetoácido. Estas reacciones son llevadas a cabo por enzimas llamadas aminotransferasas. Todas estas enzimas requieren de fosfato de piridoxal (vitamina B6) como grupo prostético, una razón importante de que esta vitamina sea esencial para la vida.[13]
Un caso especial de aminación reductiva es la biosíntesis ácido glutámico a partir de α-cetoglutarato; la fuente de amoniaco es el grupo carbamilo de la L-glutamina y el tipo de reductor depende del organismo:
Enzima: Glutamato sintasa-NADPH dependiente (EC 1.4.1.13); presente en bacterias y plantas.
- L-glutamina + 2-oxoglutarato + NADPH + H+ 2 L-glutamato + NADP+
Enzima: Glutamato sintasa-Ferredoxina dependiente. (EC 1.4.7.1)
- L-glutamina + 2-oxoglutarato + 2 ferredoxina reducida + 2 H+ 2 L-glutamato + 2 ferredoxina oxidada
Enzima: Glutamato sintasa-NADH dependiente. (EC 1.4.1.14)
- L-glutamina + 2-oxoglutarato + NADH + H+ 2 L-glutamato + NAD+
Referencias
- Nouvelle méthodegénérale de préparation des amines à partir des aldéhydes ou des cétones. M. Georges Mignonac, Compt. rend., 172, 223 (1921).
- "α-Phenylethylamine". Org. Synth.; Coll. Vol. 3: 717.
- Leuckart, R. (1885). «Ueber eine neue Bildungsweise von Tribenzylamin». Ber. 18 (2): 2341. doi:10.1002/cber.188501802113.
- Wallach, O. (1893). «Zur Kenntniss der Terpene und der ätherischen Oele; Zweiundzwanzigste Abhandlung. I. Ueber die Bestandtheile des Tujaöls». Ann. 272 (1): 99. doi:10.1002/jlac.18932720103.
- deBenneville, P. L.; Macartney, J. H. (1950). «The Behavior of Aliphatic Aldehydes in the Leuckart-Wallach Reactionjournal». J. Am. Chem. Soc. 72 (7): 3073-3075. doi:10.1021/ja01163a074.
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- Moore (1949). Org. React. 5: 301.
- Eschweiler, W. Ber. 1905, 38, 880.
- Clarke, H. T.; Gillespie, H. B.; Weisshaus, S. Z. J. Am. Chem. Soc. 1933, 55, 4571.
- Moore, M. L. Org. React. 1949, 5, 301–330. (Review)
- Icke, R. N.; Wisegarver, B. B.; Alles, G. A. (1945). «β-Phenylethyldimethylamine». Org. Synth. 25: 89. Archivado desde el original el 5 de junio de 2011. Consultado el 29 de mayo de 2011.
- Farkas, E.; Sunman, C. J. J. Org. Chem. 1985, 50, 1110. (doi 10.1021/jo00207a037)
- Albert L. Lehninger, David Lee Nelson, Michael M. Cox (2005). Principles of biochemistry, Vol. 1 4th ed. W.H. Freeman,. ISBN 9780716743392.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
Enlaces externos
- Métodos actuales de aminación reductora (Inglés)
- Aminación reductora industrial en BASF