Antraceno
El antraceno es un hidrocarburo aromático policíclico. A temperatura ambiente se trata de un sólido incoloro que sublima fácilmente. El antraceno es incoloro pero muestra una coloración azul fluorescente cuando se somete la radiación ultravioleta. En 2010 el Observatorio del Roque de los Muchachos realizó unas mediciones en espectroscopia infrarroja de una región situada a 700 años luz de la Tierra en la dirección de la estrella Cernis 52 (constelación de Perseo) y permitió la detección de ingentes cantidades de antraceno suspendidas en una nube.[2] Este descubrimiento aproxima el entendimiento de cómo las moléculas prebióticas llegaron a la Tierra.
| Antraceno | ||
|---|---|---|
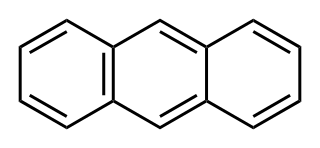 Estructura química | ||
 Fórmula tridimensional | ||
| General | ||
| Fórmula molecular | C14H10 | |
| Identificadores | ||
| Número CAS | 120-12-7[1] | |
| ChEBI | 35298 | |
| ChEMBL | CHEMBL333179 | |
| ChemSpider | 8111 | |
| PubChem | 8418 | |
| UNII | EH46A1TLD7 | |
| KEGG | C14315 | |
| Propiedades físicas | ||
| Densidad | 1280 kg/m³; 1,28 g/cm³ | |
| Masa molar | 17 823 g/mol | |
| Punto de fusión | 488,8 K (216 °C) | |
| Punto de ebullición | 613 K (340 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Historia del antraceno
El antraceno fue descubierto en 1832 por Auguste Laurent y Jean Dumas a partir del alquitrán. Por oxidación del antraceno Laurent consiguió en 1836 la primera síntesis del oxígeno y del ácido sebaslico.
Reactividad
Aunque el antraceno es un sistema completamente aromático el anillo central muestra también reactividad de dieno siendo susceptible de reacciones Diels-Alder. El anillo central también es más fácilmente oxidable o reducible, debido a la acción de los dos átomos centrales que conservan dos anillos fenílicos con su sistema aromático intacto y por esta situación es energéticamente más favorable.
Síntesis
El antraceno se obtiene como en el siglo XIX del alquitrán o se puede sintetizar a partir de benzoquinona y 1,3-butadieno y reducción de la antraquinona con zinc. Rutas alternativas pasan por el anhídrido del ácido ftálico y benceno en reacción Friedel-Crafts o por deshidratación de la 2-metil-benzofenona.
Usos
Casi todo el antraceno es oxidado para dar antraquinona y por lo tanto sustancia de partida en la síntesis de una amplia gama de colorantes como la alizarina.
Se utiliza también en la síntesis de algunos insecticidas, conservantes, etc.
Un cristal de antraceno se utilizó en el experimento de Chien Siung Wu para demostrar la violación de la paridad en las interacciones débiles. En dicho experimento, un cristal de antraceno se usó como detector de electrones, ya que al chocar estos con el cristal, emite un destello, que con la ayuda de un fotomultiplicador permitió observar una notable asimetría en la emisión de electrones, lo que permitió a su vez demostrar la violación de la paridad.