Bomba de solubilidad
En biogeoquímica oceánica, la bomba de solubilidad es un proceso físico-químico que transporta carbono (como carbono inorgánico disuelto) desde la superficie del océano hacia su interior.
Introducción
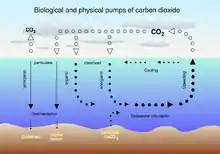
La bomba de solubilidad funciona por la acción de dos efectos que se dan en el océano:
- La solubilidad del dióxido de carbono es una acusada función inversa de la temperatura superficial marina (la solubilidad es mayor cuanto más fría es el agua)
- La circulación termohalina debida a la formación de agua profunda en altas latitudes, donde el agua de mar normalmente es más fría y densa
Como las aguas profundas se forman desde la superficie en unas condiciones favorables a la solubilidad del dióxido de carbono, contienen una mayor concentración de carbono inorgánico disuelto de lo que podría esperarse sin tener en cuenta tales efectos. Por tanto estos efectos consiguen bombear carbono desde la atmósfera al interior de los océanos.
Las aguas profundas circulan hasta latitudes ecuatoriales, más cálidas, emergen a la superficie, y al disminuir la solubilidad emiten grandes cantidades de dióxido de carbono a la atmósfera.
La bomba de solubilidad tiene una contrapartida biológica, la bomba biológica. Para una introducción a ambas ver Raven & Falkowski (1999).[1]
Solubilidad del dióxido de carbono
El dióxido de carbono, como otros gases, es soluble en agua. Sin embargo, a diferencia de otros gases como por ejemplo el oxígeno, reacciona con el agua y forma un balance de varias especies iónicas y no iónicas, conocidas colectivamente como carbono inorgánico disuelto. Estas especies son: dióxido de carbono libre disuelto (CO2 (aq)), ácido carbónico (H2CO3), bicarbonato (HCO3-) y carbonato (CO32-). Interaccionan con el agua así:
El balance de estas especies, que afecta en definitiva a la solubilidad del dióxido de carbon, depende de factores tales como el pH. En el agua de mar éste se regula por el balance de carga entre iones positivos (p.e. Na+, K+, Mg2+, Ca2+) y negativos (p.e. el mismo CO32-, Cl-, SO42-, Br-). Normalmente el balance de tales iones deja una carga neta positiva. Esto afecta al balance del sistema de carbonatos, que para compensar se desplaza hacia el lado de los iones negativos. El resultado es una menor concentración de dióxido de carbono libre y de especies carbónicas ácidas, que a su vez conduce a una mayor toma de dióxido de carbono desde la atmósfera para compensar el balance. Por tanto cuanto mayor es el desequilibrio de carga positiva, mayor es la solubilidad del dióxido de carbono. En términos de la química de los carbonatos, a este desequilibrio se le denomina alcalinidad.
Desde el punto de vista de las medidas, hay cuatro parámetros de importancia clave: carbono inorgánico total (CIT, TCO2 o CT), alcalinidad Total (TALK o AT), pH, y pCO2. Midiendo dos cualesquiera de esos parámetros pueden determinarse un amplio rango de especies dependientes del pH (incluyendo las especies mencionadas antes). Este balance puede cambiar por varios procesos. Por ejemplo, el flujo de aire marino del CO2, la disolución/precipitación de CaCO3, o una actividad biológica como la fotosíntesis/respiración. Cada uno de estos procesos tiene diferentes efectos en cada uno de los cuatro parámetros básicos, y juntos ejercen una gran influencia en los ciclos globales. Es importante notar que la carga local neta de los océanos es nula durante cualquier proceso químico.
Cambios Antropogénicos
Los cambios en el uso de la tierra, la combustión de combustibles fósiles y la producción de cemento han generado un flujo de CO2 a la atmósfera. Se estima que, hoy en día, el océano acoge en torno a un tercio (aproximadamente 2 gigatoneladas de carbono al año)[2][3] de las emisiones antropogénicas de CO2. La bomba de solubilidad es el mecanismo principal que gobierna este flujo, con la consecuencia de que el CO2 antropogénico llega al interior del océno a través la formación de aguas profundas en altas latitudes, particularmente en el Atlántico Norte. En última instancia la mayoría del CO2 emitido por las actividades humanas se disolverá en el océano,[4] pero no está claro el ritmo al que el océano lo asimilará en el futuro.
En un estudio del ciclo del carbono hasta el siglo 21, Cox et al. (2000)[5] predicen que el ritmo de asimilación del CO2 empezará a saturarse (alcanzar su máximo) a 5 gigatoneladas de carbono por año en el 2100. Esto se debería parcialmente a las no linealidades en el sistema de carbonatos marino, pero también debido al cambio climático. El calentamiento oceánico disminuye la solubilidad del CO2 en el agua de mar, ralentizando la respuesta del océano a las emisiones. El calentamiento también incrementa la estratificación del océano, aislando la superficie de las aguas más profundas. Además los cambios en la circulación termohalina de los océanos (específicamentes ralentización)[6] puede actuar para disminuir el transporte de CO2 disuelto hacia las profundidades del océano. Sin embargo la magnitud de estos procesos aún es incierta, impidiendo buenas estimaciuones a largo plazo del destino de la bomba de solubilidad.
Aunque la absorción de CO2 antropogénico desde la atmósfera actúa para disminuir el cambio climático, causa acidificación del océano que se cree tendrá consecuencias negativas para los ecosistemas marinos.[7]
Véase también
- Bomba biológica
- Bomba de la plataforma continental
- Acidificación del océano
Referencias
- Raven, J. A. and P. G. Falkowski (1999). Oceanic sinks for atmospheric CO2. Plant Cell Environ. 22, 741-755.
- Takahashi, T., S. C. Sutherland, C. Sweeney, A. Poisson, N. Metzl, B. Tilbrook, N. Bates, R. Wanninkhof, R. A. Feely, C. Sabine, J. Olafsson and Y. C. Nojiri (2002) Global sea-air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects. Archivado el 16 de agosto de 2009 en Wayback Machine. Deep-Sea Res. Pt. II 49, 1601-1622.
- Orr, J. C., E. Maier-Reimer, U. Mikolajewicz, P. Monfray, J. L. Sarmiento, J. R. Toggweiler, N. K. Taylor, J. Palmer, N. Gruber, C. L. Sabine, C. Le Quéré, R. M. Key and J. Boutin (2001). Estimates of anthropogenic carbon uptake from four three-dimensional global ocean models. Global Biogeochem. Cycles 15, 43-60.
- Archer, D. (2005). Fate of fossil fuel CO2 in geologic time. J. Geophys. Res., 110, doi:10.1029/2004JC002625.
- Cox, P. M., Betts, R. A., Jones, C. D., Spall, S. A. and Totterdell, I. J. (2000). Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model. Nature, 408, 184-187.
- Bryden, H. L., Longworth, H. R. and Cunningham, S. A. (2005). Slowing of the Atlantic meridional overturning circulation at 25° N. Nature, 438, 655-657.
- Orr, J. C. et al. (2005). Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms. Nature 437, 681-686.