Célula granulosa
Las células granulosas son las células más pequeñas que se encuentran en el encéfalo y son un tipo de neurona extremadamente pequeña. Las células granulosas se encuentran dentro de la capa granular del cerebelo (la cual es también conocida como la capa 3, la capa más interna de la corteza cerebelar, con la capa intermedia siendo la capa de las células de Purkinje y la capa molecular siendo la capa externa), el giro dentado del hipocampo, la capa superficial del núcleo coclear dorsal, y en el bulbo olfatorio.
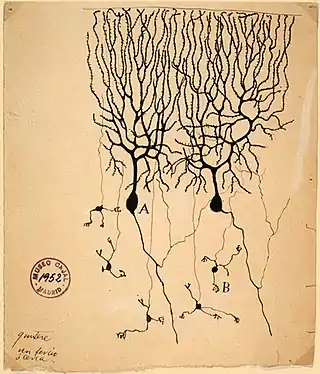
Las células granulosas del cerebelo representan casi la mitad de las neuronas del sistema nervioso central.[1] Las células granulosas reciben entradas excitatorias de las fibras musgosas procedentes de los núcleos pontinos. Las células granulares envían fibras paralelas a través de la capa de Purkinje hacia la capa molecular donde estas se ramifican y se propagan a través de ramificaciones a las dendritas de las células de Purkinje. Estas fibras paralelas forman miles de sinapsis excitatorias entre células granulares y células de Purkinje en las dendritas intermedias y distales de las células de Purkinje, utilizando el glutamato como neurotransmisor.
Las células granulares de la capa 4 de la corteza cerebral reciben entradas del tálamo y envían proyecciones a las capas supragranulares 2-3, pero también a las capas infragranulares de la corteza cerebral.
Estructura
Las células granulosas en diferentes regiones del cerebro son funcional y anatómicamente diversas: lo principal que tienen en común es su pequeñez. Por ejemplo, las células granulares del bulbo olfatorio son GABAérgicas y sin axones, mientras que las células granulares en el giro dentado tienen axones de proyecciones glutamatérgicas. Estas dos poblaciones de células granulares son también las únicas poblaciones neuronales importantes que sufren neurogénesis adulta, mientras que las células granulosas cerebelares y las células granulosas corticales no lo hacen. Las células granulares tienen una estructura típica de una neurona que consiste de dendritas, soma y un axón.
Dendritas: cada célula tiene de 3 - 4 dendritas redondas cortas que terminan en una garra. Cada una de las dendritas mide alrededor de 15 micras de longitud.
Soma: las células granulares tienen un soma pequeño cuyo diámetro es de aproximadamente 10 micras.
Axón: Cada células granulares envía un solo axón hacia el árbol dendrítico de células, las células de Purkinje. El axón tiene un diámetro muy estrecho: ½ micrones.
Sinapsis: entre 100,000 y 300,000 axones de las células granulares hacen sinapsis en una sola célula de Purkinje.
La existencia de uniones comunicantes (unión gap) entre las células granulares permite que múltiples puedan acoplarse unas a otras permitiendo que las células múltiples actúen en la sincronización y que permitan señalar las funciones necesarias para que ocurra el desarrollo de células granulares.[2]
Las células granulosas cerebelares
Las células granulares, producidas por el labio rómbico, se encuentran en la capa de células granulares de la corteza cerebelosa. Son pequeñas y numerosas. Se caracterizan por un soma muy pequeño y varias dendritas cortas que terminan en terminaciones en forma de garra. En el microscopio electrónico de transmisión, estas células se caracterizan por un núcleo teñido de oscuro rodeado de un fino borde de citoplasma. El axón asciende hasta la capa molecular, donde se divide para formar fibras paralelas.[1]
Célula granulosa dentada
El tipo de célula principal del giro dentado, es la célula granulosa. La célula granulosa dentada tiene un cuerpo celular elíptico con un ancho aproximado de 10μm y una altura de 18 μm.[3]
La célula granulosa tiene un árbol característico en forma de cono con dendritas de puntas espinosas. Las ramas de las dendritas se proyectan a través de toda la capa molecular, y las últimas puntas del árbol dendrítico, terminan justamente en la fisura hipocampal, o en la superficie ventricular.[4] Las células granulosas están estrechamente empaquetadas en la capa de la célula granulosa del giro dentado.
Célula granulosa núcleo coclear dorsal
Las células granulosas en el núcleo coclear dorsal son pequeñas neuronas con dos o tres dendritas cortas que dan lugar a unas cuantas ramificaciones con expansiones en las terminales. Las dendritas son cortas con terminaciones en forma de garra, las cuales forman glomérulos para recibir a las fibras musgosas, similares a las células granulosas cerebelares.[5] Su axón se proyecta a la capa molecular del núcleo coclear dorsal donde forma fibras paralelas, las cuales también son similares a las células granulosas cerebelares.[6] Las células granulares cocleares dorsales son pequeñas interneuronas excitadoras relacionadas con el desarrollo, por lo que se asemejan a la célula granular cerebelosa.
Célula granulosa bulbo olfatorio
La principal célula granulosa intrínseca del bulbo olfatorio de los vertebrados carece de axón (al igual que la neurona accesoria). Cada célula da lugar a dendritas centrales cortas y a una única dendrita apical larga que se expande en la capa de células granulares y penetra en la capa del cuerpo celular mitral. Las ramas de las dendritas terminan dentro de la capa plexiforme externa entre las dendritas del tracto olfatorio.[7] En el bulbo olfatorio de los mamíferos, las células granulares pueden procesar tanto la entrada como la salida sináptica debido a la presencia de grandes espinas.[8]
Función
Red neuronal
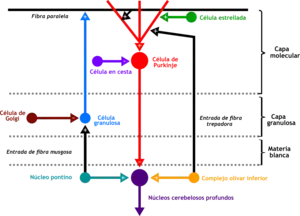
Las células granulosas reciben entradas excitatorias de tres o cuatro fibras musgosas que se originan en el núcleo Pontino. Las fibras musgosas hacen una conexión excitatoria en las células granulosas lo que causa que las células granulosas disparen un potencial de acción.
El axón de una célula granular cerebelosa se divide para formar una fibra paralela que inerva las células de Purkinje. La gran mayoría de las sinapsis axonales de las células granulares se encuentran en las fibras paralelas[9]
Las fibras paralelas son enviadas a través de la capa Purkinje hacia la capa molecular donde se ramifican y distribuyen a través de los árboles dendríticos de la célula Purkinje. Estas fibras paralelas forman miles de sinapsis excitatorias entre células granulares y células de Purkinje en las dendritas de las células de Purkinje.
Esta conexión es excitatoria en tanto que se libera glutamato.
Las fibras paralelas y las sinapsis de axones ascendentes de la misma célula granulosa se disparan en sincronía, lo cual resulta en señales excitatorias. En la corteza cerebelar existe una variedad de neuronas inhibitorias (interneuronas). Las únicas neuronas excitatorias en la corteza cerebelar son las células granulosas.[10]
La plasticidad de la sinapsis entre una fibra paralela y una célula de Purkinje se cree que es importante para el aprendizaje motriz.[11] La función de los circuitos cerebelosos depende por completo de los procesos llevados a cabo por la capa granular. Por lo tanto, la función de las células granulares determina la función cerebelosa en su conjunto.[12]
Entrada de la fibra musgosa en las células granulares del cerebelo
Las dendritas de las células granulares también hacen sinapsis con axones distintivos no mielinizados que Santiago Ramón y Cajal denominó fibras musgosas.[4] Las fibras musgosas y las células Golgi, ambas establecen conexiones sinápticas con las células granulosas. Juntas estas células forman los glomérulos.[10]
Las células granulares están sujetas a una inhibición por prealimentación: las células granulares excitan a las células de Purkinje, pero también excitan a las interneuronas GABAérgicas que inhiben a las células de Purkinje.
Las células granulares también están sujetas a la inhibición por retroalimentación: Las células de Golgi reciben estímulos excitatorios de las células granulares y, a su vez, devuelven señales inhibitorias a la célula granular.[13]
Los códigos de entrada de las fibras musgosas se conservan durante la transmisión sináptica entre las células granulares, lo que sugiere que la inervación es específica de la entrada que se recibe.[14] Las células granulares no se limitan a retransmitir señales de las fibras musgosas, sino que realizan diversas e intrincadas transformaciones que se requieren en el dominio espaciotemporal.[10]
Cada célula granular recibe una entrada de dos fibras musgosas diferentes. Por lo tanto, la entrada procede de dos lugares diferentes, a diferencia de la célula granular que recibe múltiples entradas de la misma fuente.
Las diferencias en las fibras musgosas que envían señales a las células granulares afectan directamente al tipo de información que las células granulares traducen a las células de Purkinje. La fiabilidad de esta traducción dependerá de la fiabilidad de la actividad sináptica en las células granulares y de la naturaleza del estímulo recibido.[15] La señal que una célula granulosa recibe de una fibra musgosa depende de la función de la fibra musgosa en sí misma. Por lo tanto, las células granulosas son capaces de integrar información de las diferentes fibras musgosas y generar diferentes patrones de actividad.[15]
Entrada de fibras trepadoras en las células granulares cerebelosas
Diferentes patrones de entrada de fibras musgosas producirán patrones únicos de actividad en las células granulares que pueden ser modificados por una señal de enseñanza transmitida por la entrada de fibras trepadoras. David Marr y James Albus sugirieron que el cerebelo funciona como un filtro adaptativo que altera el comportamiento motor en función de la naturaleza de la entrada sensorial.
Dado que múltiples (~200.000) células granulares sinaptan a una única célula de Purkinje, los efectos de cada fibra paralela pueden alterarse en respuesta a una "señal de enseñanza" procedente de la entrada de la fibra trepadora.
Funciones específica de las diferentes células granulosas
- Células granulosas del cerebelo
David Marr sugiere que las células granulosas codifican combinaciones de las entradas de las fibras musgosas. Para que las células granulosas respondan, necesitan recibir entradas activas de múltiples fibras musgosas. La combinación de múltiples entradas resulta en que el cerebelo sea capaz de hacer distinciones más precisas entre los patrones de entrada de lo que una sola fibras musgosas permitiría.[16] Las células granulosas del cerebelo también desempeñan un papel en la orquestación de las conducciones tónicas las cuales controlan el sueño en conjunción con la los niveles ambientales de GABA que se encuentran en el cerebro.
- Células granulares dentadas
La pérdida en el hipocampo de neuronas del giro dentado resultada en un déficit en la memoria espacial. Por lo tanto, las células granulosas dentadas se piensa que funcionan en la formación de la memoria espacial.[17][18] Las células granulosas dentadas jóvenes y viejas tienen papeles distintos en función de la memoria. Se cree que las células granulares jóvenes pera ya adultas participan en la separación de patrones, mientras que las células granulares maduras contribuyen a la rápida finalización de patrones.[19]
- Células granulosas cocleares dorsales
Las células piramidales de la corteza auditiva primaria se proyecta directamente hacia el núcleo coclear. Esto es importante en el reflejo de sobresalto acústico, en el cual las células piramidales modulan el reflejo de orientación secundaria y la entrada de las células granulosas es responsable por la orientación adecuada.[20] Esto se debe a que las señales recibidas por las células granulares contienen información sobre la posición de la cabeza. Las células granulares del núcleo coclear dorsal intervienen en la percepción y respuesta a los sonidos de nuestro entorno.
- Células granulosas del bulbo olfatorio
La inhibición generada por las células granulares, el tipo de célula GABAérgica más común en el bulbo olfatorio, desempeña un papel crítico en la formación de la salida del bulbo olfatorio.[21] Las células granulares GABAérgicas reciben dos tipos de señales excitatorias: las activadas por un receptor AMPA y las activadas por un receptor NMDA. Esto permite que las células granulosas puedan regular el procesamiento de la información sensorial en el bulbo olfatorio.[21] El bulbo olfatorio transmite información olfativa de la nariz al cerebro, lo cual es necesario para un buen sentido del olfato.[22]
Factores críticos para la función
- Calcio
La dinámica del calcio es esencial para muchas funciones de las células granulosas, tales el como cambio de potencial de membrana, la plasticidad sináptica, la apoptosis y la regulación de la transcripción genética.[10] Se desconoce la naturaleza de las señales de calcio que controlan la función presináptica y postsináptica de las espinas de las células granulares del bulbo olfatorio.[8]
- Óxido nítrico
Las neuronas granulosas tienen altos niveles de la isoforma neuronal de la óxido nítrico sintasa. Esta enzima depende de la presencia de calcio y es responsable de la producción de óxido nítrico (NO). Este neurotransmisor es un regulador negativo de la proliferación de precursores de células granulosas, que favorece la diferenciación de las distintas células granulares. El NO regula las interacciones entre las células granulosas y las células gliales[10] y es esencial para la protección de daños de las células granulosas. El NO también es responsable de la neuroplasticidad y el aprendizaje motor.[23]
Papel en la enfermedad
Alteración de la morfología de las células granulares dentadas
El receptor de tropomiosina quinasa B (TrkB) es responsable del mantenimiento de la conectividad sináptica normal de las células granulares dentadas.El TrkB también regula la morfología (biología) específica de las células granulosas y por lo que se considera que es importante en la regulación del desarrollo neuronal, la plasticidad neuronal, el aprendizaje y el desarrollo de la epilepsia.[24] La regulación del TrkB de las células granulosas es importante para prevenir los déficits de memoria y la epilepsia límbica. Esto se debe al hecho de que las células granulares dentadas desempeñan un papel crítico en la función del circuito entorrinal-hipocampal en la salud y la enfermedad. Las células granulares dentadas están situadas para regular el flujo de información hacia el hipocampo, una estructura necesaria para el aprendizaje y la memoria normales.[24]
Disminución de la neurogénesis de las células granulares
Tanto la epilepsia como la depresión muestran una producción alterada de células granulares del hipocampo.[25] La epilepsia se asocia a un aumento de la producción -pero a una integración aberrante - de células nuevas al principio de la enfermedad y a una disminución de la producción al final de la misma.[25] La integración aberrante de las células adultas generadas durante el desarrollo de la epilepsia puede afectar a la capacidad de la circunvolución dentada para evitar que el exceso de actividad excitatoria llegue a las células piramidales del hipocampo, favoreciendo así los ataques.[25] Los ataques epilépticos de larga duración estimulan la neurogénesis de las células granulares dentadas. Estas células granulares dentadas recién nacidas pueden dar lugar a conexiones aberrantes que provoquen la plasticidad de la red hipocampal asociada a la epileptogénesis.[26]
Dendritas de las células granulares más cortas
Los pacientes con Alzheimer tienen dendritas de células granulares más cortas. Además, las dendritas estaban menos ramificadas y tienen menos espinas que las de los pacientes que no padecían Alzheimer.[27] Sin embargo, las dendritas de las células granulares no son un componente esencial de las placas seniles y estas placas no tienen ningún efecto directo sobre las células granulares del giro dentado. Los cambios neurofibrilares específicos de las células granulares dentadas se dan en pacientes con Alzheimer, variante de cuerpos de Lewy y parálisis supranuclear progresiva.[28]
Enlaces externos
Referencias
- Llinás, Rodolfo; Walton, Kerry; Lang, Eric (2004). «Chapter 7: Cerebellum». En Shepherd, Gordon, ed. The synaptic organization of the brain. Oxford, New York: Oxford University Press. pp. 271-309. ISBN 9780195159561.
- C. Reyher, J Liibke, W Larsen, G Hendrix, M Shipley, and H Baumgarten (1991). «Olfactory Bulb Granule Cell Aggregates: Morphological Evidence for lnterperikaryal Electrotonic Coupling via Gap Junctions». The Journal of Neuroscience. 11(6): 1465-495.
- Claiborne BJ, Amaral DG, Cowan WM (1990). «A quantitative three-dimensional analysis of granule cell dendrites in the rat dentate gyrus». The Journal of Comparative Neurology 302: 206-219. doi:10.1002/cne.903020203.
- David G. Amaral, Helen E. Scharfman, and Pierre Lavenex (2007). Progress in Brain Research - dentate gyrus: fundamental neuroanatomical organization 163. pp. 3-22. doi:10.1016/S0079-6123(07)63001-5.
- Mugnaini E, Osen KK, Dahl AL, Friedrich VL Jr, Korte G. (1980). «Fine structure of granule cells and related interneurons (termed Golgi cells) in the cochlear nuclear complex of cat, rat and mouse». Journal of Neurocytology. 9(4): 537-70. doi:10.1007/BF01204841.
- E. Young, O. Oertel (2004). The Synaptic Organization of the Brain. Oxford University Press. doi:10.1093/acprof:oso/9780195159561.003.0004.
- K. Neville,L. Haberly (2004). The Synaptic Organization of the Brain. Oxford University Press. doi:10.1093/acprof:oso/9780195159561.003.0010.
- V Egger, K Svoboda, and Z Mainen (2005). «Dendrodendritic Synaptic Signals in Olfactory Bulb Granule Cells: Local Spine Boost and Global Low-Threshold Spike». The Journal of Neuroscience. 25(14): 3521-3530. doi:10.1523/JNEUROSCI.4746-04.2005.
- Huang CM, Wang L, Huang RH (2006). «Cerebellar granule cell: ascending axon and parallel fiber». European Journal of Neuroscience. 23(7): 1731-1737. doi:10.1111/j.1460-9568.2006.04690.x.
- M Manto and C De Zeeuw (2012). «Diversity and Complexity of Roles of Granule Cells in the Cerebellar Cortex». The Cerebellum. doi:10.1007/s12311-012-0365-7.
- M. Bear and M. Paradiso (2006). Neuroscience: Exploring the Brain. Lippincott Williams & Wilkins. p. 855. ISBN 9780781760034.
- M Schonewille, G Spitzmaul, A Badura , I Klein, Y Rudhard, W Wisden, C Hübner, C De Zeeuw and T Jentsch (2012). «Raising cytosolic Cl(-) in cerebellar granule cells affects their excitability and vestibulo-ocular learning.». The EMBO journal. doi:10.1038/emboj.2011.488.
- Eccles JC, Ito M, Szentagothai J (1967). The cerebellum as a neural machine. Springer-Verlag. p. 56.
- Bengtssona, F; Jörntell, H (2009). «Sensory transmission in cerebellar granule cells relies on similarly coded mossy fiber inputs.». PNAS 106 (7): 2389-2394. Bibcode:2009PNAS..106.2389B. PMC 2650166. PMID 19164536. doi:10.1073/pnas.0808428106.
- A Arenz, E Bracey and T Margrie (2009). «Sensory representations in cerebellar granule cells.». Current Opinion in Neurobiology. 19(4): 445-451. doi:10.1016/j.conb.2009.07.003.
- Marr D (1969). «A theory of cerebellar cortex». The Journal of Physiology 202: 437-70.
- M Colicos, P Dash (1996). «Apoptotic morphology of dentate gyrus granule cells following experimental cortical impact injury in rats: possible role in spatial memory deficits». Brain Research. 739(1-2): 120-131. doi:10.1016/S0006-8993(96)00824-4.
- Kovács KA (September 2020). «Episodic Memories: How do the Hippocampus and the Entorhinal Ring Attractors Cooperate to Create Them?». Frontiers in Systems Neuroscience 14: 68. PMC 7511719. PMID 33013334. doi:10.3389/fnsys.2020.559186.
- T Nakashiba, J Cushman, K Pelkey, S Renaudineau, D Buhl, T McHugh, V Rodriguez Barrera, R Chittajallu, K Iwamoto, C McBain, M Fanselow and S Tonegawa (2012). «Young Dentate Granule Cells Mediate Pattern Separation, whereas Old Granule Cells Facilitate Pattern Completion». Cell. doi:10.1016/j.cell.2012.01.046.
- Weedman DL, Ryugo DK (1996). «Projections from auditory cortex to the cochlear nucleus in rats: synapses on granule cell dendrites». The Journal of Comparative Neurology. 371(2): 311-324. doi:10.1002/(SICI)1096-9861(19960722)371:2<311::AID-CNE10>3.0.CO;2-V.
- R Balu, R Pressler, and B Strowbridge (2007). «Multiple Modes of Synaptic Excitation of Olfactory Bulb Granule Cells». The Journal of Neuroscience. 27(21): 5621-5632. doi:10.1523/JNEUROSCI.4630-06.2007.
- Jansen, Jaclyn. «First glimpse of brain circuit that helps experience to shape perception». ScienceDaily. Archivado desde el original el 6 de marzo de 2014. Consultado el 2 de marzo de 2014.
- R Feil , J Hartmann, C Luo, W Wolfsgruber, K Schilling, S Feil etal (2003). «Impairment of LTD and cerebellar learning by Purkinje cell specific ablation of cGMP-dependent protein kinase I.». The Journal of Cell Biology. 163(2): 295-302. doi:10.1083/jcb.200306148.
- S Danzer, R Kotloski, C Walter, Maya Hughes and J McNamara (2008). «Altered morphology of hippocampal dentate granule cell presynaptic and postsynaptic terminals following conditional deletion of TrkB». Hippocampus. 18(7): 668-678. doi:10.1002/hipo.20426.
- S Danzer (2012). «Depression, stress, epilepsy and adult neurogenesis». Experimental Neurology 233 (1): 22-32. PMC 3199026. PMID 21684275. doi:10.1016/j.expneurol.2011.05.023.
- J. Parent; T Yu; R Leibowitz; D Geschwind; R Sloviter; D Lowenstein (1997). «Dentate Granule Cell Neurogenesis Is Increased by Seizures and Contributes to Aberrant Network Reorganization in the Adult Rat Hippocampus». The Journal of Neuroscience 17 (10): 3727-3738. PMC 6573703. PMID 9133393. doi:10.1523/JNEUROSCI.17-10-03727.1997.
- Einstein G, Buranosky R, Crain BJ (1994). «Dendritic pathology of granule cells in Alzheimer's disease is unrelated to neuritic plaques». The Journal of Neuroscience 14 (8): 5077-5088. PMC 6577187. PMID 8046469. doi:10.1523/JNEUROSCI.14-08-05077.1994.
- Wakabayashi K, Hansen LA, Vincent I, Mallory M, Masliah E (1997). «Neurofibrillary tangles in the dentate granule cells of patients with Alzheimer's disease, Lewy body disease and progressive supranuclear palsy». Acta Neuropathologica 93 (1): 7-12. PMID 9006651. S2CID 10136450. doi:10.1007/s004010050576.