Plasticidad neuronal
La plasticidad neuronal, también llamada neuroplasticidad, plasticidad neural o plasticidad sináptica, de las neuronas cuando estas establecen comunicación, y que modula la percepción de los estímulos del medio, tanto los que entran como los que salen.[1] Esta dinámica deja una huella al tiempo que modifica la eficacia de la transferencia de la información a nivel de los elementos más finos del sistema.[2] Dichas huellas son los elementos de construcción de la cosmovisión,[3] en donde lo anterior modifica la percepción de lo siguiente.[4] .


Generalidad
Toda célula posee propiedades electrolíticas, reguladas por iones comunes al ambiente y la zona de su localización dentro del sistema homeostático.[5] La diferencia de potencial que aparece entre el medio y el interior celular se compensa por la precipitación de ciertas moléculas que se acoplan en la membrana plasmática. La interacción entre estas moléculas y la membrana tiene como efecto la emergencia de la propiedad denominada permeabilidad selectiva, creando una apertura llamada canal. Dependiendo de la molécula que se acople a ese receptor, junto con otras variables del medio, la célula recibirá un tipo de información concreta que le indicará el tipo de proteína a codificar. Este tipo de información se denomina señal de pervivencia.[6] Sin estas señales, un programa genético sano codificará la información que provocará la muerte celular.[7]
Transmisión de la señal en la sinapsis química


Las propiedades electrolíticas de la neurona vienen dadas por la existencia de calcio y sodio en el líquido cefalorraquídeo, solución que envuelve a todo el sistema nervioso central y que por ende pone en contacto la parte externa de la célula con el resto del sistema homeostático. El potasio se encuentra en el citoplasma y es el resultado de la actividad metabólica de la célula. El potasio forma iones positivos, mientras que el calcio y el sodio lo hacen de forma negativa con respecto al potasio.[8] Cuando un impulso presináptico alcanza el umbral mínimo de disparo, una gran cantidad de iones de calcio difunden a través de los canales de la membrana celular presináptica. Esto a su vez provoca un cambio de potencial entre el interior de la célula y el espacio sináptico, lo cual provoca que las vesículas sinápticas difundan a la membrana liberando moléculas en el espacio sináptico, denominadas neurotransmisores. En la membrana existen ciertas estructuras proteicas denominadas canales iónicos. La llave es la molécula que se acopla a ese receptor. Finalmente, la célula postsináptica recibirá un tipo de información concreta que le indicará el tipo de tarea metabólica a realizar. Según los mecanismos disparados por esta acción, pueden producirse cambios metabólicos y estructurales a corto o largo plazo, que modifiquen la fuerza de conexión de las dos neuronas.
Acción Ionotrópica
En rasgos generales, el efecto que se induce en el axón de la neurona como resultado de la despolarización de la membrana plasmática, se denomina potencial de acción, que recorre todo el axón hasta llegar a la vesícula presináptica; y la respuesta hiperpolarizante se denomina potencial sináptico.
Potencial Excitador Postsináptico (PEPS)
El potencial excitador postsináptico ocurre debido a un potencial de acción en la neurona presináptica, la cual libera neurotransmisores en el espacio sináptico. Estos se acoplan a los receptores iónicos, los cuales actúan como canales, modificando el gradiente electroquímico. Entonces el canal permite el paso de iones de sodio, haciendo más positivo el potencial de membrana, lo cual genera un impulso nervioso que se transmite a lo largo de la célula y del axón.
- El glutamato es un neurotransmisor que provoca la apertura de canales glutamatérgicos, los cuales solo permiten el paso de iones de sodio. Por ello, se clasifica al glutamato como neurotransmisor excitatorio.
Potencial Inhibidor PostSináptico (PIPS)
Contrariamente a los potenciales de acción, los potenciales sinápticos son de escasa amplitud y alcanzan tan solo algunos mV.
- El GABA, provoca la apertura de canales de cloruro, y estos se difunden hacia el espacio sináptico, provocando un disminución en el potencial sináptico y "apagando" la neurona.
Acción Metabotrópica
En las mismas condiciones iniciales que la interacción ionotrópica, la combinación de ciertos neurotransmisores con estos receptores (receptores metabotrópicos) activan unas enzimas presentes en la membrana y responsables de la formación de nuevas moléculas denominadas segundos mensajeros.
Dependiendo con cual se combinen, pueden manifestar dos propiedades distintas:[9]
- Pueden modificar la actividad de los receptores ionotrópicos, aumentando el tiempo de apertura de los canales, creados a partir de la interacción ionotrópica.
- Pueden 'movilizar' otros receptores ionotrópicos a una zona concreta de la membrana, aumentando de esa manera la probabilidad de éxito en la sinapsis neuronal.
Neurotransmisión primaria y secundaria
- La neurotransmisión primaria está regulada por los receptores ionotrópicos, que tienen la propiedad de volver a una neurona más o menos excitable.
- La neurotransmisión secundaria está regulada por los receptores metabotrópicos, que tienen la propiedad de interaccionar con los mismos neurotransmisores ya excitados, pero modifican la intensidad del estímulo o aumentan las probabilidades de éxito de los neurotransmisores.
La dinámica de la neurotransmisión primaria y secundaria da forma a la plasticidad neuronal y sináptica.
Integración de la información
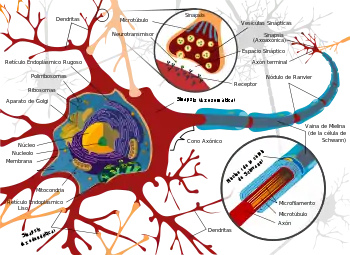
Es el proceso en cuya virtud las neuronas, gracias a las propiedades intrínsecas a su membrana, se hallan capacitadas para sumar distintas entradas excitadoras e inhibidoras y elaborar una respuesta en función de ellas.[10]
Una sola neurona puede integrar entre 10.000 y 15.000 conexiones, todas procedentes de otras neuronas y/o células gliales. Si todo el cerebro cuenta con 100.000 millones de neuronas promedio, el promedio de sinapsis existente en un cerebro humano es de una simple regla de tres, cuyo número deja de tener significado en la escala humana.[11] Un total de: 1.000 billones de sinapsis (100.000 millones de neuronas promedio por 10.000 conexiones), un uno seguido de quince ceros.
Según cuanto dure un impulso y cuanto se repita, en ciertos periodos de tiempo, las acciones combinadas de los primeros y segundos mensajeros tenderán a cambiar la estructura y facilidad de apertura de canales e inducirán (o no) cambios en el metabolismo y la estructura de la membrana celular. La proximidad entre dendritas y axones también depende de la frecuencia con la que la sinapsis se realice.
Las sinapsis que forman las dendritas y los axones no tienen una programación genética predeterminada, de hecho, el nivel de expresión de un gen dado puede estar determinado por las particularidades de la experiencia.[12] La disposición genética predispone ciertas tendencias a la interconexión.[13] Se puede decir que la genética nos predispone para adaptarnos a la dinámica determinista del medio.[14]
Durante la maduración del feto, las células nerviosas experimentan la misma dinámica plástica basada en la neurotransmisión primaria y secundaria ya descrita, no obstante, al ir madurando aquellas partes de la red que dependen de factores internos principalmente repetitivos (latidos del corazón, respiración, temperatura del cuerpo, etc.) estas redes establecen enlaces desde el feto, conectando los órganos según van estimulando la red nerviosa de la cual dependen, haciendo perdurable dicha conexión por estos ciclos.[cita requerida]
Suma espacial

Supongamos que, de entre las 10.000 sinapsis posibles, 3.000 están recibiendo señales de excitación y otras tantas de inhibición. La suma espacial es el proceso que hace la neurona al elaborar todas esas señales en un mismo ciclo de proceso y producir una respuesta, tanto a niveles de potencial de acción como de metabolización de proteínas, neurotransmisores o cualquier otra molécula capaz de portar información.[15]
Suma temporal
Partiendo del mismo supuesto que en el caso de la suma espacial, tomamos como ejemplo una dendrita, en donde se establece sinapsis con una terminación axónica de una neurona. Dicha neurona produce una ráfaga de estímulos muy seguidos en el tiempo, los cuales la neurona que los recibe ha de sumarlos en el tiempo, aplicando un proceso mediante el cual la neurona establece un resultado a ese estímulo.[15]
Aprendizaje y memoria
Los potenciales sinápticos duran entre milisegundos y segundos (el tiempo suficiente para ejercer un efecto transitorio sobre la excitabilidad de las células postsinápticas) pero en realidad son efímeros. Si las sinapsis están comprometidas en los cambios de conductas a largo plazo relacionados con el aprendizaje y la memoria las neuronas deben demostrar modificaciones en la eficacia sináptica (plasticidad sináptica) que deben durar varios minutos, días o semanas. La eficacia sináptica suele reflejarse en un cambio en la amplitud del potencial postsináptico en respuesta a un potencial de acción presináptico.[16]
En muchas sinapsis, las amplitudes de los potenciales postsinápticos individuales no son constantes. La facilitación sináptica es un aumento de la amplitud de los potenciales postsinápticos en respuesta a impulsos presinápticos sucesivos. La disminución de la amplitud de los potenciales postsinápticos en respuesta a impulsos presinápticos sucesivos se denomina antifacilitación sináptica o depresión sináptica. Tanto la facilitación como la antifacilitación sinápticas se producen como resultado de cambios en la cantidad de neurotransmisor liberado por cada impulso presináptico.[17]
Modelos de aprendizaje en invertebrados
Habituación y sensibilización sináptica

El aprendizaje, capacidad de modificar el comportamiento en respuesta a una experiencia, y la memoria, capacidad de almacenar dicha modificación por un período, son los rasgos más sobresalientes de los procesos mentales de los animales superiores. Sin embargo, estas propiedades están presentes en sistemas nerviosos más simples, como en Aplysia, un caracol marino que retrae la branquia cuando se le aplica un estímulo en el sifón o en el lóbulo del manto. La amplitud de esta respuesta disminuye en presencia de una estimulación repetida de baja frecuencia; esto implica que la respuesta se habitúa. Después de un golpe en la cola, la respuesta a la estimulación del sifón vuelve a aumentar; o sea, se sensibiliza por el golpe en la cola.[18] Con un acoplamiento repetido de los estímulos en la cola y en el sifón, es posible alterar este comportamiento durante días o semanas, lo que demuestra una forma simple de memoria a largo plazo.
Kandel y Tauc, mapearon el circuito nervioso del reflejo de retirada de la aleta y determinaron el locus sináptico de la habituación y de la sensibilizacón. Entre las neuronas críticas se incluyen las mecanosensitivas que inervan la piel del sifón, las motoras que inervan los músculos de la aleta, y las interneuronas que reciben aferencias de distintas neuronas sensitivas.[19]
La habituación de la respuesta de retirada de la aleta podría producirse en: 1) las terminaciones nerviosas sensitivas de la piel del sifón, haciéndolas más sensibles al tacto; 2) el músculo de la aleta, haciéndolo menos sensible a la estimulación sináptica por la motoneurona, o 3) la sinapsis entre la neurona sensitiva y la motoneurona.
La primera posibilidad se descartó obteniendo registros con microelectrodos de la neurona sensitiva cuando se producía la habituación. Esta neurona seguía produciendo potenciales de acción en respuesta a la estimulación de la piel. Igualmente se descartó la segunda posibilidad mediante la estimulación eléctrica de la motoneurona y mostrando que siempre provocaba la misma contracción muscular. Esto dejaba solo la tercera posibilidad: la habituación se produce en la sinapsis que conecta el estímulo sensitivo con la motoneurona.[20] En la habituación la transmisión en la sinapsis glutamatérgica entre las neuronas sensitivas y motoras está disminuida. Se cree que este debilitamiento en la transmisión sináptica, denominado depresión sináptica, es el responsable de disminuir la capacidad de los estímulos sobre el sifón para evocar contracciones de la aleta durante la habituación. Más adelante, se demostró que la depresión sináptica se debe a una reducción en la cantidad de vesículas sinápticas disponibles para la liberación, con una reducción simultánea en la cantidad de glutamato liberado en la neurona sensitiva presináptica. La sensibilización, por el contrario, modifica la función de este circuito al reclutar neuronas adicionales. El choque en la cola que evoca la sensibilización, activa neuronas sensitivas que inervan a la cola. Por su parte, estas neuronas sensitivas excitan interneuronas que liberan serotonina en las terminaciones presinápticas de las neuronas sensitivas del sifón. La serotonina aumenta la liberación del transmisor desde las terminaciones neuronales sensitivas del sifón, lo que conduce a un incremento de la excitación sináptica de las neuronas motoras. Esta modulación de la sinapsis neurona sensitiva- neurona motora dura alrededor de una hora, lo que es similar a la duración de la sensibilización a corto plazo de la retirada de la aleta producida por la aplicación de un solo estímulo en la cola. Así aparentemente la sensibilización a corto plazo se debe al reclutamiento de los elementos sinápticos adicionales que modulan la transmisión sináptica en el circuito de retirada de la aleta.
Transmisión glutamatérgica durante la sensibilización a corto plazo

- PASO 1: La serotonina liberada por las interneuronas se une a receptores acoplados a la proteína G sobre las terminaciones presinápticas de las neuronas sensitivas del sifón.
- PASO 2: estimulación de la producción de segundo mensajero (AMPc)
- PASO 3: el AMPc se une a las subunidades reguladoras de la proteína kinasa A (PKA) y las subunidades catalíticas de la PKA fosforila a varias proteínas.
- PASO 4: una de estas proteínas es un canal potasio cuya fosforilación hace que se cierre.
- PASO 5: el cierre de los canales de potasio en la terminación axónica produce una prolongación del potencial de acción presináptico.
- PASO 6: una mayor entrada de calcio a través de canales de calcio regulados por voltaje hace que se libere más cuantos de neutransmisor.
Transmisión glutamatérgica durante la sensibilización prolongada

La duración prolongada de esta forma de plasticidad se debe a cambios en la expresión genética, y por lo tanto de la síntesis proteica. Con un entrenamiento repetido (choques adicionales en la cola), la PKA fosforila y estimula al activador transcripcional CREB y este a su vez estimula la síntesis de la Ubiquitina hidroxilasa, que degrada la subunidad reguladora de la PKA, produciendo un aumento persistente en la cantidad de subunidad catalítica libre, lo que significa que cierta cantidad de PKA está continuamente activa y no requiere serotonina para activarse.
El CREB también estimula otra proteína activadora de la transcripción, denominada C/EBP. Esta estimula la transcripción de otros genes desconocidos que producen el agregado de terminaciones sinápticas, lo que genera un aumento prolongado de la cantidad de sinapsis entre las neuronas sensitivas y motoras. Estos incrementos estructurales no se observan en la sensibilización a largo plazo y pueden ser la causa final del cambio prolongado en la fuerza global de las conexiones relevantes del circuito que producen un refuerzo prolongado en la respuesta de la retirada de la aleta.[21]
Plasticidad sináptica a corto plazo en vertebrados
Lo más probable es que todas las sinapsis químicas son capaces de sufrir cambios plásticos. Los mecanismos de la plasticidad sináptica en la sinapsis de los mamíferos se desarrollan en escalas temporales que varían desde los milisegundos hasta días, semanas o más. Las formas de plasticidad a corto plazo (duran minutos o menos) se han estudiado con más detalle en las sinapsis musculares periféricas.
Incluso el cerebro humano adulto es notablemente dinámico, plástico y reconfigurable, una propuesta que en 1995 hubiera sorprendido a la mayoría de los neurocientíficos, ahora está respaldada por una abrumadora cantidad de evidencia.[22]
La activación repetida de la unión neuromuscular desencadena varios cambios que varían en dirección y duración. La facilitación sináptica, que es un aumento transitorio de la fuerza sináptica, se desarrolla cuando dos potenciales de acción o más invaden la terminación presináptica sucesivamente. La facilitación conduce a que se libere más neurotransmisor con cada potencial de acción sucesivo, aumentando progresivamente el potencial de membrana terminal postsináptico. La facilitación es el resultado de la elevación prolongada de calcio en la terminación presináptica. El ingreso de calcio se desarrolla en uno o dos milisegundos después del potencial de acción pero el retorno del calcio hasta los niveles de reposo son mucho más lentos. Por lo tanto, cuando los potenciales de acción aparecen juntos tienden a aumentar el calcio dentro de la terminación y en consecuencia el potencial de acción presináptico ulterior libera más neurotransmisor. Una descarga de alta frecuencia de potenciales de acción presinápticos (tétanos) puede conducir a una elevación incluso más prolongada de los niveles de calcio presinápticos, lo que produce otra forma de plasticidad sináptica denominada potenciación postetánica (PPT). La PPT se demora en su inicio y en los casos típicos aumenta la liberación del neurotransmisor hasta algunos minutos después de que finalizó la sucesión de estímulos. La diferencia de duración distingue la PPT de la facilitación sináptica. También se cree que la PPT surge de procesos dependientes del calcio, que tal vez comprendan la activación de proteínas cinasas presinápticas, que aumentan la capacidad de los iones entrantes de calcio para desencadenar la fusión de las vesículas sinápticas con la membrana plasmática.
La transmisión sináptica también puede disminuirse luego de la actividad sináptica repetida. Esta depresión sináptica se desarrolla cuando se presentan muchos potenciales de acción presinápticos en rápida sucesión, y depende de la cantidad de neurotransmisor que se liberó. La depresión surge por la depleción progresiva del pool (reserva) de vesículas sinápticas disponibles para la fusión en esta circunstancia. Durante la depresión sináptica, la fuerza de la sinapsis declina hasta que este pool puede recuperarse mediante los mecanismos involucrados el reciclado de las vesículas sinápticas.
Plasticidad sináptica a largo plazo en vertebrados
La facilitación, la depresión y la potenciación postetánica pueden modificar brevemente la transmisión sináptica pero no pueden proporcionar las bases para las memorias u otras manifestaciones de plasticidad conductual que persisten durante meses, semanas o años. Algunos patrones de actividad sináptica en el sistema nervioso central producen un aumento prolongado en la fuerza sináptica conocido como potenciación a largo plazo (PLP), mientras que otros patrones de actividad generan una disminución prolongada de la fuerza sináptica, conocida como depresión a largo plazo (DLP).[23]
Potenciación a largo plazo de la sinapsis del hipocampo
El hipocampo es un área del encéfalo especialmente importante para la formación y la recuperación de algunas formas de memoria.
Una aferencia importante al hipocampo es la corteza entorrinal. Esta corteza manda información al hipocampo a través de un haz de axones denominado vía perforante; estos axones establecen sinapsis con neuronas de la circunvolución dentada, que emiten axones (denominados fibras musgosas) que hacen sinapsis con células de CA3. Estas células emiten axones que se ramifican. Una de las ramas deja el hipocampo a través del fórnix; la otra rama, llamada colateral de Schaffer, establece sinapsis con neuronas de CA1. Aunque la PLP se demostró por primera vez en la sinapsis de la vía perforante con las neuronas de la circunvolución dentanda, la mayoría de los experimentos sobre el mecanismo de la PLP se realizan actualmente con las sinapsis de la colateral de Schaffer y las neuronas piramidales de CA1.[24] La estimulación eléctrica de las colaterales de Schaffer genera potenciales postsinápticos excitadores (PPSE) en las células postsinápticas CA1. Si se estimulan las colaterales de Schaffer solo dos o tres veces por minuto, el tamaño de PPSE en las neuronas de CA1 se mantiene constante. Sin embargo, una sucesión breve y de alta frecuencia de estímulos (estimulación tetánica) en los mismos axones produce una potenciación a largo plazo, lo que se observa como un aumento prolongado en la amplitud de los PPSE.
Mecanismos moleculares de la potenciación a largo plazo en el hipocampo
La transmisión sináptica excitadora en el hipocampo está mediada por receptores de glutamato. La PLP en la vía colateral de Schaffer requiere la activación del receptor de glutamato tipo NMDA, este se vuelve funcional cuando el glutamato se une al receptor postsináptico NMDA y el potencial de membrana de la célula postsináptica está lo bastante despolarizado por la descarga cooperativa de varios axones aferentes como para expulsar el Mg2+ del canal NMDA, dado que el bloqueo del canal NMDA por el Mg2+ es dependiente de voltaje. Solo cuando el Mg2+ se elimina puede entrar Ca2+ en la célula postsináptica. La entrada de calcio inicia la facilitación persistente de la transmisión sináptica activando proteincinasas: la proteincinasa C (PKC), la proteincinasa Ca2+/dependiente de calmodulina (CaMKII), y protincinasa de tirosina fyn.[25]
Depresión sináptica a largo plazo en el hipocampo y en el cerebelo.
Para convertir el reforzamiento sináptico en un mecanismo útil son necesarios otros procesos que puedan debilitar de manera selectiva conjuntos específicos de sinapsis. La DPL es uno de estos procesos. A finales de la década de 1970, se observó que se desarrollaba una DPL en las sinapsis entre las colaterales de Schaffer y las células piramidales CA1. La DLP se desarrolla cuando las colaterales de Schaffer se estimulan a baja frecuencia (1 Hz aproximadamente) durante periodos prolongados (10-15 minutos). Este patrón de actividad disminuye el PPSE durante varias horas, y al igual que la PLP, es específico de las sinapsis activadas.
La PLP y la DPL son complementarias ya que la DPL puede borrar el incremento en el tamaño del PPSE producido por la PLP y por el contrario, esta última puede borrar la disminución en el tamaño de los PPSE debido a la DPL.
La potenciación y la depresión a largo plazo en las sinapsis colaterales de Schaffer- CA1 tienen varios elementos en común. Ambas necesitan la activación de receptores de glutamato NMDA y la entrada de calcio en la célula postsináptica. Lo que determina que se produzca una PLP o una DPL es la cantidad de calcio en la célula postsináptica: pequeños aumentos en el Ca2+ desencadenan depresión, mientras que los grandes incrementos conducen a potenciación.
Depresión a largo plazo en la corteza cerebelosa.
El cerebelo es importante para el aprendizaje motor, porque en él se realizan las correcciones cuando el resultado de los movimientos no cumple las expectativas. Parece que estas correcciones se realizan por modificaciones de las conexiones sinápticas.
La DLP en el cerebelo es algo diferente. La corteza cerebelosa consta de dos capas de cuerpos celulares neuronales, la capa de células de Purkinje y la capa de células granulares, separadas de la superficie de la piamadre por una capa de molecular desprovista prácticamente de cuerpos celulares.[26] Las neuronas de Purkinje del cerebro reciben dos tipos de aferencias excitadoras: fibras trepadoras y paralelas. La DLP reduce la fuerza de la transmisión en la sinapsis de las fibras paralelas y de las fibras trepadoras. Esta forma de depresión a largo plazo ha sido relacionada con el aprendizaje motor que media la coordinación, la adquisición y el almacenamiento de movimientos complejos en el interior del cerebelo.
Potenciación a largo plazo, depresión a largo plazo y memoria.
Estudios teóricos muestran que la PLP y DLP pueden contribuir a la formación de la memoria, ya que las moléculas que intervienen en la PLP y DLP también lo hacen en el aprendizaje y la memoria, por ejemplo, ambas formas de plasticidad sináptica necesitan la activación de receptores de NMDA, para valorar el posible papel de los receptores NMDA del hipocampo en el aprendizaje, los investigadores inyectaron un bloqueante de dichos receptores en el hipocampo de ratas que estaban siendo entrenadas en un laberinto acuático. A diferencia de los animales normales, estas ratas no lograban aprender las reglas del juego ni la localización de la plataforma para escapar. Este hallazgo proporcionó la primera prueba de que los procesos dependientes de los receptores NMDA desempeñan un papel en la memoria. Un nuevo y revolucionario enfoque de la base molecular del aprendizaje y la memoria fue presentado por Susumu Tonegawa. Este reconoció que moléculas y comportamiento debían estar conectados mediante manipulación génica de animales de experimentación. En su primer experimento Tonegawa y Cols. “eliminaron” el gen para una subunidad (alfa) de CaMKII y observaron deficiencias paralelas en la memoria y la PLP del hipocampo. Desde entonces se han manipulado muchos genes de ratones con la intención de valorar el papel de los mecanismos de la PLP y DLP en el aprendizaje. Aunque los investigadores no se pronuncian, parece que la PLP, la DLP y el aprendizaje tienen muchas necesidades en común.
El enfoque genético es poderoso, pero tiene limitaciones importantes. La pérdida de una función, como PLP o el aprendizaje, podría ser una consecuencia secundaria de alteraciones del desarrollo causadas por el crecimiento sin una determinada proteína. Además, como la proteína sed ha perdido en todas las células que normalmente la expresan, puede ser difícil precisar dónde y cómo una molécula contribuye al aprendizaje. Por estas razones, los investigadores han tratado de idear formas de limitar sus manipulaciones genéticas a localizaciones y momentos específicos. En un interesante ejemplo de este enfoque Tonegawa encontraron una manera de limitar la deleción genética de receptores de NMDA a la región CA1, empezando a la edad de tres semanas aproximadamente. Estos animales muestran u llamativo déficit de PLP, DLP y rendimiento en el laberinto acuático, con lo que se revela que los receptores de NMDA de CA1 desempeñan un papel esencial en ese tipo de aprendizaje. Si una activación demasiado escasa de los receptores de NMDA del hipocampo es perjudicial para el aprendizaje y la memoria, los animales tratados con ingeniería genética para producir demasiados receptores NMDA muestran un aumento de la capacidad para aprender algunas tareas. En conjunto, los estudios farmacológicos y genéticos muestran que los receptores NMDA del hipocampo desempeñan un papel esencial no solo en la modificación sináptica, como PLP y DLP, sino también en el aprendizaje y la memoria.[27]
Neurodegeneración
Durante la maduración se produce un proceso que implica la degeneración progresiva y/o la muerte de las neuronas. Este proceso, que puede ser normal y natural durante el envejecimiento normal, involucra a las células fundamentales del tejido nervioso y a sus componentes internos, que son los que impiden efectividad en la conducción de información en el cerebro humano, con la consecuente disminución de las funciones cognitivas. Así, durante el envejecimiento normal se limitan funciones cerebrales en la zona afectada pero también pueden aparecer distintas patologías neurológicas en el ser humano, llamadas enfermedades neurodegenerativas.[28][29][30]
Bibliografía
- Morris, R.G.M. et al., the role of activity dependents synaptic plasticity in memory", Phil. Trans. R. Soc. Lond. B, N.º 358, 2003, pp. 773-786.
- Kandel, E.R., Psychotherapy and the single synapse: the impact of psychiatric thought on neurobiological research, J.Neuropsychiatry Clin. Neurosci, 13: 2, 2001, pp. 290-300.
- François Ansermet & Pierre Magistretti: A cada cual su cerebro. Plasticidad neuronal e inconsciente. Discusiones. pp. 47.
- Blake, D.T., Byl, N.N., Mercenich, M., Representation of the hand in the cerebral cortex, Behavioral Brain Research, Nº135, 2002, pp. 179-184.
- Mechanisms and genes of cellular suicide. H Steller Science 10 March 1995 267: 1445-1449 (DOI: 10.1126/science.7878463)
- From AIDS to Parasite Infection: Pathogen-mediated Subversion of Programed Cell Death as a Mechanism for Inmune Dysregulation. J.-C-. Ameisen, J. estaquier y T. Idziorek en Immunological Reviews, vol. 142, pags. 9-51, 1994
- Apopotosis in a Unicellular Eukaryote, J.-C. Ameisen et al. en Cell Death and Differentiation, vol.2, pags. 185-300, 1995.
- Bliss, T.V., Collingridge, G.L., Morris, R. G. M., Long-term potentiation: enhancing neyrosciencie for 30 years, philosophical Transaction of the Royal Society, N.º 1432, 2003
- François Ansermet & Pierre Magistretti: A cada cual su cerebro. Plasticidad neuronal e inconsciente. Discusiones. pp. 35-43.
- Dinamic Signaling between Astrocytes and neurons. A. Araque, G. Carmignoto, P. G. Haydon en annual Review of physiology, vol. 63, pags. 795-813; 2001
- Bear, M. F., Connors, B. W., Paradiso, M. A., Neuroscience, exploring the brain 2ª ed., Baltimore, Lippincott Williams & Wilkins, 2001.
- Kandell, E.R., The molecular biology of memory storage: a dialogue between genes and synapses, Science, N.º 294, 2001, pp. 1030-1038
- Cheung, V.G., Spielman, R. S., The genetics of variation in gene expression, Nature Genetics Supplement, N.º 32, 2002, pp. 522-525
- François Ansermet & Pierre Magistretti: A cada cual su cerebro. Plasticidad neuronal e inconsciente. Discusiones. pp. 26.
- Por citar
- Hill, Wyse, Anderson: Fisiología Animal. pp.395.
- Hill, Wyse, Anderson: Fisiología animal. pp.395.
- Hill, Wyse, Anderson: Fisiología animal. pp.395-396.
- Purves, Augustine, Fitzpatrick, Hall, LaMantia, Williams: Neurociencia.pp.641.
- Mark F. Bear, Barry Connors, Michael Paradiso: Neurociencia, la exploración del cerebropp.766.
- Purves, Augustine, Fitzpatrick, Hall, LaMantia, Williams: Neurociencia.pp642-643.
- Vukovic N., Hansen B., Lund T.E., Jespersen S., Shtyrov Y. (2021). «Rapid microstructural plasticity in the cortical semantic network following a short language learning session.». PLoS Biology 19 (6): e3001290. doi:10.1371/journal.pbio.3001290. Consultado el 14 de junio de 2021.
- Purves, Augustine, Fitzpatrick, Hall, LaMantia, Williams: Neurociencia.pp647.
- Mark F. Bear, Barry Connors, Michael Paradiso: Neurociencia, la exploración del cerebropp.777-778
- Purves, Augustine, Fitzpatrick, Hall, LaMantia, Williams: Neurociencia.pp654.
- Mark F. Bear, Barry Connors, Michael Paradiso: Neurociencia, la exploración del cerebropp.772
- Mark F. Bear, Barry Connors, Michael Paradiso: Neurociencia, la exploración del cerebropp.784,785,786
- «Neurodegeneración y Envejecimiento». Instituto de Investigaciones Biomédicas de Barcelona www.iibb.csic.es. Consultado el 25 de junio de 2020.
- «Asociación entre neuroinflamación, neurodegeneración y depresión». www.intramed.net. Consultado el 25 de junio de 2020.
- Meza, Mónica Navarro; Ceballos, Juan Luis Orozco (30 de abril de 2015). Cuidado y alimentación en la neurodegeneración, Alzheimer y Parkinson: Información básica. Editorial Universitaria - Universidad de Guadalajara. ISBN 978-607-742-180-1. Consultado el 25 de junio de 2020.
Otras fuentes consultadas
- Françoise Ansermet & Pierre Magistretti. A cada cual su cerebro. Plasticidad neuronal e inconsciente Discusiones. Primera edición: 2006 ISBN 84-935187-0-0
- Neuroglia e interacción nerviosa
Véase también
Enlaces externos
- . Puedes profundizar más en el concepto de plasticidad neural en la página de Aportaciones desde las Neurociencias a la intervención en Atención Temprana y discapacidad.
- . Video sin comentarios, solo música e imágenes con letras. Es una mezcla de varios videos relacionados con la sinapsis neuronal.
- . Sinopsis del libro de Norman Doidge: The Brain That Changes Itself, análisis de casos clínicos y terapias de neuroplasticidad aplicada.