Celulasa
Las celulasas son un grupo de enzimas complejas especializadas en catalizar la celulólisis, es decir, en descomponer celulosa y otros polisacáridos relacionados, en múltiples monómeros de glucosa. Ésta es producida con leves diferencias químicas por los integrantes del reino de los hongos y el de las bacterias, los cuales son los mayores descomponedores del planeta.
| Celulasa | ||||
|---|---|---|---|---|
 Una enzima celulasa producida por Thermomonospora fusca , con celotriosa unida en el surco poco profundo del dominio catalítico | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 3.2.1.4 | |||
| Número CAS | 9012-54-8 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Las celulasas descomponen la molécula de celulosa en monosacáridos (azúcares simples) como la β-glucosa o en polisacáridos y oligosacáridos más cortos. La ruptura de la celulosa es de importancia económica debido a que dicha molécula es un componente mayor de las plantas disponibles para consumo y uso en reacciones químicas. La reacción específica involucrada es la hidrólisis de enlaces 1,4 β- D-glucosídicos de la celulosa principalmente, pero también de la hemicelulosa, liquenina y de los β -D-glucanos de cereales. Debido a que las moléculas de celulosa se encuentran enlazadas fuertemente, la celulólisis es relativamente difícil en comparación a la ruptura de otros polisacáridos como el almidón.[1]
La mayoría de los mamíferos poseen una habilidad limitada para digerir fibras dietéticas como la celulosa por sí mismos. En la mayoría de los animales herbívoros como los rumiantes y los animales que presentan fermentación en el intestino grueso, las celulasas son producidas por bacterias simbióticas. Las celulasas endógenas son producidas por algunos pocos tipos de metazoarios como las termitas,[2][3][4] caracoles y gusanos de tierra. Además de los rumiantes, la mayoría de los animales incluyendo a los humanos, no producen celulasa en sus cuerpos y únicamente pueden degradar parcialmente la celulosa a través de la fermentación, limitando su habilidad de obtener nutrientes de las plantas.
Recientemente, las celulasas se han encontrado en microalgas verdes (Chlamydomonas reinhardtii, Gonium pectorale y Volvox carteri). Sus dominios catalíticos (CD) pertenecientes a la familia GH9 (familia 9 de las glicosil hidrolasas) o EC 3.2.1, muestran la mayor similitud a las celulasas endógenas de los metazoos.[5]
Se conocen diversos tipos de celulasas que difieren en su estructura y en su mecanismo de acción. Enzimas sinónimas, derivadas y específicas asociadas con el nombre "celulasa" son la endo-1,4-beta-D-glucanasa, carboxilmetil celulasa, avicelasa, celudextrinasa, celulasa A, celulosin AP, celulasa básica, celulasa A 3, celulasa 9.5 y pancelasa SS. Las enzimas que separan la lignina también han sido llamadas celulasas, aunque esta denominación es obsoleta y ahora son nombradas enzimas ligninolíticas.[6]
Tipos de celulasas y acción
Existen cinco tipos de celulasas clasificadas según el tipo de reacción que catalizan:
- Endocelulasas (EC 3.2.1.4): se encargan de romper las interacciones no covalentes en las estructuras amorfas de la celulosa para crear cadenas lineales.
- Exocelulasas (EC 3.2.1.91): también llamadas celobiohidrolasas, se encargan de hidrolizar los extremos de las cadenas producidas por la endocelulasas en segmentos de 2 a 4 unidades como la celobiosa; éstas a su vez se clasifican entre las tipo I, que hidrolizan el extremo reductor de la cadena y las tipo II, que hidrolizan el extremo no reductor de la molécula.[7]
- Celobiasas (EC3.2.1.21): también llamadas β-glucosidasas, se encargan de separar los disacáridos o tetrasacáridos que se forman por la enzima anterior.[8]
- Celulasas oxidativas: despolimerizan la celulosa mediante reacciones de radicales libres. Un ejemplo de esto es la celobiosa deshidrogenasa.[9]
- Celulosa fosforilasas: despolimerizan la celulosa utilizando grupos fosfato en vez de agua.
Dentro de los tipos de celulosa mencionados arriba, también se encuentran los tipos progresivos (o procesivos) y no progresivos. Las celulasas progresivas continuarán interactuando con la misma cadena de polisacárido mientras que la celulasa no progresiva interactuará una sola vez y luego se anclará en otra cadena.
La acción de la celulosa se considera sinérgica debido a que las tres primeras clases de celulasa producen en conjunto mucho más monosacáridos que la suma de las tres por separado.
Estructura
La mayoría de las celulasas fúngicas poseen una estructura de dos dominios, uno catalítico y uno de unión con la celulosa, que están conectados por una unión flexible. Esta estructura está adaptada para trabajar en un sustrato insoluble y permite que la enzima se difunda sobre la superficie de manera similar a una oruga. Sin embargo, también existen celulasas (como las endoglucanasas) que no poseen dominios de unión.
Ambos tipos de dominios dependen de la estructura tridimensional de la enzima que surge como consecuencia del nivel de plegamiento de la proteína. La secuencia de aminoácidos, el acomodo de los residuos cercanos al sitio activo y la posición en la que se enlaza el sustrato pueden influenciar la afinidad por el ligando, la estabilización del sustrato en el sitio activo y la efectividad de la catálisis. La estructura del sustrato es complementaria al sitio activo de la enzima. Cambios en la posición de los residuos pueden resultar en la distorsión de una o más interacciones.[10] Factores adicionales como la temperatura, el pH y la presencia de iones metálicos modifican las interacciones no covalentes en la estructura enzimática.[11] Las especies de Thermotoga maritima crean celulasas que consisten en dos hojas plegadas beta que rodean una región catalítica central que es el sitio activo.[12] La enzima se categoriza como una endoglucanasa que separa internamente los enlaces β-1,4-glicosídicos en las cadenas e celulosa, facilitando su degradación. Diferentes especies en la misma familia de las T. maritima crean celulasas con diferentes estructuras.[12] Las celulasas producidas por la especie Coprinopsis cinerea consisten de 7 hebras de proteína en la forma de un túnel cerrado llamado barril alfa/beta.[13] Estas enzimas hidrolizan el sustrato carboximetil celulosa. El enlace del sustrato con el sitio activo induce un cambio en la conformación que permite la degradación de la molécula.
Complejos de celulasa
En diversas bacterias, las celulasas in-vivo son complejas estructuras enzimáticas organizadas en complejos supramoleculares llamadas celulosomas. Estos pueden contener, aunque no están limitados a, cinco diferentes subunidades enzimáticas llamadas representativamente endocelulasas, exocelulasas, celobiasas, celulasas oxidativas y celulosa fosforilasas, aunque sólo las exocelulasas y celobiasas participan en la hidrólisis del enlace β(1→4). El número de subunidades que forman los celulosomas puede determinar la velocidad de la actividad enzimática.[14]
Las celulasas multidominio se presentan ampliamente a través de varios grupos taxonómicos, sin embargo, las celulasas de bacterias anaeróbicas, encontradas en celulosomas, poseen la más compleja arquitectura consistente en diferentes módulos. Por ejemplo, la especie Clostridium cellulolyticum produce celulasas 13 GH9 modulares, que contienen un diferente número y arreglo del dominio catalítico, del módulo de unión con el carbohidrato, del dominio de anclaje, de enlace, etc.[15]
Las celulasas multimodulares son más eficientes que la enzima libre (con sólo módulos de dominio catalítico) debido a un efecto sinérgico; debido a la proximidad entre la enzima y el sustrato celulósico. Los dominios de unión con el carbohidrato (CBM) están involucrados en el enlace con la celulosa, donde los enlazantes glicosilados proveen flexibilidad al dominio catalítico para mayor actividad y protección proteica, así como una mejor unión con la superficie de la celulosa.[5]
Mecanismo de la celulólisis

- Mecanismo de acción
El proceso por el cual tales enzimas degradan la celulosa se puede resumir en tres pasos: La β -1,4-gluconasa actúa aleatoriamente sobre los enlaces glucosídicos β-1,4 entre las unidades de glucosa que forman la molécula de celulosa mediante la conversión de cadenas largas en oligosacáridos. Dicha enzima actúa sobre regiones de celulosa amorfa y, como resultado, disminuye la longitud de las cadenas de celulosa y se crean nuevos extremos reactivos que servirán como sustrato para reacciones posteriores.
La segunda etapa involucra la enzima β-1,4-glucanasa, que corta la cadena de 1,4-β-D-glucano del extremo no reductor de la molécula de celulosa o de las moléculas de celodextrinas (cadenas más cortas de celulosa) y que causa la eliminación de unidades de celobiosa (dímero) o glucosa (monómero). La celobiosa es un inhibidor de la hidrólisis enzimática llevada a cabo por endoglucanasas y exoglucanasa, reduciendo su eficacia.
Finalmente en la última etapa, se produce la degradación de la celobiosa a glucosa por la acción de la β-1,4-glucosidasa.
Los dos mecanismos de acción de la celobiasa[16] son tan sencillos como elegantes, pues implican únicamente reacciones ácido-base y sustituciones nucleofílicas. En el sitio activo se encuentran 2 aminoácidos, un ácido general que dona protones y una base como el aspartato o el glutamato. Existen 2 vías de acción: una que retiene la configuración del carbono anomérico y otra que la invierte; la vía que se lleve a cabo depende de la distancia entre los aminoácidos antes mencionados; si la distancia es próxima a los 5.5 Å el mecanismo que se lleva a cabo es el que retiene la configuración, mientras que si la distancia es cercana a los 10 Å, se lleva a cabo el mecanismo de inversión de la configuración.
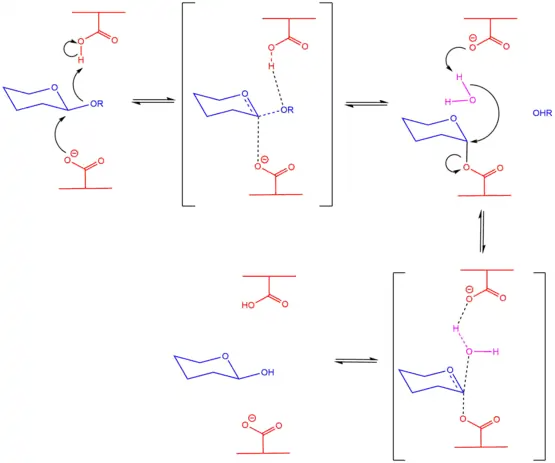
El mecanismo de inversión de la configuración sucede en una sola etapa, similar, en esencia, a una sustitución nucleofílica bimolecular SN2. Debido a la mayor distancia entre los aminoácidos, se puede acomodar una molécula de agua en el sitio contrario al enlace β-glucosídico, el cual coincide con el aminoácido básico. En una reacción concertada (simultánea), el aminoácido básico retira un protón de la molécula de agua, la cual a su vez, forma un enlace con el carbono anomérico de la glucosa, sustituyendo el enlace glucosídico que ya tenía formado con el siguiente sacárido. Este último residuo desplazado desprotona al aminoácido protonado de la enzima, también de manera concertada, formando como productos un residuo de glucosa (el que originalmente era no reductor) con la configuración anomérica invertida, un residuo de glucosa cuya configuración permanece igual y una enzima cuyo sitio activo permanece equivalente, aunque invertido, pues en total, un aminoácido se protona y otro se desprotona.
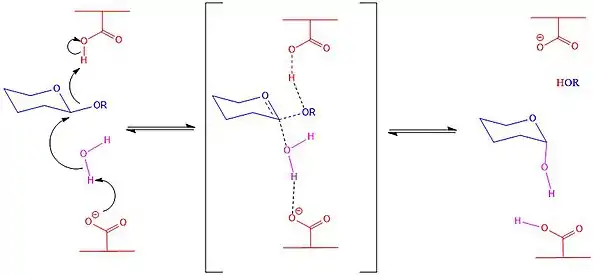
El mecanismo de retención de la configuración[17] sucede en dos etapas, en la primera, el aminoácido básico realiza un ataque nucleofílico al carbono anomérico, rompiendo el enlace glucosídico y generando un nuevo enlace con la enzima y una inversión temporal de la configuración. El monosacárido desplazado en forma de alcóxido desprotona al aminoácido protonado y se retira de la reacción. El aminoácido desprotonado ahora funciona como una base que desprotona una molécula de agua, la cual ataca al carbono anomérico rompiendo el enlace formado con la enzima y retornando la configuración anomérica original, así como regresando la enzima exactamente a como se encontraba al inicio de la reacción.
La degradación de la celulosa por las bacterias anaeróbicas tiene un mecanismo de acción ligeramente diferente en su lugar. Los celulosomas, localizados en la superficie, median en la adherencia de las enzimas a la superficie del sustrato, lo que conduce a una reorganización supramolecular, que redistribuye las subunidades de celulosa de manera que interactúen con los diferentes sustratos de referencia. Las enzimas celulares básicas y aplicadas, como las celulasas, han demostrado su importancia y su potencial biotecnológico en muchas industrias y sectores.Salvo contadas excepciones —como el insecto pececillo de plata (Lepisma saccharina), algunas especies de termitas de la familia Termitidae y el molusco bivalvo Teredo navalis— los animales no producen celulasa y para digerir más eficientemente las plantas requieren de la actividad de microorganismos en sus estomágos o intestinos; de tal modo que los animales herbívoros desarrollan "pequeñas cámaras fermentativas" en sus tractos digestivos. La mayoría de los mamíferos herbívoros la ha desarrollado en el ciego del intestino grueso y los rumiantes en un estómago modificado conocido como "Rumen".
Usos
La celulasa es utilizada con propósitos comerciales para el procesamiento de las semillas de café[18] pues sirve para romper los enlaces de la molécula que forma el mucílago o baba de café, reduciendo su viscosidad y facilitando su desecado. También es utilizada en la industria textil para realizar terminados especiales en telas de algodón o como agregado para detergentes para brindar brillo al color de las telas.[19]
En la medicina, la celulasa es utilizada como un tratamiento para fitobezoares, una forma de bezoar de celulosa que se puede encontrar en estómagos humanos. La enzima también ha demostrado una alta eficacia en la degradación de los biofilms de las bacterias polimicrobianas, al hidrolizar los enlaces β-1,4-glucosídicos en la matriz estructural de exopolisacáridos en la sustancia polimérica extracelular (EPS).[20][21]
Referencias
- Barkalow, David G.; Whistler, Roy L. (2019). «Cellulose». Access Science (en inglés). doi:10.1036/1097-8542.118200. Consultado el 14 de octubre de 2020.
- Bignell, David Edward.; Roisin, Yves.; Lo, Nathan. (2011). Biology of termites : a modern synthesis. Springer. ISBN 978-90-481-3977-4. OCLC 682911246. Consultado el 14 de octubre de 2020.
- Watanabe, Hirofumi; Noda, Hiroaki; Tokuda, Gaku; Lo, Nathan (1998-07). «A cellulase gene of termite origin». Nature (en inglés) 394 (6691): 330-331. ISSN 1476-4687. doi:10.1038/28527. Consultado el 14 de octubre de 2020.
- Watanabe, H.; Tokuda, G. (1 de agosto de 2001). «Animal cellulases». Cellular and Molecular Life Sciences CMLS (en inglés) 58 (9): 1167-1178. ISSN 1420-9071. doi:10.1007/PL00000931. Consultado el 14 de octubre de 2020.
- Guerriero, Gea; Sergeant, Kjell; Legay, Sylvain; Hausman, Jean-Francois; Cauchie, Henry-Michel; Ahmad, Irshad; Siddiqui, Khawar Sohail (15 de junio de 2018). «Novel Insights from Comparative In Silico Analysis of Green Microalgal Cellulases». International Journal of Molecular Sciences 19 (6). ISSN 1422-0067. PMC 6032398. PMID 29914107. doi:10.3390/ijms19061782. Consultado el 14 de octubre de 2020.
- «Producción de enzimas ligninolíticas durante la degradación del herbicida paraquat por hongos de la pudrición blanca». Revista Argentina de Microbiología (en inglés) 49 (2): 189-196. 1 de abril de 2017. ISSN 0325-7541. doi:10.1016/j.ram.2016.11.004. Consultado el 14 de octubre de 2020.
- Martínez-Anaya, Claudia; Balcázar-López, Edgar; Dantán-González, Edgar; Folch-Mallol, Jorge L. (2008). «Celulasas fúngicas: Aspectos biológicos y aplicaciones en la industria energética». Revista Latinoamericana de Microbiología (en español) 50 (3-4): 119-131. Consultado el 14 de octubre de 2020.
- Jeng, Wen-Yih; Wang, Nai-Chen; Lin, Man-Hua; Lin, Cheng-Tse; Liaw, Yen-Chywan; Chang, Wei-Jung; Liu, Chia-I; Liang, Po-Huang et al. (1 de enero de 2011). «Structural and functional analysis of three β-glucosidases from bacterium Clostridium cellulovorans, fungus Trichoderma reesei and termite Neotermes koshunensis». Journal of Structural Biology (en inglés) 173 (1): 46-56. ISSN 1047-8477. doi:10.1016/j.jsb.2010.07.008. Consultado el 14 de octubre de 2020.
- Phillips, Christopher M.; Beeson, William T.; Cate, Jamie H.; Marletta, Michael A. (16 de diciembre de 2011). «Cellobiose Dehydrogenase and a Copper-Dependent Polysaccharide Monooxygenase Potentiate Cellulose Degradation by Neurospora crassa». ACS Chemical Biology 6 (12): 1399-1406. ISSN 1554-8929. doi:10.1021/cb200351y. Consultado el 15 de octubre de 2020.
- Payne, Christina M.; Bomble, Yannick J.; Taylor, Courtney B.; McCabe, Clare; Himmel, Michael E.; Crowley, Michael F.; Beckham, Gregg T. (25 de noviembre de 2011). «Multiple Functions of Aromatic-Carbohydrate Interactions in a Processive Cellulase Examined with Molecular Simulation». Journal of Biological Chemistry (en inglés) 286 (47): 41028-41035. ISSN 0021-9258. PMC 3220501. PMID 21965672. doi:10.1074/jbc.M111.297713. Consultado el 15 de octubre de 2020.
- Lee, You-Jung; Kim, Bo-Kyung; Lee, Bo-Hwa; Jo, Kang-Ik; Lee, Nam-Kyu; Chung, Chung-Han; Lee, Young-Choon; Lee, Jin-Woo (1 de enero de 2008). «Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull». Bioresource Technology (en inglés) 99 (2): 378-386. ISSN 0960-8524. doi:10.1016/j.biortech.2006.12.013. Consultado el 15 de octubre de 2020.
- Cheng, Ya-Shan; Ko, Tzu-Ping; Wu, Tzu-Hui; Ma, Yanhe; Huang, Chun-Hsiang; Lai, Hui-Lin; Wang, Andrew H.-J.; Liu, Je-Ruei et al. (2011). «Crystal structure and substrate-binding mode of cellulase 12A from Thermotoga maritima». Proteins: Structure, Function, and Bioinformatics (en inglés) 79 (4): 1193-1204. ISSN 1097-0134. doi:10.1002/prot.22953. Consultado el 15 de octubre de 2020.
- Liu, Yuan; Yoshida, Makoto; Kurakata, Yuma; Miyazaki, Takatsugu; Igarashi, Kiyohiko; Samejima, Masahiro; Fukuda, Kiyoharu; Nishikawa, Atsushi et al. (2010). «Crystal structure of a glycoside hydrolase family 6 enzyme, CcCel6C, a cellulase constitutively produced by Coprinopsis cinerea». The FEBS Journal (en inglés) 277 (6): 1532-1542. ISSN 1742-4658. doi:10.1111/j.1742-4658.2010.07582.x. Consultado el 15 de octubre de 2020.
- Tsai, Shen-Long; DaSilva, Nancy A.; Chen, Wilfred (18 de enero de 2013). «Functional Display of Complex Cellulosomes on the Yeast Surface via Adaptive Assembly». ACS Synthetic Biology 2 (1): 14-21. doi:10.1021/sb300047u. Consultado el 15 de octubre de 2020.
- Ravachol, Julie; Borne, Romain; Tardif, Chantal; Philip, Pascale de; Fierobe, Henri-Pierre (14 de marzo de 2014). «Characterization of All Family-9 Glycoside Hydrolases Synthesized by the Cellulosome-producing Bacterium Clostridium cellulolyticum». Journal of Biological Chemistry (en inglés) 289 (11): 7335-7348. ISSN 0021-9258. PMC 3953250. PMID 24451379. doi:10.1074/jbc.M113.545046. Consultado el 15 de octubre de 2020.
- Gutiérrez-Rojas, Ivonne; Moreno-Sarmiento, Nubia; Montoya, Dolly (1 de enero de 2015). «Mecanismos y regulación de la hidrólisis enzimática de celulosa en hongos filamentosos: casos clásicos y nuevos modelos». Revista Iberoamericana de Micología 32 (1): 1-12. ISSN 1130-1406. doi:10.1016/j.riam.2013.10.009. Consultado el 23 de noviembre de 2020.
- Bhaumik, Prasenjit; Dhepe, Paresh Laxmikant (20 de noviembre de 2015). Biomass Sugars for Non-Fuel Applications (en inglés). pp. 1-53. Consultado el 23 de noviembre de 2020.
- M., A.e & Pabón-Usaquén, Jenny & T., C.e. (2011). Enzimas : Una alternativa para remover rápida y eficazmente el mucílago del café. Centro nacional de Investigaciones del Café. Avances Técnicos Cenicafé 406.https://www.cenicafe.org/es/publications/avt0406.pdf
- Arja, Miettinen-Oinonen (2007). Polaina, Julio, ed. Industrial Enzymes (en inglés). Springer Netherlands. pp. 51-63. ISBN 978-1-4020-5376-4. doi:10.1007/1-4020-5377-0_4. Consultado el 23 de noviembre de 2020.
- Fleming, Derek; Rumbaugh, Kendra P. (2017/6). «Approaches to Dispersing Medical Biofilms». Microorganisms (en inglés) 5 (2): 15. PMC 5488086. PMID 28368320. doi:10.3390/microorganisms5020015. Consultado el 23 de noviembre de 2020.
- Fleming, Derek; Chahin, Laura; Rumbaugh, Kendra (1 de febrero de 2017). «Glycoside Hydrolases Degrade Polymicrobial Bacterial Biofilms in Wounds». Antimicrobial Agents and Chemotherapy (en inglés) 61 (2). ISSN 0066-4804. PMC 5278739. PMID 27872074. doi:10.1128/AAC.01998-16. Consultado el 23 de noviembre de 2020.