Ciclopenteno
El ciclopenteno es un compuesto orgánico con fórmula C5H8. Se trata de un cicloalqueno, un anillo insaturado de cinco miembros que tiene un doble enlace. Es un líquido incoloro con un olor parecido al petróleo.
| Ciclopenteno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ciclopenteno | ||
| General | ||
| Fórmula estructural |
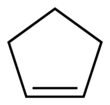 | |
| Fórmula molecular | C5H8 | |
| Identificadores | ||
| Número CAS | 142-29-0[1] | |
| ChEMBL | CHEMBL1797299 | |
| ChemSpider | 8544 | |
| PubChem | 8882 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 771 kg/m³; 0,771 g/cm³ | |
| Masa molar | 6811 g/mol | |
| Punto de fusión | −135 °C (138 K) | |
| Punto de ebullición | 44 °C (317 K) | |
| Índice de refracción (nD) | 1,4194[2] | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,535 | |
| Momento dipolar | 0,93[2] D | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Usos y aplicaciones
El ciclopenteno se produce industrialmente en grandes cantidades. Se utiliza como monómero para la síntesis de plásticos, y en diferentes síntesis químicas, tales como adición al doble enlace y cicloadiciones. Las reacciones de sustitución suelen tener lugar en la posición alílica.[2] La oxidación catalítica de ciclopenteno con oxígeno puede dar ciclopentanona.[3]
La formación estereoselectiva de trans-triciclo[5.3.0.02,6]decano por dimerización fotoquímica de ciclopenteno es un ejemplo simple de fotodimerización a través de cicloadición [2 + 2]:[4]
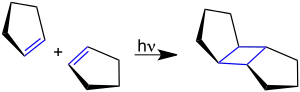
La reacción obtiene un rendimiento del 55%.[4]
Obtención
El ciclopenteno se obtiene por craqueo a vapor de la nafta, con cerca de 2,2 kg ciclopenteno por tonelada de nafta. Sin embargo, es más eficiente la hidrogenación catalítica de ciclopentadieno.[2] También se puede obtener por la reacción de reordenamiento de vinilciclopropano.
Referencias
- Número CAS
- D. Hönicke, R. Födisch, P. Claus, M. Olson: Cyclopentadiene and Cyclopentene, in: Ullmanns Enzyklopädie der Technischen Chemie 2002, Wiley-VCH, Weinheim.
- J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger, H. Kojer: Katalytische Umsetzungen von Olefinen an Platinmetall-Verbindungen Das Consortium-Verfahren zur Herstellung von Acetaldehyd, in : Angew. Chem. 1959, 71, 176–182; doi 10.1002/ange.19590710503.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 143, ISBN 978-3-906390-29-1.