Clostridium perfringens
Clostridium perfringens, antes llamado Bacillus aerogenes capsulatus, Bacillus perfringens, Bacillus welchii o Clostridium welchii, es una bacteria anaeróbica Gram-positiva, capsulada, esporulada e inmóvil que se encuentra ampliamente distribuida en el ambiente, de gran plasticidad ecológica. No suele aparecer esporulada, ni en productos patológicos ni en cultivos, requiriendo para esporular medios especiales.[1]
| Clostridium perfringens | ||
|---|---|---|
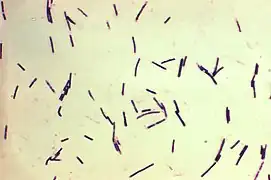 La fotomicrografía muestra Clostridium perfringens teñidos con la tinción de Gram. | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Firmicutes | |
| Clase: | Clostridia | |
| Orden: | Clostridiales | |
| Familia: | Clostridiaceae | |
| Género: | Clostridium | |
| Especie: |
C. perfringens Veillon & Zuber 1898 Hauduroy et al. 1937 | |
La cápsula, la carencia de flagelos y la esporulación poco frecuente lo diferencian de otras especies del el agente etiológico más importante de la gangrena gaseosa. Además, es responsable de otros cuadros clínicos como son: toxiinfecciones alimentarias, enteritis necrosante, colecistitis enfisematosa[2], celulitis e infecciones inespecíficas.
Los determinantes de patogenicidad de esta bacteria son variados, de tal manera que ejerce su acción patógena mediante la producción de varias toxinas citotóxicas, una enterotoxina y varias enzimas extracelulares con actividad biológica (colagenasas, hialuronidasas, etc.)
Características.
Produce toxinas que pueden causar enfermedades como la enteritis necrótica o la gangrena gaseosa.
En la gangrena gaseosa, el clostridio provoca destrucción en los tejidos infectados si persiste. Esto es provocado por la liberación de exoenzimas específicos que atacan a las moléculas constituyentes de los tejidos de animales: fosfolipasas, hemolisinas, colagenasas, proteasas.., que provocan la putrefacción del tejido acompañada de una producción de gas, y de ahí su nombre ("gaseosa"). Actualmente el tratamiento con antitoxinas, antibióticos y profilaxis quirúrgica es muy efectivo lo cual reduce muy significativamente los casos de amputación y de muerte. Sin embargo en casos extremos es necesario amputar para salvar la vida del paciente.
Es el tercer indicador de contaminación fecal de las aguas. Se destruye con temperaturas superiores a 121 °C.
Al menos 8 de las toxinas producidas por este microorganismo son consideradas letales y 4 de ellas, α, β, ε ι y se consideran las más significativas, y se han utilizado para agrupar las cepas en 5 tipos toxigénicos, A, B, C, D y E (Petit et al., 1999).
Pertenece a la familia Clostridiaceae y al grupo de los clostridios que agrupa a unas 60 especies. Hay varios tipos de Clostridium perfringens:
- Clostridium perfringens A.
- Clostridium perfringens B.
- Clostridium perfringens C.
- Clostridium perfringens D.
- Clostridium perfringens E.
Entre estos tipos, destacamos C. perfringens A y C, que son los que tienen capacidad de producir una enfermedad infecciosa en el ser humano.
C. perfringens es un microorganismo que reviste suma importancia en medicina humana y veterinaria ya que, pese a ser parte de la microbiota intestinal, es potencialmente patógeno y letal, tanto para animales como para el hombre. Tanto es así que el uso de algunas de sus toxinas como potenciales armas bioterroristas ha generado cierta preocupación en algunos países. Sin embargo, y a modo de contracara, otras de sus toxinas podrían ser usadas en el tratamiento de enfermedades, como transportadoras e internalizadoras de drogas en células procariotas (toxina iota) o en ciertas terapias antitumorales (enterotoxina).
El tipo A es el responsable de la casi totalidad de los cuadros clínicos en el hombre. El tipo C produce ocasionalmente enteritis necrosante. La enterotoxina es producida por múltiples cepas del tipo A y excepcionalmente por alguna de los tipos C y D.
La enterotoxina
Se trata de una proteína de bajo peso molecular (aproximadamente 35.000 Da) que presenta un punto isoeléctrico de 4,3 (Granum y Stewart, 1993). Esta enterotoxina es termolábil, así, el calentamiento en solución salina a una temperatura de 60 °C durante 5 minutos destruye su actividad biológica. Además, la toxina es muy sensible a pH extremos, aunque es resistente a algunos tratamientos proteolíticos (McDonel, 1986).
Se han propuesto diversos mecanismos de acción de esta enterotoxina: una acción colinérgica derivada de la acción lecitinasa, y alternativamente o al mismo tiempo una toxina con acción tipo cólera, activando la secreción de iones cloruro en el lumen, lo que conlleva la retención de iones sodio y secuestro de agua en el intestino; un tercer mecanismo sugiere efectos endoteliales que llevan a una vasodilatación en el intestino y aumento de la permeabilidad (Deshpande, 2002).
El cuadro clínico de toxiinfección alimentaria se produce por ingestión de gran número de bacterias (más de 10 8 células vegetativas) productoras de la enterotoxina.
Signos
Los signos aparecen tras un periodo de incubación de 8 a 24 horas y el cuadro clínico se caracteriza fundamentalmente por la aparición de dolor abdominal y diarreas severas. Cursa sin fiebre, y la enfermedad es de corta duración, con recuperación favorable, salvo en niños y personas debilitadas.
El cuadro clínico de la enteritis necrosante es un cuadro muy infrecuente, aunque grave, que aparece después de un periodo de incubación menor de 24 horas y se caracteriza por dolor abdominal, diarrea, vómitos, e inflamación aguda del intestino delgado con necrosis y gangrena en diversas porciones del mismo (Brynestad y Granum, 2002). Este cuadro clínico se relaciona con dietas hipoproteicas y se produce fundamentalmente por la ingestión de alimentos contaminados con C. perfringens tipo C que libera en el intestino toxina de la cual se han descrito 2 tipos, β 1 y β 2 (Gibert et al., 1997). Ambos tipos tienen una acción letal y necrótica, produciendo hemorragia y necrosis.
Actualmente la enteritis necrosante está restringida a los indígenas de Papua, Nueva Guinea, que habitualmente ingieren pocas proteínas en su dieta. Aunque la mayoría de los alimentos pueden contaminarse con este microorganismo, los productos cárnicos, en particular, son los más susceptibles.
Contaminación
La contaminación tiene lugar en cualquiera de los eslabones de la cadena alimentaria, que van desde su obtención, procesado culinario, conservación y recalentamiento. La prevención de la toxiinfección por C. perfringens no es fácil. Así, asegurar que el microorganismo no contamine el alimento resulta prácticamente imposible, ya que se trata de un microorganismo ubicuo.
Especial precaución debe tomarse en el caso de carnes rojas y aves, ya que estos animales actúan como reservorios (tracto intestinal). Además, es la especie del género Clostridium que se aísla con mayor frecuencia del hombre como microbiota normal (manos), actuando así el hombre también como reservorio.
Por lo tanto, resulta más práctico inhibir la multiplicación del microorganismo en el alimento, y si está presente en gran cantidad, reducirlo hasta niveles seguros.
Las esporas de este bacilo resisten el calentamiento de los alimentos y pueden germinar durante el enfriamiento. Se debe tener especial cuidado de no conservar nunca los alimentos ya cocinados a temperatura ambiente. El enfriamiento lento de 50 °C a 25 °C es particularmente peligroso en el caso de esta bacteria, puesto que a esas temperaturas, en unas pocas horas, se puede desarrollar un gran número de células vegetativas productoras de la enterotoxina.
Ámbito de la medicina veterinaria
En el ámbito de la medicina veterinaria, C. perfringens genera importantes pérdidas en la producción ganadera. En pequeños rumiantes es conocida como basquilla. En el caso de la producción avícola, por ejemplo, el reciente descubrimiento de una toxina (NetB), presente en cepas de C. perfringens tipo A aisladas de aves con enteritis necrótica, abre una nueva línea de investigación, relevante tanto para el conocimiento de la patogenia de estos microorganismos como para el desarrollo de nuevas vacunas. Esta toxina, o tal vez otras también, podrían estar involucradas en la enteritis necrótica por C. perfringens tipo A observada en otras especies animales.
Dado el renovado interés que existe en el estudio de C. perfringens y sus toxinas, es posible que algún día llegue a tenerse un perfil más completo de la biología de esta bacteria como comensal y como patógeno. Esta información permitirá dilucidar su papel en enfermedades entéricas en las que su participación aún es incierta.
Galería
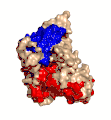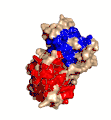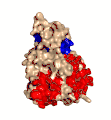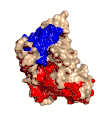 Estructura cristalina de la toxina alfa de C. perfringens publicada en el Protein Data Bank (PDB: 1CA1)
Estructura cristalina de la toxina alfa de C. perfringens publicada en el Protein Data Bank (PDB: 1CA1) Clostridium perfringens. MEB. 16.000X.
Clostridium perfringens. MEB. 16.000X.
Bibliografía
- Ingraham, John L. (1998). Harriet Prentiss, ed. Introducción a la microbiología, Volumen 2 Introducción a la microbiología, Catherine A. Ingraham, ISBN 8429118691, 9788429. books.google.es: Reverte. p. 567. ISBN 9788429118711. Consultado el 8 de enero de 2017.
- Anderson, María del Rosario Pascual (2005). Enfermedades de origen alimentario: su prevención. Ediciones Díaz de Santos. ISBN 9788479786823. Consultado el 9 de agosto de 2017.
Referencias
- Kiu, Raymond; Hall, Lindsay J. (agosto de 2018). «An update on the human and animal enteric pathogen Clostridium perfringens» [Una actualización acerca del patógeno entérico humano y animal Clostridium perfringens]. Emerg Microbes Infect (en inglés) (Taylor & Francis) 7: 141. PMID 30082713. doi:10.1038/s41426-018-0144-8. Consultado el 16 de septiembre de 2019.
- Safwan, Mishal; Penny, Steven M. (2016-05). «Emphysematous Cholecystitis: A Deadly Twist to a Common Disease». Journal of Diagnostic Medical Sonography (en inglés) 32 (3): 131-137. ISSN 8756-4793. doi:10.1177/8756479316631535. Consultado el 7 de septiembre de 2022.