Diisocianato de tolueno
El diisocianato de tolueno es un compuesto orgánico de tipo diisocianato (por tener dos grupos isocianato,-N=C=O) aromático (por tener un anillo aromático). Su nombre es usualmente abreviado como "TDI" (de Toluen diisocianato). Tiene varios isómeros estructurales pero los más importantes comercialmente[2] son el 2,4-TDI (n°CAS: 584-84-9) y el 2,6-TDI (n°CAS: 91-08-7). A la mezcla de isómeros le corresponde el n°CAS: 26471-62-5.[3] El 2,4-TDI tiene importancia comercial en estado puro mientras que el 2,6-TDI se vende mezclado con el 2,4-TDI en distintas relaciones.
El TDI es el segundo diisocianato más importante del mercado solo después del diisocianato de difenilmetano (MDI).[4]
| Diisocianato de tolueno | ||
|---|---|---|
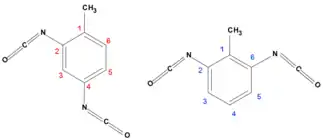 Isómeros 2,4-TDI y 2,6-TDI | ||
 Estructura 3D de esferas de Van der Waals del 2,4-TDI | ||
| Nombre IUPAC | ||
| 2,4-diisocianato-1-metil-benzeno | ||
| General | ||
| Otros nombres |
Diisocianato de 4-metil-m-benceno, | |
| Fórmula semidesarrollada | CH3C6H3(NCO)2 | |
| Fórmula molecular | C9H6N2O2 | |
| Identificadores | ||
| Número CAS | 584-84-9 (TDI-2,4)[1] | |
| Número RTECS | CZ6300000 | |
| ChEBI | 53556 | |
| ChEMBL | CHEMBL1086446 | |
| ChemSpider | 13835351 | |
| PubChem | 11443 | |
| UNII | 17X7AFZ1GH | |
| Propiedades físicas | ||
| Apariencia | Cristales o líquido incoloro-amarillento pálido | |
| Densidad | 1214 kg/m³; 1214 g/cm³ | |
| Masa molar | 1742 g/mol | |
| Punto de fusión | 295 K (22 °C) | |
| Punto de ebullición | 523 K (250 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Reacciona con el agua | |
| Peligrosidad | ||
| Punto de inflamabilidad | 400 K (127 °C) | |
| NFPA 704 |
1
3
2
₩
| |
| Temperatura de autoignición | 893 K (620 °C) | |
| Frases R | R26-36/37/38-40-42/43-52/53 | |
| Frases S | S23 S36/37-45-61 | |
| Límites de explosividad | 0,9-9,5 (%vol aire) | |
| Riesgos | ||
| LD50 | 5800 mg/Kg | |
| Más información | Exceptuando donde se diga algo distinto, todos los datos están dados bajo las condiciones del estado estándar (25 °C, 100 kPa). | |
| Compuestos relacionados | ||
| Diisocianatos |
| |
| Derivados/Precursores | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis
El TDI se sintetiza en tres etapas[5] a partir del tolueno:
- Nitración: El tolueno se trata con una mezcla de ácidos sulfúrico y nítrico para nitrarlo doblemente hasta obtener una mezcla de isómeros de dinitrotolueno.
- Hidrogenación: El dinitrotolueno se hidrogena catalíticamente para producir diaminotolueno o toluendiamina.
- Fosgenación: La toluendiamina o el diaminotolueno es tratado con fosgeno para producir TDI, obteniéndose ácido clorhídrico como subproducto que se aprovecha.[4]
El TDI crudo obtenido es sometido a procesos de separación o diferenciación para obtener mezclas 2,4-TDI/2,6-TDI de ratios 80:20, mezcla conocida como TDI(80/20), hasta mezclas con ratios 65:35, conocidas como TDI(65/35).
Actualmente se realizan esfuerzos para tratar de sustituir el proceso de fosgenación[6] ,[7],[8] en la síntesis de isocianatos, debido a la alta toxicidad del fosgeno.Uno de los métodos alterntivas a la fosgenación es el implementado por Mitsui Toatsu Chemicals y Atlantic Richfield basado en la descomposición térmica de los diuretanos formados tras el tratamiento del dinitrotolueno con alcoholes según:[9]
(RCOONH)C6H3CH3 → (OCN)2C6H3CH3 + 2(ROH)
Química
El TDI desarrolla una química similar al del resto de isocianatos. Sin embargo al tener una naturaleza aromática la reactividad es mayor que en el caso de los diisocianatos alifáticos dando lugar a reacciones altamente exotérmicas, pudiendo reaccionar muy violentamente cuando se hace reaccionar con diaminas. La velocidad de polimerización con dibases es mayor que la presentada por los diisocianatos alifáticos.
En el isómero 2,4-TDI, al ser asimétrico, las reactividades de los grupos funcionales son distintas, siendo más reactivo el de la posición 4.[10] En el caso del isómero 2,6-TDI que es simétrico esta diferencia no existe pero si sucede que una vez reaccionado por un lado la ractividad del otro isocianato puede verse alterada.[4]
Usos
El mayor uso es en la síntesis de poliuretano. La mayor parte del TDI producido (80-85%) se emplea en la producción de espumas flexibles de poliuretano. También en menor medida para espumas rígidas, como es el caso del núcleo de algunas tablas de surf. Alrededor de un 3% en la síntesis de poliuretanos elástoméricos, un 5% en adhesivos y sellantes, y un 9% en recubrimientos.[5]
Seguridad
El TDI es clasificado por la Comunidad Europea como "Muy Tóxico". Es imprescindible la lectura de las hojas de seguridad antes de su manipulación así como una indumentaria de protección personal adecuada para evitar el mínimo contacto, inhalación o ingesta.


Referencias
- (TDI-2,4) Número CAS
- Grupo Transmerquin (2009). «TDI-Hoja de datos de Seguridad».
- Oehha. «CHRONIC TOXICITY SUMMARY 2,4- AND 2,6-TOLUENE DIISOCYANATE». Archivado desde el original el 6 de marzo de 2012. Consultado el 27 de octubre de 2012.
- Randall, David; Lee, Steve (2002). The Polyurethanes Book. New York: Wiley. ISBN 978-0-470-85041-1.
- DOW, Product Safety Assessment. «Toluen Diisocyanate» (en inglés).
- Six, C.; Ritcher, F. (2003). Isocyanates, Organic-Ullmann´s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a14_611.
- Repsol S.A.-TecaT. «Síntesis de Isocianatos sin Fosgeno. Estudios de Carbonilación». Archivado desde el original el 14 de diciembre de 2013. Consultado el 28 de octubre de 2012.
- Merger, F.; Towae, F.; Hellbach, H.; Isbarn, G.; Koehler, W. (BASF) (24 de junio de 1986). «USA-Patent-4596678-Multiple-Step Process for the Preparation of Hexamethylene Diisocyanate-1,6 and/or Isomeric Aliphatic Diisocyanates with Six Carbon Atoms in the Alkylene Residue».
- Laborde et al (1994). Transformación catalítica del gas natural. IV. Derivados del gas de síntesis: fosgeno, isocianatos, ácido acético y alcoholes superiores. Información Tecnológica, 5, 41-48.
- Aranguren, M.; Williams, R.J (1986). «Kinetic and statistical aspects of the formation of polyurethanes from toluenediisocyanate». Polymer 27 (3): 425-430. doi:10.1016/0032-3861(86)90160-6.
Recursos externos
. Ficha Internacional de Seguridad Química Diisocianato de Tolueno (isómero 2,4-TDI). Instituto Nacional de Seguridad y Salud en el Trabajo. Gobierno de España.
. Ficha Internacional de Seguridad Química Diisocianato de Tolueno (isómero 2,6-TDI). Instituto Nacional de Seguridad y Salud en el Trabajo. Gobierno de España.
. Ficha Internacional de Seguridad Química Diisocianato de Tolueno (mezcla 80/20 de isómeros 2,4- y 2,6-). Instituto Nacional de Seguridad y Salud en el Trabajo. Gobierno de España.
