Epicoccum nigrum
Epicoccum nigrum es una especie de hongo del filo Ascomycota. Es patógeno y endófito de plantas, es un hongo muy extendido que produce pigmentos coloreados que pueden usarse como agentes antifúngicos contra otros hongos patógenos. De ella se extrae la tinción fluorescente epicocconona.
| Epicoccum nigrum | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Reino: | Fungi | |
| División: | Ascomycota | |
| Clase: | Dothideomycetes | |
| Subclase: | Pleosporomycetidae | |
| Orden: | Pleosporales | |
| Familia: | Didymellaceae | |
| Género: | Epicoccum | |
| Especie: |
Epicoccum nigrum Link | |
| Sinonimia | ||
Epicoccum purpurascens Ehrenb. | ||
Crecimiento y morfología
E. nigrum (1825) es un hongo sin forma teleomorfa conocida.[1] Se ha clasificado como miembro de Hyphomycetes,[2] en Deuteromycota, así como de Fungi imperfecti porque solo se sabe que se reproduce asexualmente. A pesar de que no es como una levadura, se ha incluido en la categoría amplia y no relacionada de hongos conocidos como levaduras negras.[2] El hongo desarrolla colonias afieltradas en tonos brillantes de amarillo, naranja y rojo, a menudo con marrón o negro por todas partes.[1][2] Las colonias crecen rápidamente y alcanzan unos 6 cm de diámetro en 2 días a temperatura ambiente.[1] Los micelios contienen quitina y celulosa.[1]
E. nigrum forma blastoconidios de color oscuro, con verrugas y esféricos, que alcanzan de 15 a 25 µm de diámetro.[1] Los conidios crecen sobre un esporodoquio, formado por hifas verrugosas y fibrosas.[1][3] Se ha encontrado que las esporas contienen hasta 15 células.[4] Las esporas de E. nigrum se liberan activamente dependiendo de las condiciones de temperatura, luz y humedad relativa.[5] El mecanismo de liberación implica la separación del conidio del esporodoquio a través de un tabique doble. Aprovecha la forma esférica de las conidias, permitiéndoles 'rebotar' en el esporodoquio.[6]] Luego, los conidios se transportan por el aire con el movimiento o el viento.[7] La esporulación se induce bajo la luz de Wood o, a veces, tras la exposición a temperaturas frías con un retorno posterior a la temperatura ambiente.[1] La producción de pigmentos también es sensible a los cambios de luz y temperatura.[8] Las temperaturas de crecimiento ideales oscilan entre 23 y 28 °C (73 y 82 °F) y el pH de crecimiento ideal oscila entre 5,0 y 6,0.[1] Aunque E. nigrum crece en un rango de actividad de agua (aw de 0,99 a 0,97),[9] el crecimiento se optimiza en la saturación de vapor de agua.[1]
E. nigrum produce una variedad de metabolitos biomédica e industrialmente útiles, incluidos importantes agentes antifúngicos y pigmentos, entre ellos: flavipina, epicorazinas A y B, epirodina, epicocconona y una variedad de pigmentos carotenoides.[10][11] E. nigrum también se ha utilizado en la fabricación biosintética de nanopartículas de plata y oro.[12][13]
Hábitat y ecología
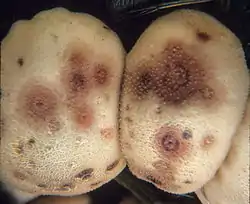
Un hongo altamente robusto y ubicuo,[14] E. nigrum tiene una distribución casi global, apareciendo en las Américas, Asia y Europa. [1] Las esporas de E. nigrum se han cultivado en una variedad de ambientes, predominantemente suelo (es decir, turba, suelo forestal, humus crudo, compost, tundra, aguas residuales)[1] y arena (por ejemplo, dunas, arenas salinas).[1][15] Es un hongo saprotrófico que forma pústulas (compuestas de esporodoquios y conidios) en plantas muertas y moribundas.[4] Esta especie se encuentra comúnmente creciendo en cereales y semillas, así como en otros cultivos, como maíz, frijoles, papas, guisantes y duraznos.[1][16] Se ha descubierto que desarrolla colonias en hojas sumergidas en agua a una temperatura de hasta 0 °C y se considera un hongo marino facultativo. [17] Es capaz de colonizar algas y pastos de pantano.[17] En ambientes interiores, se ha encontrado E. nigrum en pinturas y papel tapiz,[18] algodón y textiles,[1][4] en polvo, [16][18] y en el aire.[1][16][19][20] Es tolerante a los cambios en la disponibilidad de agua, y se ha encontrado que el crecimiento de las hifas se reanuda dentro de una hora de exposición al agua.[17]
Referencias
- Anderson, K.H. Domsch, W. Gams, Traute-Heidi (1981). Compendium of soil fungi.. London: Academic Press. ISBN 978-0-12-220401-2. (requiere registro).
- Pfaller, [edited by] Elias J. Anaissie, Michael R. McGinnis, Michael A. (2009). Clinical mycology (2nd edición). [Edinburgh?]: Churchill Livingstone. ISBN 978-1-4160-5680-5.
- Mims, C.W.; Richardson, E.A. (October 2005). «Ultrastructure of sporodochium and conidium development in the anamorphic fungus». Canadian Journal of Botany 83 (10): 1354-1363. doi:10.1139/b05-137.
- Schol-Schwarz, M. Beatrice (June 1959). «The genus Epicoccum Link». Transactions of the British Mycological Society 42 (2): 149-IN3. doi:10.1016/S0007-1536(59)80024-3.
- Meredith, Donald S. (1966). «Diurnal periodicity and violent liberation of conidia in epicoccum». Phytopathology 56: 988.
- Webster, J. (June 1966). «Spore projection in Epicoccum and Arthrinium». Transactions of the British Mycological Society 49 (2): 339-IN14. doi:10.1016/S0007-1536(66)80068-2.
- McGinnis, Michael R. (January 2007). «Indoor mould development and dispersal». Medical Mycology 45 (1): 1-9. PMID 17325938. doi:10.1080/13693780600928495.
- Gribanovski-Sassu, Olga; Foppen, F.H. (September 1968). «Light and temperature effect on Epicoccum nigrum». Phytochemistry 7 (9): 1605-1612. doi:10.1016/S0031-9422(00)88613-6.
- ALDRED, DAVID; PENN, JULIA; MAGAN, NARESH (February 2005). «Water availability and metabolomic profiles of Epicoccum nigrum and Sarophorum palmicola grown in solid substrate fermentation systems». Mycologist 19 (1): 18-23. doi:10.1017/S0269915X05001035.
- Bamford, P.C.; Norris, G.L.F.; Ward, G. (September 1961). «Flavipin production by Epicoccum spp.». Transactions of the British Mycological Society 44 (3): 354-356. doi:10.1016/S0007-1536(61)80028-4.
- Brown, Averil E.; Finlay, Ruth; Ward, J.S. (January 1987). «Antifungal compounds produced by Epicoccum purpurascens against soil-borne plant pathogenic fungi». Soil Biology and Biochemistry 19 (6): 657-664. doi:10.1016/0038-0717(87)90044-7.
- Qian, Yongqing; Yu, Huimei; He, Dan; Yang, Hui; Wang, Wanting; Wan, Xue; Wang, Li (6 de marzo de 2013). «Biosynthesis of silver nanoparticles by the endophytic fungus Epicoccum nigrum and their activity against pathogenic fungi». Bioprocess and Biosystems Engineering 36 (11): 1613-1619. PMID 23463299. S2CID 19159298. doi:10.1007/s00449-013-0937-z.
- Sheikhloo, Zeinab; Salouti, Mojtaba; Katiraee, Farzad (15 de septiembre de 2011). «Biological Synthesis of Gold Nanoparticles by Fungus Epicoccum nigrum». Journal of Cluster Science 22 (4): 661-665. S2CID 97716088. doi:10.1007/s10876-011-0412-4.
- Ahumada-Rudolph, Ramón; Cajas-Madriaga, Daniel; Rudolph, Anny; Reinoso, Rodrigo; Torres, Cristian; Silva, Mario; Becerra, José (August 2014). «Variation of sterols and fatty acids as an adaptive response to changes in temperature, salinity and pH of a marine fungus Epicoccum nigrum isolated from the Patagonian Fjords». Revista de Biología Marina y Oceanografía 49 (2): 293-305. doi:10.4067/S0718-19572014000200009.
- Debrecen, edited by Mahendra Rai, University of (2010). Progress in mycology. Dordrecht: Springer. ISBN 978-90-481-3712-1.
- Miller, edited by Brian Flannigan, Robert A. Samson, J. David (2011). Microorganisms in home and indoor work environments : diversity, health impacts, investigation and control (2nd edición). Boca Raton, FL: CRC Press. ISBN 978-1-4200-9334-6.
- Cole, Edited by Garry; Kendrick, Edited by Bryce (1981). Biology of conidial fungi. New York [u.a.]: Acad. Press. ISBN 978-0-12-179501-6.
- Singh, Jagjit, ed. (1994). Building Mycology Management of Decay and Health in Buildings. (1st edición). Hoboken: Taylor & Francis Ltd. ISBN 978-0-203-97473-5.
- PUSZ, Wojciech; PLĄSKOWSKA, Elzbieta; YILDIRIM, İsmet; WEBER, Ryszard (2015). «Fungi occurring on the plants of the genus Amaranthus L.». Turkish Journal of Botany 39: 147-161. doi:10.3906/bot-1403-106.
- Wilman, Karolina; Stępień, Łukasz; Fabiańska, Izabela; Kachlicki, Piotr (29 de enero de 2014). «Plant-Pathogenic Fungi in Seeds of Different Pea Cultivars in Poland». Archives of Industrial Hygiene and Toxicology 65 (3): 329-338. PMID 25205690. doi:10.2478/10004-1254-65-2014-2480.