Factor de crecimiento epidérmico
El factor de crecimiento epidérmico (EGF, más conocido por sus siglas en inglés, «epidermal growth factor»), es una proteína que estimula el crecimiento y la diferenciación celular combinándose con su receptor EGFR. El EGF humano tiene una masa molecular de 6 kilodaltons, contiene 53 residuos aminoácidos y tres enlaces disulfuro.[1][2] Ha sido desarrollado como fármaco con el nombre de «nepidermina».[3]
| Factor de crecimiento epidérmico | ||||
|---|---|---|---|---|
 Estrutura de RMN coas cores do arco da vella da EGF de rato (N-terminal = azul, C-terminal = vermello). PDB 1a3p | ||||
| Estructuras disponibles | ||||
| PDB | Buscar ortólogos: PDBe, RCSB | |||
| Identificadores | ||||
| Identificadores externos | ||||
| Locus | Cr. 4 :(109.91 – 110.01 Mb) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
El Factor de Crecimiento Epidérmico (Epidermal Growth Factor, EGF) es importante en la curación de heridas y quemaduras; regula la inflamación y la acción de los fibroblastos y estimula el crecimiento de las células epiteliales para la reparación del tejido.[4]
El EGF fue en principio descrito como un péptido secretado, encontrado en las glándulas submaxilares de los ratones y en la orina humana. Desde entonces ha sido hallado en varios tejidos humanos, entre los que podemos señalar como ejemplo la glándula parótida.[5] El EGF humano fue conocido inicialmente como urogastrona ,.[6] y fue el primer factor de crecimiento identificado.[7]
Al igual que el TGF-α—y junto con las hormonas y neurotransmisores—desempeña una importante función en la comunicación intercelular. Todos estos pertenecen a la familia de los factores de crecimiento epidérmico y utilizan el mismo receptor.[8]
EGF tiene capacidad mitogénica sobre una amplia variedad de tipos celulares: epiteliales, hepatocitos y fibroblastos. Esta actividad es importante en la cicatrización de heridas, situación en la que los macrófagos, queratinocitos y otras células inflamatorias que migran a la zona dañada segregan EGF, que se distribuye ampliamente en secreciones tisulares y fluidos.
El TGF-α se identificó originalmente en células transformadas por virus de sarcoma, y está implicado en la proliferación de tejidos epiteliales embrionarios y adultos, así como en procesos de transformación tumoral. TGF-α presenta homologías con el EGF, ya que utiliza el mismo receptor y realiza funciones similares.
El receptor para EGF (EGFR) es en realidad una familia de 4 moléculas con actividad intrínseca tirosina quinasa. La molécula receptora mejor caracterizada se denomina EGFR1, ERB B1 o simplemente EGFR. Se han detectado mutaciones y amplificaciones de EGFR en cáncer de pulmón, de cabeza y cuello, de mama, glioblastomas y otros tipos de cáncer.
Fuentes biológicas
El factor de crecimiento epidérmico se puede encontrar en la orina , la saliva , la leche , las lágrimas y el plasma sanguíneo . También se puede encontrar en las glándulas submandibulares , y la glándula parótida .[9]
Mecanismo
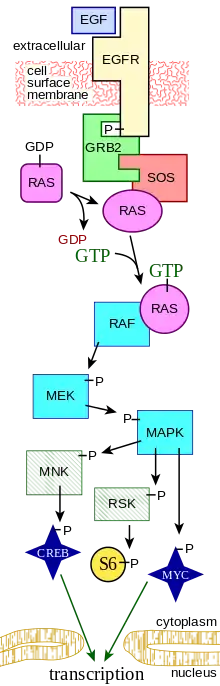
El EGF actúa uniéndose con alta afinidad al receptor del factor de crecimiento epidérmico (EGFR) en la superficie celular . Esto estimula la dimerización inducida por ligando, activando la actividad intrínseca de proteína tirosina quinasa del receptor. La actividad de la tirosina quinasa , a su vez, inicia una cascada de transducción de señales que da como resultado una variedad de cambios bioquímicos dentro de la célula: aumento de los niveles de calcio intracelular , aumento de la glucólisis y síntesis de proteínas y aumento de la expresión de ciertos genes.incluido el gen del EGFR, que en última instancia conduce a la síntesis de ADN y la proliferación celular.
Familia EGF / Dominio similar a EGF
EGF es el miembro fundador de la familia de proteínas EGF . Los miembros de esta familia de proteínas tienen características estructurales y funcionales muy similares. Además del propio FEAG, otros miembros de la familia incluyen:[10]
- Factor de crecimiento similar a EGF de unión a heparina (HB-EGF)
- factor de crecimiento transformante-α (TGF-α)
- Anfirregulina (AR)
- Epirregulina (EPR)
- Epigen
- Betacelulina (BTC)
- neuregulina-1 (NRG1)
- neuregulina-2 (NRG2)
- neuregulina-3 (NRG3)
- neuregulina-4 (NRG4).
Todos los miembros de la familia contienen una o más repeticiones de la secuencia de aminoácidos conservada :
CX 7 CX 4-5 CX 10-13 CXCX 8 GXRC
Donde C es cisteína , G es glicina , R es arginina y X representa cualquier aminoácido .
Esta secuencia contiene seis residuos de cisteína que forman tres enlaces disulfuro intramoleculares . La formación de enlaces disulfuro genera tres bucles estructurales que son esenciales para la unión de alta afinidad entre los miembros de la familia EGF y sus receptores de la superficie celular.[11]
Homólogo sintético
En la década de 1990, algunos investigadores del Centro de Ingeniería Genética y Biotecnología en La Habana lograron sintetizar una versión recombinada de este factor. Se encuentra en periodo experimental y ha recibido el nombre de Heberprot-p. La empresa española Praxis Pharmaceutical está realizando ensayos clínicos (fases II en adelante) con el nombre de "PX070101" para su posterior comercialización en Europa.
Referencias
- Harris, R (10 de marzo de 2003). «EGF receptor ligands». Experimental Cell Research (en inglés) 284 (1): 2-13. doi:10.1016/S0014-4827(02)00105-2. Consultado el 13 de abril de 2020.
- Carpenter, G.; Cohen, S. (15 de mayo de 1990). «Epidermal growth factor». The Journal of Biological Chemistry 265 (14): 7709-7712. ISSN 0021-9258. PMID 2186024. Consultado el 13 de abril de 2020.
- «Nepidermin». Drugs.com (en inglés). Consultado el 13 de abril de 2020.
- Esquirol-Caussa, Jordi; Herrero-Vila, Elisabeth; Esquirol-Caussa, Jordi; Herrero-Vila, Elisabeth (2017-12). «Factor de Crecimiento Epidérmico (EGF) y geles de silicona en el abordaje de heridas, quemaduras y cicatrices: revisión de la literatura». Cirugía Plástica Ibero-Latinoamericana 43 (4): 387-394. ISSN 0376-7892. doi:10.4321/s0376-78922017000500009. Consultado el 2 de octubre de 2020.
- Venturi, Sebastiano; Venturi, Mattia (2009-04). «Iodine in Evolution of Salivary Glands and in Oral Health». Nutrition and Health (en inglés) 20 (2): 119-134. ISSN 0260-1060. doi:10.1177/026010600902000204. Consultado el 13 de abril de 2020.
- Md, Hollenberg (1980-05). «Epidermal Growth Factor-Urogastrone: Biological Activity and Receptor Binding of Derivatives». Molecular pharmacology (en inglés). Consultado el 13 de abril de 2020.
- EPIDERMAL GROWTH FACTORS (en inglés). 1 de enero de 2006. pp. 129-133. doi:10.1016/B0-12-370879-6/00138-1. Consultado el 7 de mayo de 2021.
- Kumar, MBBS, MD, FRCPath, V.; Abul K. Abbas, MBBS, Nelson Fausto, MD and Jon Aster, MD (2009). «Ch3-Tissue Renewal, Regeneration and Repair». En Saunders (Elsevier), ed. Robbins & Cotran Pathologic Basis of Disease (8th edición).
- Venturi, Sebastiano; Venturi, Mattia (1 de abril de 2009). «Iodine in Evolution of Salivary Glands and in Oral Health». Nutrition and Health (en inglés) 20 (2): 119-134. ISSN 0260-1060. doi:10.1177/026010600902000204. Consultado el 7 de mayo de 2021.
- Dreux, Alys C.; Lamb, David J.; Modjtahedi, Helmout; Ferns, Gordon A. A. (1 de mayo de 2006). «The epidermal growth factor receptors and their family of ligands: Their putative role in atherogenesis». Atherosclerosis (en inglés) 186 (1): 38-53. ISSN 0021-9150. PMID 16076471. doi:10.1016/j.atherosclerosis.2005.06.038. Consultado el 7 de mayo de 2021.
- «EGF receptor ligands». Experimental Cell Research (en inglés) 284 (1): 2-13. 10 de marzo de 2003. ISSN 0014-4827. doi:10.1016/S0014-4827(02)00105-2. Consultado el 7 de mayo de 2021.