Fosfato tripotásico
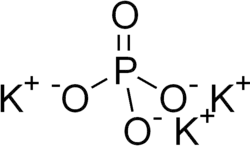
El fosfato tripotásico, también llamado fosfato tribásico de potasio[2] es una sal soluble en agua con la fórmula química K3PO4.(H2O)x (x = 0, 3, 7, 8).[3] El fosfato tripotásico es básico.
| Fosfato tripotásico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Fosfato de potasio | ||
| General | ||
| Otros nombres |
Fosfato tripotásico Fosfato de potasio tribásico Monofosfato de potasio | |
| Fórmula molecular | K3PO4 | |
| Identificadores | ||
| Número CAS | 7778-53-2[1] | |
| ChemSpider | 56408 | |
| PubChem | 62657 | |
| UNII | 16D59922JU | |
|
[O-]P(=O)([O-])[O-].[K+].[K+].[K+]
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco cristalino | |
| Densidad | 2564 kg/m³; 2,564 g/cm³ | |
| Masa molar | 2 122 663 g/mol | |
| Punto de fusión | 1340 °C (1613 K) | |
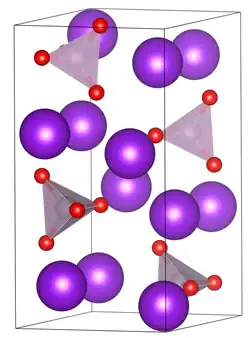
| Estructura cristalina | Ortorrómbico | |
| Propiedades químicas | ||
| Acidez | 12,32 pKa | |
| Solubilidad en agua | 508 g/L (a 25 °C) | |
| Peligrosidad | ||
| SGA |
  | |
| Compuestos relacionados | ||
| Otros fosfatos de potasio |
Fosfato dipotásico Fosfato monopotásico | |
| Otros fosfatos de sodio |
Fosfato trisódico Fosfato disódico Fosfato monosódico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Producción
El fosfato tripotásico se produce mediante la neutralización del ácido fosfórico con hidróxido de potasio:[3]
No es posible obtener fosfato tripotásico anhidro por cristalización de una disolución acuosa, pero el octahidrato puro se obtiene introduciendo amoniaco en la disolución.[4]
Propiedades
El fosfato tripotásico se disuelve en agua con una reacción alcalina. La forma anhidra cristaliza en el grupo espacial ortorrómbico Pnma (grupo espacial nº 62) con las constantes de red a = 1,123772 nm, b = 0,810461 nm y c = 0,592271 nm con cuatro unidades de fórmula cada una en una celda unitaria.[5] También hay una modificación a alta temperatura de esto con una estructura cúbica con a = 0,811 nm.[6]
Usos en la industria química
Los fosfatos se utilizan como aditivos en detergentes. Son capaces de reducir la dureza del agua formando complejos con iones metálicos polivalentes (Mg2+, etc.). Su uso ahora está prohibido en algunos países (incluida Suiza), debido a que producían fenómenos de eutrofización. Los fosfatos también se utilizan como fertilizantes minerales.
Se utiliza como regulador de la acidez en la industria alimentaria. Junto con el fosfato monopotásico (KH2PO4) y dipotásico (K2HPO4), está aprobado en la UE como aditivo alimentario con el número común E340 ("fosfato de potasio") para determinados alimentos con diferentes restricciones de cantidad máxima.
Referencias
- Número CAS
- «Potassium phosphate tribasic P5629». Sigma-Aldrich. Consultado el 27 de abril de 2018.
- «Phosphoric Acid and Phosphates». Wiley. 2008. doi:10.1002/14356007.a19_465.pub3.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry 2nd edition, volume 1, Academic Press 1963, página 545.
- V. I. Voronin et al. (2006-08). «Crystal Structure of the Low-Temperature Form of K3PO4». Inorganic Materials 42 (8): 908-913. doi:10.1134/S0020168506080206.
- R. Hoppe, H. M. Seyfert (1973-08). «Zur Kenntnis wasserfreier Orthophosphate derhöheren Alkalimetalle: K3PO4 Rb3PO4, Cs3PO4». Zeitschrift für Naturforschung B 28 (7–8): 507-508. doi:10.1515/znb-1973-7-828.