Fosfoenolpiruvato-proteína cinasa
La fosfoenolpiruvato-proteína cinasa (EC 2.7.3.9) es una enzima que cataliza la reacción:
- Fosfoenolpiruvato + proteína L-histidina piruvato + proteína N(pi)-fosfo-L-histidina
| Fosfoenolpiruvato-proteína cinasa | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.3 | |||
| Estructura/Función proteica | ||||
| Tipo de proteína | Cinasa | |||
| Funciones | Enzima | |||
| Ortólogos | ||||
| Especies |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Esta enzima actúa solamente en los residuos de histidina de proteínas específicas transportadoras del grupo fosfato de bajo peso molecular (9,5 kDa) y que participan en el transporte de azúcares en las bacterias.
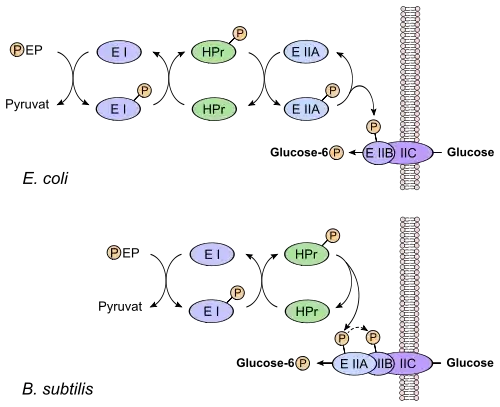
Sistema fosfotransferasa para azúcares
Las bacterias han evolucionado un mecanismo único para importar carbohidratos, el sistema fosfotransferasa para azúcares (PTS). El PTS sincroniza el transporte y fosforilación del azúcar utilizando algunas proteínas en una cascada de fosforilación de cinco etapas. Con algunas variaciones, el PTS tiene tres proteínas:
- En el citoplasma el fosfoenolpiruvato fosforila la fosfoenolpiruvato-proteína cinasa (Enzima I, EI) que transfiere el grupo fosforilo a la histidina de la proteína fosfotransportadora (HPr).
- Desde la HPr, el grupo fosforilo es transferido a los transportadores asociados a la membrana y específicos para los azúcares (Enzima II, EII).
- Cada transportador se compone de dos dominios citoplasmáticos (EIIA y EIIB) y un dominio integrado en la membrana (EIIC). En la EII, EIIA acepta el grupo fosforilo desde la HPr y se lo da a la EIIB, mientras que la EIIC media en la translocación del azúcar con la EIIB proporcionando el grupo fosforilo. La EIIB es la enzima proteína-N(pi)-fosfohistidina azúcar fosfotransferasa (EC 2.7.1.69).
Aparte de controlar la translocación de azúcares, el estado de fosforilación de las proteínas del PTS está también asociado con la regulación de rutas metabólicas y de señalización en las células bacterianas.
Características de la fosfoenolpiruvato-proteína cinasa
La fosfoenolpiruvato-proteína cinasa (EI) es un homodímero de ~64 kDa que requiere Mg2+ para su funcionamiento. Cada subunidad tiene tres dominios:
- El fosfoenolpiruvato se une al dominio C-terminal adoptando éste una configuración barril alfa/beta.
- La HPr se une al dominio N-terminal, un haz de hélices alfa.
- El dominio central está unido al dominio N-terminal por dos conectores y al dominio C-terminal por una hélice alfa larga. El dominio central contiene el residuo histidina (His-189) que es fosforilado.
Clasificación
Se ha demostrado que una serie de enzimas que catalizan la transferencia de un grupo fosforilo desde el fosfoenolpiruvato vía un intermedio fosfo-histidina están estructuralmente relacionadas:
- Piruvato, fosfato dicinasa (PPDK). La PPDK cataliza la fosforilación reversible del piruvato y el fosfato por el ATP a fosfoenolpiruvato. En las plantas la PPDK cataliza en la dirección del fosfoenolpiruvato, que es el principal aceptor de dióxido de carbono en las plantas de metabolismo C4 y de metabolismo ácido de las crasuláceas. En algunas bacterias como la Bacteroides symbiosus, la PPDK funciona en la dirección de la síntesis de ATP.
- Piruvato, agua dicinasa. Esta enzima cataliza la fosforilación reversible del piruvato por el ATP para formar fosfoenolpiruvato. Esta es una etapa esencial en la gluconeogénesis cuando el piruvato y el lactato son usados como fuentes de carbono.
- Fosfoenolpiruvato-proteína cinasa. Esta es la primera enzima del sistema fosfotransferasa para azúcares (PTS).
Todas estas enzimas comparten el mismo mecanismo catalítico, se unen al fosfoenolpiruvato y transfieren su grupo fosforilo a un residuo de histidina. La secuencia alrededor de este residuo está muy conservada.