Célula glial radial
Una célula glial radial es una célula con forma bipolar que abarca todo el ancho de la corteza en el desarrollo embrionario del sistema nervioso central (SNC) y que sirve como progenitor primario capaz de generar neuronas, astrocitos y oligodendrocitos.
| Célula radial glial | ||
|---|---|---|
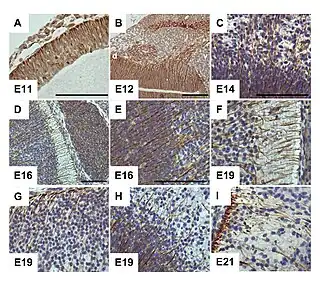 Células radiales gliales en el cerebro murino embrionario, mediante el receptor G-CSF.[1] | ||
| Nombre y clasificación | ||
| Latín | gliocytus radialis | |
| TH | H3.11.08.3.01098 | |
| TH | H3.11.08.3.01098 | |
|
| ||
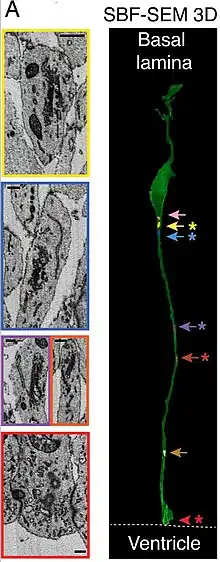
Durante su desarrollo, las neuronas recién nacidas usan la glía como andamiaje viajando a lo largo de las fibras radiales gliales para llegar a sus destinos finales.[2][3] Sin importar la suerte que tenga la población de glía radial, se ha demostrado por medio de análisis clonal que la mayor parte de la glía radial tiene destinos unipotenciales o multipotenciales restringidos. La glía radial se puede encontrar durante la fase neurogénica en todos los vertebrados.[4]
El término "glía radial" se refiere a las características morfológicas de las primeras células de este tipo que fueron observadas, es decir, los procesos (prolongaciones) radiales y su similitud con los astrocitos, otro miembro de la familia de las células gliales.[5]
Descubrimiento
Camillo Golgi, utilizando su técnica de tinción con plata (posteriormente llamada el método de Golgi), describió por primera vez células orientadas de forma radial localizadas desde canal central hasta la superficie exterior de la médula espinal del pollo en 1885.[6]
Usando el método de Golgi, Giuseppe Magini estudió posteriormente la corteza cerebral del feto en mamíferos en 1888, confirmando así la presencia de células con esta morfología en la corteza (también descrito con anterioridad por Kölliker). Observó "varias varices o hinchazones" en las fibras radiales. Intrigado, Magini también observó que el tamaño y número de estas varices incrementaba más tarde en el desarrollo y estaba ausentes en el sistema nervioso adulto. Basándose en estos hallazgos, Magini planteó la hipótesis de que estas varices podrían ser neuronas en desarrollo. Utilizando una combinación de los métodos de Golgi y de tinción con hematoxilina, Magini pudo identificar a estas varices como células, algunas de las cuales estaban fuertemente relacionadas con las fibras radiales.[6]
Adicionalmente otros trabajos previos fueron importantes para dilucidar la identidad y función de la glía radial, como los realizados por Santiago Ramón y Cajal, quien en un principio sugirió que las células radiales eran un tipo de glía dada su similitud con los astrocitos,[5] y los realizados por Wilhelm His, quien también propuso que los axones en crecimiento podrían utilizar a las células radiales para orientarse y guiarse durante el desarrollo.[6]
A pesar del periodo de interpes inicial en la glía radial, poca se aprendió de estas células hasta que la microscopía electrónica y las técnicas inmunohistoquímicas estuvieron disponibles 60 años después.[6]
Origen
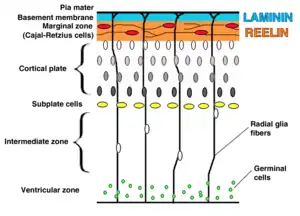
Las células gliales radiales tienen su origen a partir de la transformación de las células neuroepiteliales que conforman la placa neural durante las etapas tempranas de neurogénesis prenatal.[5][7] Este proceso es mediado por la disminución de la expresión de proteínas relacionadas con el epitelio (tales como las uniones estrechas) y el aumento de características específicas de glía como lo son los granulos de glucógeno, el transportador astrocítico de glutamato (GLAST), vimentina (una proteína que conforma los filamentos intermedios) y en algunos casos, incluyendo en humanos, la proteína ácida fibrilar glial (GFAP).[4]
Después de esta transición, la glía radial conserva mucha de las características originales de las células neuroepiteliales que incluyen: su polaridad apical-basal, su localización a lo largo de los ventrículos laterales de la corteza en desarrollo y la migración de su núcleo dependiendo del punto del ciclo celular en el que se encuentran (fenómeno denominado migración nuclear intercinética).[7][8]
Funciones
Progenitores
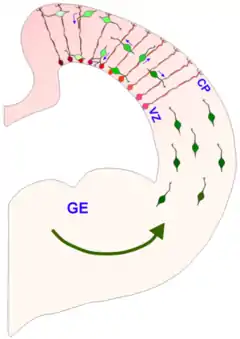
Las células gliales radiales son ya reconocidas como células progenitoras clave en el desarrollo del sistema nervioso. Durante las etapas tardías de la neurogénesis, las células gliales radiales se dividen de manera asimétricaen la zona ventricular generando de esta manera nuevas células gliales radiales, así como una neurona postmitótica o un progenitor intermediario (IPC por sus siglas en inglés) como células hija. Las células progenitoras intermediarias posteriormente se dividen simétricamente en la zona subventricular para generar más neuronas.[8] Estímulos ambientales locales como la señalización con Notch y el factor de crecimiento de fibroblastos (FGF), el periodo de desarrollo, y las diferentes habilidades de la glía radial para responder a estos estímulos locales han demostrado influir en el tipo de glía radial y de cpelulas hijas de glía radial que se producirán. La señalización con FGF y Notch regula la proliferación de la glía radial y la tasa de neurogénesis, la cual influye en la expansión del área de superficie de la corteza cerebral y en su capacidad de formar convoluciones cerebrales (también conocidos como giros cerebrales), proceso conocido como girificación.[7][9][10] Estudios recientes sugieren que los estímulos procedentes del ambiente exterior pueden también influir en la proliferación y diferenciación de la glía radial.[7][11]
Al concluir el desarrollo cortical, la mayoría de la glía radial pierde su adhesión a los ventrículos y migra hacia la superficie de la corteza cerebral donde, en mamíferos, la mayoría de estas células se convierten en astrocitos durante el proceso de gliogénesis.[8]
Aunque se ha sugerido que es muy probable que la glía radial da lugar a la formación de oligodendrocitos, a través de la generación de células progenitoras de oligodendrocitos (OPCs), y a pesar de que es posible generar OPCs a partir de células gliales radiales in vitro, se requiere de más información para concluir que este proceso sucede durante el desarrollo del cerebro.[8][12]
Recientemente, se ha descubierto glía radial que genera únicamente neuronas corticales de la capa superior.[5] Puesto que las capas corticales superiores se han expandido enormemente recientemente, y están asociadas con el procesamiento de información de alto nivel y el pensamiento, las células gliales radiales se han considerado como importantes mediadores de la evolución del cerebro.[13]
Guía de los axones
La primera función de la glía radial mejor caracterizada y ampliamente aceptada es la de andamiaje para la migración neuronal en las cortezas cerebral y cerebelar. Esta función puede visualizarse fácilmente por medio de un microscopio electrónico o microscopía de lapso de tiempo de alta resolución, a través de lo cual se puede visualizar a las neuronas envolviendo a la glía radial conforme viajan hacia la corteza.[5] Evidencia adicional sugiere que muchas neuronas podrían moverse entre las fibras radiales vecinas durante la migración.[7]
Aunque la migración neuronal excitatoria es en gran parte radial, se ha demostrado que las neuronas GABAérgicas inhibidoras se someten a migración tangencial. Las neuronas que migran de manera tangencial, aparentemente, también hacen contacto con las fibras gliales radiales en la corteza en desarrollo en hurones, lo cual relaciona a las células gliales radiales en ambas formas de migración.[7]
Conforme la glía radial se diferencia en la etapa tardía del desarrollo de la médula espinal, cerca del comienzo de la gliogénesis. Aún no es claro si la glía radial está involucrada en la neurogénesis en la médula espinal o la migración.[5]
Compartimentalización
También se ha demostrado que la glía radial está involucrada en la formación de límites entre los diferentes tractos de los axones y las áreas de sustancia blanca en el cerebro.[5][14]
Subtipos de la glía radial
Glía de Müller
Las glías de Müller son células gliales radiales que están presentes en la retina en desarrollo así como en la etapa adulta. Así como en la corteza, la glía de Müller posee procesos (prolongaciones) que abarcan en toda su extensión a la retina, desde la capa celular basal a la capa apical. Sin embargo, a diferencia de la glía radial cortical, la glía de Müller no se presenta en la retina hasta después de las primeras rondas de neurogénesis. Algunos estudios sugieren que la glía de Müller se puede diferenciar en progenitores neurales listos para dividirse en respuesta a una lesión.[7]
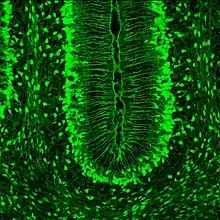
Las características que realmente diferencian a la glía de Müller de la glía radial en otras áreas del cerebro son sus propiedades ópticas. La mayor parte de la retina dispersa la luz en gran parte, lo que sugiere que la glía de Müller funciona como la principal fibra responsable para la transmisión de luz a los fotorreceptores en la parte posterior de la retina. Las propiedades que ayudan a la glía de Müller a lograr esto incluyen un número limitado de mitocondrias (las cuales dispersan la luz), así como un arreglo interno de filamentos proteicos.[7]
La glía de Müller es el único tipo de macroglía en la retina, por lo que es responsable de muchas funciones de apoyo que normalmente realizan los astrocitos y oligodendrocitos en el resto del SNC.[7]
Glia de Bergmann
La glía de Bergmann se localiza en el cerebelo en donde se puede encontrar desde etapas muy tempranas en el desarrollo y desempeña un papel esencial en la migración de las células cerebelares de Purkinje y las células granulares cerebelares. La glía de Bergmann está caracterizada por múltiples ramificaciones radiales, contrario a los procesos únicos en la glia radial de otras áreas del cerebro, que se extienden a lo largo de la corteza cerebral. Puesto que la glía de Bergmann persiste en el cerebelo, y desempeña muchos papeles característicos de los astrocitos, también se conocen como "astrocitos especializados".[7] Además de su papel en el desarrollo temprano del cerebelo, la glía de Bergmann es necesaria para poda sináptica.[15]
Glía radial y enfermedad
Puesto que la glía radial funciona como progenitores primarios de neuronas y glía en el cerebro, y de la misma manera es crucial para la migración neuronal apropiada, los defectos en la función de la glía radial puede tener efectos profundos en el desarrollo del sistema nervioso.
Mutaciones en Lis1 o Nde1, proteínas esenciales para la diferenciación de la glía radial y su estabilización, provocan los desórdenes del desarrollo neural asociados: lisencefalia y microlisencefalia (que significa literalmente "cerebro blando"). Los pacientes con estas enfermedades se caracterizan por tener una falta de pliegues corticales (surcos y giros) y un volumen cerebral reducido. Los casos extremos de lisencefalia causan la muerte después de unos meses a partir del nacimiento, mientras que los pacientes con formas más tenues de lisenceflia pueden presentar retraso mental, déficit motor y del habla y epilepsia.
Véase también
- Migración neuronal
- Desarrollo de la corteza cerebral
Referencias
- Kirsch F, Krüger C, Schneider A (2008). «The receptor for granulocyte-colony stimulating factor (G-CSF) is expressed in radial glia during development of the nervous system». BMC Dev. Biol. 8: 32. PMC 2329616. PMID 18371196. doi:10.1186/1471-213X-8-32.
- Rakic, P (mayo de 1972). «Mode of cell migration to the superficial layers of fetal monkey neocortex.». The Journal of comparative neurology 145 (1): 61-83. PMID 4624784.
- Rakic, P (octubre de 2009). «Evolution of the neocortex: a perspective from developmental biology.». Nature reviews. Neuroscience 10 (10): 724-35. PMID 19763105.
- Malatesta, P; Appolloni, I; Calzolari, F (Jan 2008). «Radial glia and neural stem cells.». Cell and tissue research 331 (1): 165-78. PMID 17846796. doi:10.1007/s00441-007-0481-8.
- Barry, DS; Pakan, JM; McDermott, KW (Jan 2014). «Radial glial cells: key organisers in CNS development.». The international journal of biochemistry & cell biology 46: 76-9. PMID 24269781. doi:10.1016/j.biocel.2013.11.013.
- Bentivoglio, M; Mazzarello, P (15 de julio de 1999). «The history of radial glia.». Brain Research Bulletin 49 (5): 305-15. PMID 10452351. doi:10.1016/s0361-9230(99)00065-9.
- Sild, M; Ruthazer, ES (Jun 2011). «Radial glia: progenitor, pathway, and partner.». The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry 17 (3): 288-302. PMID 21558559. doi:10.1177/1073858410385870.
- Kriegstein, A; Alvarez-Buylla, A (2009). «The glial nature of embryonic and adult neural stem cells.». Annual review of neuroscience 32: 149-84. PMC 3086722. PMID 19555289. doi:10.1146/annurev.neuro.051508.135600.
- Rash, BG; Lim, HD; Breunig, JJ; Vaccarino, FM (26 de octubre de 2011). «FGF signaling expands embryonic cortical surface area by regulating Notch-dependent neurogenesis.». The Journal of neuroscience : the official journal of the Society for Neuroscience 31 (43): 15604-17. PMID 22031906.
- Rash, BG; Tomasi, S; Lim, HD; Suh, CY; Vaccarino, FM (26 de junio de 2013). «Cortical gyrification induced by fibroblast growth factor 2 in the mouse brain.». The Journal of neuroscience : the official journal of the Society for Neuroscience 33 (26): 10802-14. PMID 23804101.
- Sharma, P; Cline, HT (4 de noviembre de 2010). «Visual activity regulates neural progenitor cells in developing xenopus CNS through musashi1.». Neuron 68 (3): 442-55. PMC 3005332. PMID 21040846. doi:10.1016/j.neuron.2010.09.028.
- Mo, Z; Zecevic, N (Apr 1, 2009). «Human fetal radial glia cells generate oligodendrocytes in vitro.». Glia 57 (5): 490-8. PMC 2644732. PMID 18814269. doi:10.1002/glia.20775.
- «Scripps Research Neuroscientists Find Brain Stem Cells that May Be Responsible for Higher Functions, Bigger Brains». Scripps Research Institute. Consultado el 1 de marzo de 2014.
- Steindler, DA (1993). «Glial boundaries in the developing nervous system.». Annual review of neuroscience 16: 445-70. PMID 8460899. doi:10.1146/annurev.ne.16.030193.002305.
- «Bergmann Glial Cell». 14 de octubre de 2011. Consultado el 10 de septiembre de 2014.
Enlaces externos
- Esta obra contiene una traducción derivada de «Radial glial cell» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.