Glutatión S-transferasa
Las Glutatión S-transferasas (GST) son una familia de isoenzimas metabólicas eucariotas y procariotas de fase II, conocidas por su capacidad para catalizar la conjugación de forma reducida de glutatión a sustratos xenobióticos con fines de desintoxicación. La familia consta de tres superfamilias: proteínas citosólicas, mitocondriales y microsómicas.[1][2] Los miembros de las GST son extremadamente diversos en su secuencia de aminoácidos. Una porción considerable de las secuencias que constan en las bases de datos públicas tienen una función aún desconocida.[3]
| Glutatión S-transferasa | ||||
|---|---|---|---|---|
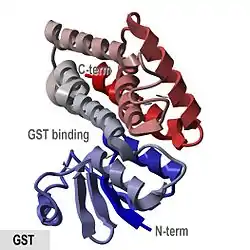 Estructura cristalográfica de la glutatión S-transferasa de Anopheles cracens. | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.5.1.18 | |||
| Número CAS | 50812-37-8 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Las glutatión S-transferasas pueden constituir hasta el 10% de la proteína citosólica en algunos órganos de los mamíferos.[4][5] Catalizan la conjugación de glutatión, a través de un tiol, con centros electrofílicos de una amplia variedad de sustratos, aumentando la solubilidad en agua de los compuestos.[6][7] Su actividad desintoxica compuestos endógenos como lípidos oxidados y permite la descomposición de los xenobióticos. También pueden unirse a las toxinas y funcionar como proteínas de transporte, lo cual dio lugar a su primera denominación, ligandinas.[8][9]
Clasificación
La secuencia y estructura de proteínas son criterios fundamentales para la clasificación de las tres superfamilias (citosólicas, mitocondriales y microsómicas) de Glutatión S-transferasas: Las clases de la familia citosólica poseen más del 40% secuencias homólogas en comparación con las demás, que tienen menos del 25%. Las GST citosólicas se dividen en 13 clases según su estructura: alfa, beta, delta, épsilon, zeta, theta, mu, nu, pi, sigma, tau, phi y omega. Las mitocondriales se encuentran en la clase kappa. Las microsómicas constan de subgrupos designados del I al IV, entre los cuales las secuencias de aminoácidos comparten menos del 20% de homología.
Las glutatión S-transferasas presentes en humanos pertenecen a las clases alfa, zeta, theta, mu, pi, sigma y omega. También se tiene constancia de la existencia de seis isoenzimas de las clases I, II y IV.[7][10][11]
Nomenclatura
La primera nomenclatura estandarizada para identificar a las glutatión S-transferasas fue propuesta en 1992. En ella, primero se identifica con una letra minúscula la especie a la que pertenece la isoenzima objeto de estudio (por ejemplo, "h" para humanos), seguida de la abreviatura GST. A continuación, la clase se identifica con una letra mayúscula (por ejemplo, "A" para alfa), seguida del número representativo de la subfamilia. Dado que tanto los GST mitocondriales como los citosólicos existen como dímeros y solo se forman heterodímeros entre miembros de la misma clase, el segundo componente de la subfamilia del dímero enzimático se denota con un guion, seguido de otro número adicional. Por tanto, si una GST humana es un homodímero de la subfamilia de clase Pi 1, su nombre se escribirá como «hGSTP1-1».
La nomenclatura temprana para los GST se refirió a ellos como proteínas "Y", refiriéndose a su separación en la fracción "Y" (a diferencia de las fracciones "X y Z") utilizando la cromatografía de Sephadex G75.[12] A medida que se iban identificando nuevas subunidades, estas se iban nombrando con la denominación Ya, Yp, etc. Si era necesario, este se acompañaba de un número identificativo de la isoforma del monómero (por ejemplo, Yb1).
En el ámbito de la química clínica y la toxicología, los términos αGST, μGST y πGST son los más utilizados.
Estructura
El sitio de unión al glutatión, o "Sitio G", se encuentra en el dominio similar al de la tiorredoxina en las glutatión S-transferasas citosólicas y mitocondriales. La región que contiene la mayor variabilidad entre las clases es la de la hélice α2, donde uno de los tres residuos de aminoácidos diferentes interactúa con el residuo de glicina del glutatión. Se han caracterizado dos subgrupos de GST citosólicos en función de su interacción con el glutatión: el grupo Y-GST, que utiliza residuo de tirosina para activar el glutatión, y el S/C-GST, que en su lugar utiliza residuos de serina o cisteína.[7][3]
Las enzima porcinas de de clase pi pGTSP1-1 fue la primera GST en tener su estructura determinada, y es representativa de otros miembros de la superfamilia GST citosólica, que contienen un dominio similar a las tiorredoxinas N-terminales así como un dominio C-terminal que consiste en hélices alfa.[7][13]
Las GST citosólicas de los mamíferos son dímericas, con ambas subunidades pertenecientes a la misma clase, aunque no necesariamente idénticas. Los monómeros tienen un tamaño de aproximadamente 25 kDa.[10][14] Están activos sobre una amplia variedad de sustratos con una superposición considerable.[15]
En la siguiente tabla se enumeran todas las enzimas GST de cada clase de las que se tiene constancia de su existencia en humanos en el repositorio UniProt.
| Clases de GST | GST miembros de la clase en Homo sapiens (22) |
|---|---|
| Alfa | GSTA1, GSTA2, GSTA3, GSTA4, GSTA5 |
| Delta | |
| Kappa | GSTK1 |
| Mu | GSTM1, GSTM1L (RNAi), GSTM2, GSTM3, GSTM4, GSTM5 |
| Omega | GSTO1, GSTO2 |
| Pi | GSTP1 |
| Theta | GSTT1, GSTT2, GSTT4 |
| Zeta | GSTZ1 (MAAI-Maleylacetoacetato isomerasa) |
| Microsómicas | MGST1, MGST2, MGST3 |
Función
La actividad de las glutatión S-transferasas depende de un suministro constante de glutatión de las enzimas sintéticas ligasa glutamato-cisteína y glutatión sintetasa, así como de la acción de transportadores específicos para eliminar conjugados de glutatión de la célula. El papel principal de las GST es desintoxicar los xenobióticos catalizando el ataque nucleófilo por glutatión en átomos electrófilos de carbono, azufre o nitrógeno de dichos sustratos xenobióticos no polares, evitando así su interacción con proteínas celulares cruciales y ácidos nucleicos.[11][16] En este cometido, su función es doble: unirse tanto al sustrato en el sitio hidrofóbico H de la enzima como al glutatión en el sitio G hidrofílico adyacente, que juntos forman el sitio activo de la enzima; y posteriormente activar el grupo tiol del glutatión, permitiendo el ataque nucleofílico al sustrato.[10] La molécula de glutatión se une en una hendidura entre los dominios terminales N y C; los residuos catalíticamente importantes residen en el dominio terminal N.[17] Ambas subunidades del dímero, ya sean de naturaleza heterodimérica u homodimérica, contienen un solo sitio de unión sin sustratos, así como un sitio de unión al glutatión. Sin embargo, en GST complejas heterodiméricos como las formados por las clases citosólicas mu y alfa, la hendidura entre las dos subunidades alberga un sitio adicional de unión xenobiótica sin sustrato de alta afinidad, que puede explicar la capacidad de las enzimas para formar heterodímeros.[16][18]
Los compuestos a los que se dirigen de esta forma las glutatión S-transferasas abarcan una amplia gama de toxinas ambientales o exógenas de todo tipo, incluyendo agentes quimioterapéuticos y otros medicamentos, pesticidas, herbicidas, carcinógenos, y epóxidos derivados de forma variable. De hecho, las GST son responsables de la conjugación de β1-8,9-epóxido, un intermediario reactivo formado por aflatoxina B1, que es un medio crucial de protección contra la toxina en roedores. Las reacciones de desintoxicación comprenden los primeros cuatro pasos de la síntesis de ácido mercaptúrico,[16] con la conjugación a glutatión que sirve para hacer que los sustratos sean más solubles y permitir que sean eliminados de la célula por transportadores como la proteína 1 multirresistente (MRP1).[7] Después de la exportación, los aductos se convierten en ácidos mercaptúricos y se excretan a través de orina o bilis.[11]
La mayoría de las isoenzimas de mamíferos tienen afinidad por el sustrato 1-cloro-2,4-dinitrobenceno, y los ensayos espectrofotométricos que utilizan este sustrato se utilizan comúnmente para informar sobre la actividad de las GST.[19] Sin embargo, algunos compuestos endógenos, por ejemplo, la bilirrubina, pueden inhibir la actividad de las GST. En los mamíferos, las isoformas tienen distribuciones específicas de las células (por ejemplo, α-GST en los hepatocitos y π-GST en el tracto biliar del hígado humano).[20] Las glutatión S-transferasas también tienen un papel en la bioactivación del profármaco clopidogrel.[21]
Rol en la comunicación celular
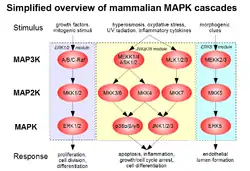
Aunque son más conocidos por su capacidad para conjugar xenobióticos con glutatión y con ello desintoxicar los entornos celulares, las Glutatión S-transferasas también son capaces de unirse a ligandos de no sustrato, con importantes implicaciones en la comunicación celular. Se ha demostrado que las isoenzimas GST de varias clases inhiben la función de la quinasa involucrada en la vía MAPK/ERK que regula la proliferación celular y la muerte celular programada, evitando que la quinasa lleve a cabo su cometido en facilitar la comunicación.[22]
La GSTP1-1 citosólica, una isoenzima de la familia de las Glutatión S-transferasas presente en mamíferos, se expresa principalmente en los tejidos cardíacos, pulmonares y cerebrales; de hecho, es la GST que se expresa de forma más común fuera del hígado.[22][23] Basándose en su sobreexpresión en la mayoría de las líneas celulares tumorales humanas y prevalencia en tumores resistentes a la quimioterapia, existen indicios de que la GSTP1-1 juega un papel en el desarrollo del cáncer y en su potencial resistencia al tratamiento con fármacos. Otra evidencia de esto se fundamenta en el conocimiento de que la GSTP1 puede inhibir selectivamente la fosforilación de C-Jun por las cinasas c-Jun N-terminal (JNK), previniendo la apoptosis.[22] Durante los momentos de bajo estrés celular, se forma un complejo a través de interacción proteína-proteína entre GSTP y el extremo C de las JNK, previniendo eficazmente la acción de estas y, por lo tanto, su inducción de la vía JNK. El estrés oxidativo celular causa la disociación del complejo, la oligomerización del GSTP y la inducción de la vía JNK, lo que resulta en apoptosis.[24] La conexión entre la inhibición del GSTP de la vía JNK proapoptótica y la sobreexpresión de la isoenzima en células tumorales farmacorresistentes puede explicar en sí misma la capacidad de las células tumorales para escapar de la apoptosis mediada por medicamentos que no son sustratos del GSTP.[22]
Al igual que la GSTP, la GSTM1 (GSTM1) está involucrada en la regulación de las vías apoptóticas a través de interacciones directas proteína-proteína, aunque actúa en ASK1, que está por encima de JNK. El mecanismo y el resultado son similares a los anteriormente decritos, ya que la GSTM1 secuestra ASK1 a través de formación compleja y evita su inducción de las porciones proapoptóticas p38 y JNK de la vía de comunicación MAPK. Al igual que el caso anterior, la GSTM1 interactúa con su pareja en ausencia de estrés oxidativo, aunque ASK1 también está involucrado en la respuesta al choque térmico, que también se previene durante el secuestro de ASK1. El hecho de que los altos niveles de GST estén asociados con la resistencia a la apoptosis inducida por una serie de sustancias, incluidos los agentes quimioterapéuticos, apoya su supuesto papel en la prevención de la comunicación MAPK.[24]
Así, la investigación ha acrecentado la evidencia de que las Glutatión S-transferasas, y en particular la GSTP están involucradas en el desarrollo del cáncer y en la resistencia quimioterapéutica. El vínculo entre el GSTP y el cáncer es más evidente en la sobreexpresión del GSTP en muchos cánceres, pero también está respaldado por el hecho de que el fenotipo transformado de células tumorales está asociado con vías de quinasa reguladas aberrantemente y la adicción celular a proteínas sobreexpresadas. El hecho de que la mayoría de los medicamentos contra el cáncer sean sustratos pobres para GSTP indica que el papel del GSTP elevado en muchas líneas celulares tumorales no es desintoxicar los compuestos, sino que debe tener otro propósito; esta hipótesis también es acreditada por el hallazgo común de sobreexpresión de GSTP en líneas celulares tumorales que no son resistentes a fármacos.[25]
Importancia clínica
Además de sus funciones en el desarrollo del cáncer y en la resistencia a los medicamentos quimioterapéuticos, los GST están implicados en una variedad de enfermedades en función de su participación en el glutatión. Aunque las pruebas son mínimas para la influencia de polimorfismos de las GST de las clases alfa, mu, pi y theta sobre la susceptibilidad a varios tipos de cáncer, numerosos estudios han implicado tales variaciones genotípicas en asma, aterosclerosis, alergias, y otras enfermedades inflamatorias.[16]
Debido a que la diabetes es una enfermedad que implica daño oxidativo, y el metabolismo del glutatión es disfuncional en pacientes diabéticos, las glutatión S-transferasas pueden ser un objetivo potencial para los fármacos que tratan esta enfermedad. Además, se sabe que la administración de insulina resulta en un aumento de la expresión génica de las GST a través de las vías PI3K/AKT/mTOR y la reducción del estrés oxidativo intracelular, mientras que el glucagón disminuye dicha expresión génica.[26]
En particular, los genes GST de clase omega (GSTO) están asociados con enfermedades neurológicas como el Alzheimer, el Parkinson y la esclerosis lateral amiotrófica. Una vez más, se cree que el estrés oxidativo es el culpable, con una disminución de la expresión génica GSTO que resulta en una menor edad de inicio de las enfermedades.[27]
Liberación de glutatión S-transferasas como indicador de daño orgánico
Las altas concentraciones intracelulares de glutatión S-transferasas junto con su distribución celular específica les permiten funcionar como biomarcadores para localizar y monitorizar lesiones a tipos celulares definidos. Por ejemplo, los hepatocitos contienen altos niveles de αGST y ha demostrado que el αGST sérico es un indicador de lesión de hepatocitos en trasplantes de hígado, toxicidad e infecciones virales.[28][29][30]
Del mismo modo, en los seres humanos las células tubulares proximales renales contienen altas concentraciones de αGST, mientras que las células tubulares distales contienen πGST.[31] Esta distribución específica permite utilizar la medición de las GST urinarias para cuantificar y localizar la lesión tubular renal en trasplantes de riñón, nefrotoxicidad y lesiones isquémicas.[32]
En estudios preclínicos en roedores, la αGST urinaria y sérica han demostrado ser indicadores sensibles y específicos de necrosis tubular proximal renal y hepatocitaria, respectivamente.[33][34]
Marcadores y ensayos de immunoprecipitación
Las glutatión S-transferasas se puede agregar a una proteína de interés para purificarla de una solución en un proceso conocido como inmunoprecipitación. Esto se logra insertando la secuencia de codificación de ADN GST junto a la que codifica para la proteína de interés. Por lo tanto, después de la transcripción y traducción, la proteína GST y la proteína de interés se expresarán juntas como proteínas de fusión. Debido a que la proteína GST tiene una fuerte afinidad de unión por glutatión, las cuentas recubiertas con el compuesto se pueden agregar a la mezcla de proteínas. Como resultado, la proteína de interés unida a la GST se pegará a ellas, aislando la proteína del resto de las que están en solución. Estas se recuperan y lavan con GSH libre para separarlas de la proteína de interés, lo que resulta en una proteína purificada. Esta técnica se puede utilizar para dilucidar las interacciones directas proteína-proteína. Un inconveniente de este ensayo es que la proteína de interés está unida a la GST, alterando su estado nativo.[35][36]
Los marcadores GST se usan habitualmente para separar y purificar proteínas que contienen la proteína de fusión GST. El marcador contiene 220 aminoácidos (un tamaño aproximado de 26 kDa),[37], lo cual lo hace bastante grande en comparación con otros marcadores como Myc-tag o FLAG-tag. Se puede fusionar con el N-terminal o C-terminal de una proteína. Además de funcionar como un marcador de purificación, la GST actúa como acompañante para la proteína adherida, promoviendo su correcto plegamiento, así como evitando que se agregue en los cuerpos de inclusión cuando se expresa en bacterias. El marcador puede ser eliminado posteriormente mediante la adición de trombina proteasa si se ha insertado un sitio de división adecuado entre la etiqueta GST y la proteína de interés (que generalmente se incluye en muchas fuentes disponibles comercialmente de plásmidos etiquetados para GST).[35][38]
Véase también
- Cromatografía de inmunoafinidad
- Glutatión transferasa bacteriana
- Glutatión S-transferasa Mu 1
- GSTP1
- Marcadores proteicos
Referencias
- Sheehan D, Meade G, Foley VM, Dowd CA (Noviembre de 2001). «Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily». The Biochemical Journal 360 (Pt 1): 1-16. PMC 1222196. PMID 11695986. doi:10.1042/0264-6021:3600001.
- Allocati N, Federici L, Masulli M, Di Ilio C (Enero de 2009). «Glutathione transferases in bacteria». The FEBS Journal 276: 58-75. PMID 19016852. doi:10.1111/j.1742-4658.2008.06743.x.
- Atkinson HJ, Babbitt PC (Noviembre de 2009). «Glutathione transferases are structural and functional outliers in the thioredoxin fold». Biochemistry 48 (46): 11108-16. PMC 2778357. PMID 19842715. doi:10.1021/bi901180v.
- Boyer TD (Marzo de 1989). «The glutathione S-transferases: an update». Hepatology 9 (3): 486-96. PMID 2646197. S2CID 85179401. doi:10.1002/hep.1840090324.
- Mukanganyama S, Bezabih M, Robert M, Ngadjui BT, Kapche GF, Ngandeu F, Abegaz B (Agosto de 2011). «The evaluation of novel natural products as inhibitors of human glutathione transferase P1-1». Journal of Enzyme Inhibition and Medicinal Chemistry 26 (4): 460-7. PMID 21028940. S2CID 41391243. doi:10.3109/14756366.2010.526769.
- Douglas KT (1987). «Mechanism of action of glutathione-dependent enzymes». Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology and Related Areas of Molecular Biology 59. pp. 103-67. ISBN 9780470123058. PMID 2880477. doi:10.1002/9780470123058.ch3.
- Oakley A (Mayo de 2011). «Glutathione transferases: a structural perspective». Drug Metabolism Reviews 43 (2): 138-51. PMID 21428697. S2CID 16400885. doi:10.3109/03602532.2011.558093.
- Leaver MJ, George SG (1998). «A piscine glutathione S-transferase which efficiently conjugates the end-products of lipid peroxidation». Marine Environmental Research 46 (1–5): 71-74. doi:10.1016/S0141-1136(97)00071-8.
- Litwack G, Ketterer B, Arias IM (Diciembre de 1971). «Ligandin: a hepatic protein which binds steroids, bilirubin, carcinogens and a number of exogenous organic anions». Nature 234 (5330): 466-7. Bibcode:1971Natur.234..466L. PMID 4944188. S2CID 4216672. doi:10.1038/234466a0.
- Eaton DL, Bammler TK (Junio de 1999). «Concise review of the glutathione S-transferases and their significance to toxicology». Toxicological Sciences 49 (2): 156-64. PMID 10416260. doi:10.1093/toxsci/49.2.156.
- Josephy PD (Junio de 2010). «Genetic variations in human glutathione transferase enzymes: significance for pharmacology and toxicology». Human Genomics and Proteomics 2010: 876940. PMC 2958679. PMID 20981235. doi:10.4061/2010/876940.
- Levi AJ, Gatmaitan Z, Arias IM (Noviembre de 1969). «Two hepatic cytoplasmic protein fractions, Y and Z, and their possible role in the hepatic uptake of bilirubin, sulfobromophthalein, and other anions». The Journal of Clinical Investigation 48 (11): 2156-67. PMC 297469. PMID 4980931. doi:10.1172/JCI106182.
- Park AK, Moon JH, Jang EH, Park H, Ahn IY, Lee KS, Chi YM (Marzo de 2013). «The structure of a shellfish specific GST class glutathione S-transferase from antarctic bivalve Laternula elliptica reveals novel active site architecture». Proteins 81 (3): 531-7. PMID 23152139. S2CID 45431154. doi:10.1002/prot.24208.
- Landi S (Octubre del 2000). «Mammalian class theta GST and differential susceptibility to carcinogens: a review». Mutation Research 463 (3): 247-83. PMID 11018744. doi:10.1016/s1383-5742(00)00050-8.
- Raza H (Noviembre de 2011). «Dual localization of glutathione S-transferase in the cytosol and mitochondria: implications in oxidative stress, toxicity and disease». The FEBS Journal 278 (22): 4243-51. PMC 3204177. PMID 21929724. doi:10.1111/j.1742-4658.2011.08358.x.
- Hayes JD, Flanagan JU, Jowsey IR (2005). «Glutathione transferases». Annual Review of Pharmacology and Toxicology 45: 51-88. PMID 15822171. doi:10.1146/annurev.pharmtox.45.120403.095857.
- Nishida M, Harada S, Noguchi S, Satow Y, Inoue H, Takahashi K (Agosto de 1998). «Three-dimensional structure of Escherichia coli glutathione S-transferase complexed with glutathione sulfonate: catalytic roles of Cys10 and His106». Journal of Molecular Biology 281: 135-47. PMID 9680481. doi:10.1006/jmbi.1998.1927.
- Vargo MA, Colman RF (Enero de 2001). «Affinity labeling of rat glutathione S-transferase isozyme 1-1 by 17β-iodoacetoxy-estradiol-3-sulfate». The Journal of Biological Chemistry 276 (3): 2031-6. PMID 11031273. doi:10.1074/jbc.M008212200.
- Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby WB (Octubre de 1974). «The identity of glutathione S-transferase B with ligandin, a major binding protein of liver». Proceedings of the National Academy of Sciences of the United States of America 71 (10): 3879-82. Bibcode:1974PNAS...71.3879H. PMC 434288. PMID 4139704. doi:10.1073/pnas.71.10.3879.
- Beckett GJ, Hayes JD (1987). «Glutathione S-transferase measurements and liver disease in man». Journal of Clinical Biochemistry and Nutrition 2: 1-24. doi:10.3164/jcbn.2.1.
- Alkattan A, Alsalameen E. (30 de abril de 2021). «Polymorphisms of genes related to phase-I metabolic enzymes affecting the clinical efficacy and safety of clopidogrel treatment.». Expert Opin Drug Metab Toxicol. PMID 33931001. doi:10.1080/17425255.2021.1925249.
- Laborde E (Septiembre de 2010). «Glutathione transferases as mediators of signaling pathways involved in cell proliferation and cell death». Cell Death and Differentiation 17 (9): 1373-80. PMID 20596078. doi:10.1038/cdd.2010.80.
- Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, Tew KD, Pincus MR, Sardana M, Henderson CJ, Wolf CR, Davis RJ, Ronai Z (Marzo de 1999). «Regulation of JNK signaling by GSTp». The EMBO Journal 18 (5): 1321-34. PMC 1171222. PMID 10064598. doi:10.1093/emboj/18.5.1321.
- Townsend DM, Tew KD (Octubre de 2003). «The role of glutathione-S-transferase in anti-cancer drug resistance». Oncogene 22 (47): 7369-75. PMC 6361125. PMID 14576844. doi:10.1038/sj.onc.1206940.
- Tew KD, Manevich Y, Grek C, Xiong Y, Uys J, Townsend DM (Julio de 2011). «The role of glutathione S-transferase P in signaling pathways and S-glutathionylation in cancer». Free Radical Biology & Medicine 51 (2): 299-313. PMC 3125017. PMID 21558000. doi:10.1016/j.freeradbiomed.2011.04.013.
- Franco R, Schoneveld OJ, Pappa A, Panayiotidis MI (2007). «The central role of glutathione in the pathophysiology of human diseases». Archives of Physiology and Biochemistry 113 (4–5): 234-58. PMID 18158646. S2CID 35240599. doi:10.1080/13813450701661198.
- Board PG (Mayo de 2011). «The omega-class glutathione transferases: structure, function, and genetics». Drug Metabolism Reviews 43 (2): 226-35. PMID 21495794. S2CID 27736207. doi:10.3109/03602532.2011.561353.
- Beckett GJ, Chapman BJ, Dyson EH, Hayes JD (Enero de 1985). «Plasma glutathione S-transferase measurements after paracetamol overdose: evidence for early hepatocellular damage». Gut 26 (1): 26-31. PMC 1432412. PMID 3965363. doi:10.1136/gut.26.1.26.
- Hughes VF, Trull AK, Gimson A, Friend PJ, Jamieson N, Duncan A, Wight DG, Prevost AT, Alexander GJ (Noviembre de 1997). «Randomized trial to evaluate the clinical benefits of serum alpha-glutathione S-transferase concentration monitoring after liver transplantation». Transplantation 64 (10): 1446-52. PMID 9392310. doi:10.1097/00007890-199711270-00013.
- Loguercio C, Caporaso N, Tuccillo C, Morisco F, Del Vecchio Blanco G, Del Vecchio Blanco C (Marzo de 1998). «Alpha-glutathione transferases in HCV-related chronic hepatitis: a new predictive index of response to interferon therapy?». Journal of Hepatology 28 (3): 390-5. PMID 9551675. doi:10.1016/s0168-8278(98)80311-5.
- Harrison DJ, Kharbanda R, Cunningham DS, McLellan LI, Hayes JD (Junio de 1989). «Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury». Journal of Clinical Pathology 42 (6): 624-8. PMC 1141991. PMID 2738168. doi:10.1136/jcp.42.6.624.
- Sundberg AG, Appelkvist EL, Bäckman L, Dallner G (1994). «Urinary pi-class glutathione transferase as an indicator of tubular damage in the human kidney». Nephron 67 (3): 308-16. PMID 7936021. doi:10.1159/000187985.
- Harpur E, Ennulat D, Hoffman D, Betton G, Gautier JC, Riefke B, Bounous D, Schuster K, Beushausen S, Guffroy M, Shaw M, Lock E, Pettit S (Agosto de 2011). «Biological qualification of biomarkers of chemical-induced renal toxicity in two strains of male rat». Toxicological Sciences 122 (2): 235-52. PMID 21593213. doi:10.1093/toxsci/kfr112.
- Bailey WJ, Holder D, Patel H, Devlin P, Gonzalez RJ, Hamilton V, Muniappa N, Hamlin DM, Thomas CE, Sistare FD, Glaab WE (Diciembre de 2012). «A performance evaluation of three drug-induced liver injury biomarkers in the rat: alpha-glutathione S-transferase, arginase 1, and 4-hydroxyphenyl-pyruvate dioxygenase». Toxicological Sciences 130 (2): 229-44. PMID 22872058. doi:10.1093/toxsci/kfs243.
- Benard V, Bokoch GM (2002). Assay of Cdc42, Rac, and Rho GTPase activation by affinity methods. «G Protein Pathways - Part C, Effector Mechanisms». Methods in Enzymology 345. pp. 349-59. ISBN 9780121822460. PMID 11665618. doi:10.1016/s0076-6879(02)45028-8.
- Ren L, Chang E, Makky K, Haas AL, Kaboord B, Walid Qoronfleh M (Noviembre de 2003). «Glutathione S-transferase pull-down assays using dehydrated immobilized glutathione resin». Analytical Biochemistry 322 (2): 164-9. PMID 14596823. doi:10.1016/j.ab.2003.07.023.
- Long F, Cho W, Ishii Y (Septiembre de 2011). «Expression and purification of 15N- and 13C-isotope labeled 40-residue human Alzheimer's β-amyloid peptide for NMR-based structural analysis». Protein Expression and Purification 79 (1): 16-24. PMC 3134129. PMID 21640828. doi:10.1016/j.pep.2011.05.012.
- Tinta T, Christiansen LS, Konrad A, Liberles DA, Turk V, Munch-Petersen B, Piškur J, Clausen AR (Junio de 2012). «Deoxyribonucleoside kinases in two aquatic bacteria with high specificity for thymidine and deoxyadenosine». FEMS Microbiology Letters 331 (2): 120-7. PMID 22462611. doi:10.1111/j.1574-6968.2012.02565.x.