Método de Gutmann-Beckett
El método de Gutmann-Beckett es un procedimiento experimental utilizado por los químicos para evaluar la acidez de Lewis de las especies moleculares. El óxido de trietilfosfina (Et3PO, TEPO) se utiliza como una molécula sonda y los sistemas son evaluados por espectroscopía de RMN de 31P.
| Ácidos y Bases | |
|---|---|
 | |
| Ácidos y Bases | |
| |
| Tipos de ácidos | |
| Tipos de bases | |
Gutmann (1975) utilizó la espectroscopía de RMN de 31P para parametrizar la acidez de Lewis de los disolventes por números de aceptadores.[1] Beckett (1996) reconoció su utilidad más general y adaptó el procedimiento para que pudiera aplicarse fácilmente a las especies moleculares cuando se disuelve en solventes ácidos de Lewis débilmente.[2] El término método de Gutmann-Beckett se utilizó por primera vez en la literatura química en 2007.[3]
El profesor Dr. Viktor Gutmann (1921–98) fue un eminente químico austriaco conocido por su trabajo sobre solventes no acuosos. El profesor Michael A. Beckett fue director de la Escuela de Química de la Universidad de Bangor, Reino Unido.
Aplicación a boranos
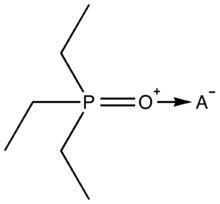
El desplazamiento químico 31P(δ) de Et3PO es sensible al entorno químico, pero generalmente se puede encontrar entre +40 y +100 ppm. El átomo de O en Et3PO es una base de Lewis, y su interacción con los sitios ácidos de Lewis causa el deshecho del átomo de P adyacente. Gutmann describió una escala de Número de Aceptador (AN) para la acidez de Lewis del disolvente [4] con dos puntos de referencia relacionados con el desplazamiento químico de 31 P NMR de Et3PO en el hexano del solvente ácido de Lewis débilmente (δ = 41.0 ppm, AN 0) y en el solvente ácido de Lewis fuertemente SbCl5 (δ = 86.1 ppm, AN 100). Los números de aceptadores se pueden calcular a partir de AN = 2.21 x (δ muestra - 41.0) y los valores más altos de AN indican una mayor acidez de Lewis. Los trihaluros de boro son ácidos de Lewis arquetípicos y tienen los siguientes valores de AN: BF3 (89) < BCl3 (106) < BBr3 (109) < BI3 (115).[2] La acidez de Lewis de otras moléculas se puede obtener en solventes ácidos de Lewis débilmente mediante mediciones de RMN de 31P de sus aductos de Et3PO.[5] El método de Gutmann-Beckett se ha aplicado a fluoroarilboranos derivados de ácidos de Lewis[5] [6] como B (C6 F5)3 (AN 82) y cationes de borenio, y se ha revisado su aplicación a una variedad de compuestos de boro.[7]
Aplicación a otros compuestos.
El método de Gutmann-Beckett se ha aplicado con éxito a complejos de metales alcalinotérreos,[8][9] compuestos del grupo principal del bloque p [5][10][11][12][13] (por ejemplo, AlCl3, AN 87; cationes de sililio; [E (bipy)2]3+ (E = P, As, Sb, Bi) cationes; derivados catiónicos 4 de coordenadas Pv y Sbv) y compuestos de metales de transición[5][14] (por ejemplo, TiCl4, AN 70).
Referencias
- U. Mayer, V. Gutmann, and W. Gerger, "The acceptor number – a quantitative empirical parameter for the electrophilic properties of solvents", Monatshefte fur Chemie, 1975, 106, 1235–1257. doi: 10.1007/BF00913599
- M.A. Beckett, G.C. Strickland, J.R. Holland, and K.S. Varma, "A convenient NMR method for the measurement of Lewis acidity at boron centres: correlation of reaction rates of Lewis acid initiated epoxide polymerizations with Lewis acidity", Polymer, 1996, 37, 4629–4631. doi: 10.1016/0032-3861(96)00323-0
- G.C. Welch, L.Cabrera, P.A. Chase, E. Hollink, J.M. Masuda, P. Wei, and D.W. Stephan,"Tuning Lewis acidity using the reactivity of "frustrated Lewis pairs": facile formation of phosphine-boranes and cationic phosphonium-boranes", Dalton Trans., 2007, 3407–3414. doi: 10.1039/b704417h
- V. Gutmann, "Solvent effects on reactivities of organometallic compounds", Coord. Chem. Rev., 1976, 18, 225–255. doi: 10.1016/S0010-8545(00)82045-7
- M.A. Beckett, D.S. Brassington, S.J. Coles, and M.B. Hursthouse, "Lewis acidity of tris(pentafluorophenyl)borane: crystal and molecular structure of B(C6F5)3.OPEt3", Inorg. Chem. Commun., 2000, 3, 530–533. doi: 10.1016/S1387-7003(00)00129-5
- S.C. Binding, H. Zaher, F.M. Chadwick, and D. O'Hare, "Heterolytic activation of hydrogen using frustrated Lewis pairs containing tris(2,2',2'-perfluorobiphenyl)borane", Dalton Trans., 2012, 41, 9061–9066. doi: 10.1039/c2dt30334e
- I.B. Sivaev, V.L. Bregadze, “Lewis acidity of boron compounds”, Coord. Chem. Rev., 2014, 270/271, 75-88. doi: 10.1016/j.ccr.2013.10.017
- S. Brand, J. Pahl, H. Elsen, and S. Harder, "Frustrated Lewis pair chemistry with magnesium Lewis acids", European J. Inorg. Chem., 2017, 4187-4195. doi: 10.1002/ejic.201700787
- J. Pahl, S. Brand, H. Elsen, and S. Harder,"Highly Lewis acidic cationic alkaline earth metal complexes", Chem. Commun., 2018, 54, 8685-8688. doi: 10.1039/C8CC04083D
- H. Grossekappenberg, M. Reissmann, M. Schmidtmann, and T. Mueller, “Quantitative assessment of the Lewis acidity of silylium ions”, Organometallics, 2015, 34, 4952-4958. doi: 10.1021/acs.organomet.5b00556
- S.S. Chitnis, A.P.M. Robertson, N. Burford, B.O. Patrick, R. McDonald, and M.J. Ferguson, “Bipyridine complexes of E3+ (E = P, As, Sb, Bi): strong Lewis acids, sources of E(OTf)3 and synthons for EI and Ev cations”, Chemical Sciences, 2015, 6, 6545-6555. doi: 10.1039/C5SC02423D
- J.M. Bayne and D.W. Stephan, “Phosphorus Lewis acids: emerging reactivity and applications in catalysis”, Chem. Soc. Rev., 2015, 45, 765-774. doi:10.1039/c5cs00516g
- B. Pan and F. Gabbai, “[Sb(C6H5)4][B(C6F5)4]: an air stable Lewis acidic stibonium salt that activates strong element-fluorine bonds”, J. Am. Chem. Soc., 2014, 136, 9564-9567. doi: 10.1021/ja505214m
- C.-Y. Wu, T. Horibe, C.B. Jacobsen, and D. Toste, “Stable gold(III) catalysts by oxidative addition of a carbon-carbon bond”, Nature, 2015, 517, 449-454. doi: 10.1038/nature14104