Pteropodidae
Los pteropódidos (Pteropodidae), conocidos comúnmente como megamurciélagos, murciélagos frugívoros o (en especial los de los géneros Acerodon y Pteropus) zorros voladores, son una familia de mamíferos quirópteros. Son el único miembro de la superfamilia Pteropodoidea, una de las dos que componen el suborden Yinpterochiroptera.
| Pteropódidos | ||
|---|---|---|
 Colonia de Pteropus scapulatus | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Mammalia | |
| Orden: | Chiroptera | |
| Superfamilia: | Pteropodoidea | |
| Familia: |
Pteropodidae Gray, 1821 | |
| Distribución | ||
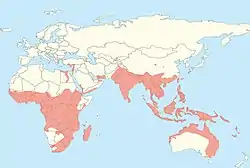 Distribución de los megamurciélagos | ||
| Subfamilias | ||
Nyctimeninae | ||
| Sinonimia | ||
Pteropidae (Gray, 1821)[1] | ||
Las divisiones de Pteropodidae han variado desde que se propusieron por primera vez subfamilias en 1917, pasando de las tres que se clasificaron ese año, a las seis que se reconocen actualmente, junto con varias tribus; hasta 2018 se habían descrito 197 especies de pteropódidos. El conocimiento de la evolución de los megamurciélagos ha estado determinada sobre todo por datos genéticos, ya que el registro fósil de esta familia es el más fragmentado de todos los murciélagos. Es probable que hayan evolucionado en Australasia, con el ancestro común de todos los pteropódidos vivos que apareció hace aproximadamente 31 millones de años. Muchos de sus linajes probablemente se originaron en Melanesia y posteriormente se dispersaron a lo largo del tiempo por el Asia continental, el Mediterráneo y África. En la actualidad se distribuyen por áreas tropicales y subtropicales de Eurasia, África y Oceanía.
Aunque esta familia incluye las especies de murciélagos de mayor tamaño, con individuos de algunas especies que pesan hasta 1,45 kg y tienen una envergadura de hasta 1,7 m, a pesar de su nombre no todos los megamurciélagos tienen un cuerpo de gran tamaño, pues casi un tercio de todas las especies pesan menos de 50 g. Morfológicamente se pueden distinguir de otros murciélagos por sus caras similares a las de los perros, hocico vulpino, la presencia de garras en el segundo dedo de la mano y su reducido uropatagio. Solo los miembros de un género, Notopteris, tienen cola. Como todos los murciélagos, cuentan con varias adaptaciones para el vuelo, como el rápido consumo de oxígeno, la capacidad de mantener una frecuencia cardíaca de más de 700 latidos por minuto y un gran volumen pulmonar.
La mayoría son nocturnos o crepusculares, aunque algunas especies son activas durante el día. Durante los períodos de inactividad se refugian en árboles o cuevas; los miembros de algunas especies descansan solos, mientras que otros forman colonias de hasta un millón de individuos. Durante los períodos de actividad utilizan el vuelo para desplazarse hasta los recursos alimenticios. Con pocas excepciones, los miembros de esta familia carecen de capacidad de ecolocalización, por lo que recurren a sus agudos sentidos de la vista y el olfato para orientarse y buscar los alimentos. La mayoría de las especies son fundamentalmente frugívoras y algunas son nectarívoras; otros recursos alimenticios menos comunes son hojas, polen, ramitas y corteza.
Alcanzan la madurez sexual a un ritmo lento y tienen un bajo rendimiento reproductivo. La mayoría de las especies tienen una sola cría tras una gestación de cuatro a seis meses; este escaso rendimiento reproductivo se traduce en que, tras una pérdida de población, su número tarda en recuperarse. Una cuarta parte de las especies de la familia están catalogadas como amenazadas, principalmente debido a la destrucción de su hábitat y a la caza indiscriminada. En algunas zonas son una fuente de alimento habitual, lo que ha provocado la disminución de la población y su extinción. Como otros murciélagos son objeto de estudios en el ámbito de la salud pública, ya que son reservorios naturales de varios virus que pueden afectar a los seres humanos.
Anatomía
Morfología externa

Los megamurciélagos recibieron este nombre porque generalmente son los murciélagos de mayor peso y tamaño; el más grande, Pteropus neohibernicus, pesa hasta 1,6 kg,[2] con una envergadura de hasta 1,7 m.[3] A pesar de que el tamaño corporal fue una característica definitoria que Dobson utilizó para la división de los murciélagos en Microchiroptera y Megachiroptera, no todas las especies de megamurciélagos son de gran tamaño o más grandes que los micromurciélagos: Balionycteris maculata pesa solo 14,2 g.[4] Los géneros Pteropus y Acerodon (zorros voladores) suelen tomarse como referentes de toda la familia en cuanto a tamaño corporal, pero en realidad estos géneros son atípicos, lo que crea un concepto erróneo del verdadero tamaño de la mayoría de las especies de la familia.[5] En un estudio realizado en 2004 se señalaba que el 28 % de las especies de megamurciélagos pesaban menos de 50 g.[4]
Pueden distinguirse de los micromurciélagos por su cara similar a la de un perro y su hocico vulpino, por la presencia de garras en el segundo dedo de la extremidad anterior (ver sección Postcráneo y por sus pequeñas orejas,[6] que se debe en parte a la carencia de trago,[n 1] que sí está presente en muchas especies de micromurciélagos. Los miembros del género Nyctimene tienen un aspecto menos parecido a los perros, con caras más cortas y fosas nasales tubulares.[8] Un estudio de 2011 sobre 167 especies de megamurciélagos concluyó que mientras que la mayoría (63 %) tiene un pelaje de color uniforme, se observan otros patrones en esta familia: contracoloración en el 4 % de las especies, una banda en el cuello o nuca en el 5 %, rayas en el 10 % y manchas en el 19 % de las especies.[9]
A diferencia de los micromurciélagos tienen un uropatagio —extensión de la membrana de vuelo de piel elástica y resistente que se extiende entre las extremidades posteriores— muy reducido.[10] Carecen de cola o es muy pequeña, con la excepción de las especies del género Notopteris, que tienen una larga cola.[11] En la mayoría de las especies de esta familia las alas se insertan lateralmente (se unen al cuerpo directamente en los lados), pero en Dobsonia las alas se unen más cerca de la columna vertebral, lo que les da el nombre común de murciélagos frugívoros «de espalda desnuda».[10]
Cráneo y dentición

Los pteropódidos tienen cavidades orbitarias grandes, bordeadas por apófisis postorbitales[n 2] que, en ocasiones, se unen para formar la barra postorbital. El hocico, de longitud variable según los géneros, es de aspecto sencillo y no muy modificado, a diferencia de otras familias de murciélagos.[12] El premaxilar está bien desarrollado y normalmente está libre,[13] esto es, que no se fusiona con el maxilar sino que se articula con él mediante ligamentos, lo que le permite moverse libremente.[14][15] El premaxilar siempre carece de una rama palatal.[13] En las especies con un hocico más largo el cráneo suele ser arqueado. En los géneros con caras más cortas (Penthetor, Nyctimene, Dobsonia y Myonycteris), el cráneo tiene poca o ninguna curvatura.[16]
El número de dientes oscila entre 24 y 34, según las especies; todas tienen dos o cuatro incisivos superiores e inferiores, con la excepción de Aproteles bulmerae, que carece completamente de incisivos,[17] y Myonycteris brachycephala, que tiene dos incisivos superiores y tres inferiores,[18] lo que lo convierte en la única especie de mamífero con una fórmula dentaria asimétrica.[18]
Todas las especies de la familia tienen dos dientes caninos superiores e inferiores. El número de premolares es variable, con cuatro o seis superiores e inferiores. Los primeros molares superiores e inferiores están siempre presentes, lo que significa que todos los megamurciélagos tienen al menos cuatro molares; los molares restantes pueden estar presentes, presentes pero reducidos, o ausentes.[17] La parte superior de los molares y premolares es sencilla, con una reducción de las cúspides y crestas que se traduce en una corona dental más aplanada.[19]
Como la mayoría de los mamíferos, los megamurciélagos son difodontos, lo que significa que los jóvenes tienen un conjunto de dientes deciduos (dientes de leche) que caen y son reemplazados por dientes permanentes; la mayoría de las especies de esta familia tiene 20 dientes de leche. Como el habitual entre los mamíferos,[20] el conjunto de dentición decidua no incluye los molares.[19]
Postcráneo

Se ha descrito a los omóplatos de los megamurciélagos como los más primitivos de todas las familias de quirópteros.[19] El hombro es por lo general de construcción simple, pero tiene algunas características especializadas. La primitiva inserción del músculo omohioideo desde la clavícula hasta la escápula está desplazada lateralmente (más hacia el lado del cuerpo), una característica que también se ve en la familia de micromurciélagos Phyllostomidae. El hombro también tiene un sistema muy desarrollado de deslizamientos musculares (bandas estrechas de músculo que potencian los músculos más grandes) que anclan el tendón del músculo occipitopollicalis (músculo en los murciélagos que va desde la base del cuello hasta la base del pulgar)[10] a la piel.[21]
Mientras que los micromurciélagos solo tienen garras en los pulgares de sus extremidades anteriores, la mayoría de los megamurciélagos además tienen un segundo dedo con garras,[19] a excepción de los géneros Eonycteris, Dobsonia, Notopteris y Neopteryx, que carecen de esta segunda garra.[22] El primer dedo es el más corto, mientras que el tercer dedo es el más largo; el segundo dedo no puede ser flexionado.[19] Los pulgares de los megamurciélagos son más largos en relación con sus extremidades delanteras que los de los micromurciélagos.[10]
Las extremidades posteriores tienen los mismos componentes del esqueleto de los humanos. La mayoría de las especies de la familia tienen una estructura adicional denominada calcar, apófisis cartilaginoso que surge del calcáneo.[23] Algunos autores se denominan a esta estructura espolón uropatagial para diferenciarla de los calcares de los micromurciélagos, que tienen una estructura diferente. La estructura permite estabilizar el uropatagio, permitiendo a los murciélagos ajustar la curvatura de la membrana durante el vuelo. Los géneros Notopteris, Syconycteris y Harpyionycteris no disponen de calcar.[24] Toda la pierna rota en la cadera comparada con la orientación normal de los mamíferos, lo que supone que las rodillas están orientadas hacia atrás. Los cinco dedos de las patas se flexionan en la dirección del plano sagital, sin que ningún dedo pueda flexionarse en la dirección opuesta, como en las patas de las aves paseriformes.[23]
Sistemas internos

El alto coste energético que supone el vuelo requirió que experimentaran varias adaptaciones del sistema cardiovascular. Durante el vuelo, los murciélagos pueden elevar en veinte veces o más su consumo de oxígeno durante períodos prolongados; los atletas humanos pueden lograr un factor de aumento similar, pero durante unos pocos minutos como máximo.[25] Un estudio realizado en 1994 con Eidolon helvum y Hypsignathus monstrosus reveló una relación media de intercambio respiratorio[n 3] de aproximadamente 0,78. En la mediciones realizadas con dos especies, las frecuencia cardíacas máximas en vuelo variaron entre los 476 latidos por minuto en Pteropus poliocephalus y los 476 en Rousettus aegyptiacus. El número máximo de respiraciones por minuto varió entre 163 en Pteropus poliocephalus y 316 en Eidolon helvum[27] Además, los megamurciélagos tienen una capacidad pulmonar excepcionalmente grande en relación con su tamaño; mientras que mamíferos terrestres como las musarañas, tienen un volumen pulmonar de 0,03 cm3 por gramo de peso corporal, especies como Epomophorus wahlbergi tienen volúmenes de 0,13 cm3 por gramo, más de cuatro veces superior.[25]
Tienen un aparato digestivo rápido, con un tiempo de tránsito intestinal de media hora o menos,[8] Está adaptado para una dieta herbívora, en ocasiones restringida a frutas blandas o néctar.[28] La longitud es corta para un herbívoro (también más corta que la de los microquirópteros insectívoros),[28] ya que el contenido fibroso de su alimentación se separa en su mayor parte por la acción del paladar, la lengua y los dientes, y luego se desecha.[28] Muchos megamurciélagos tienen estómagos en forma de U. No hay una diferencia clara entre el intestino delgado y el grueso, ni un comienzo definido del recto. Tienen una densidad muy alta de microvellosidades intestinales, lo que proporciona una gran área para la absorción de nutrientes.[29]
Biología y ecología
Tamaño del genoma
Como en todos los murciélagos, el tamaño del genoma de los pteropódidos es mucho más pequeño que en otros mamíferos. Un estudio realizado en 2009 con 43 especies de megamurciélagos determinó que sus genomas iban desde los 1,86 picogramos[n 4] en Eidolon helvum y 2,51 pg en Pteropus lylei; todos los valores fueron mucho más bajos que el valor medio de los mamíferos de 3,5 pg. Los megamurciélagos tienen genomas más pequeños que los micromurciélagos, con un peso medio de 2,20 pg en comparación con 2,58 pg de estos últimos. Se cree que esta diferencia podría estar relacionada con el hecho de que el linaje de los megamurciélagos ha pasado por una extinción del LINE-1.[n 5] LINE-1 constituye entre el 15 y el 20 % del genoma humano y se considera el elemento nuclear intercalado largo más frecuente entre los mamíferos.[31]
Vista
A diferencia de otros murciélagos, con muy pocas excepciones los pteropódidos carecen de la capacidad de ecolocalización, por lo tanto dependen de la vista y el olfato para orientarse.[32] Sus ojos son grandes y están situados en la parte delantera de la cabeza.[33] Son más grandes que los del ancestro común de todos los murciélagos y un estudio evidenció una tendencia al aumento del tamaño de los ojos entre los megamurciélagos; en el mismo estudio, los exámenes realizados sobre los ojos de 18 especies de megamurciélagos determinó que Syconycteris australis tenía los ojos más pequeños, con un diámetro de 5,03 mm, mientras que los más grandes eran los de Pteropus vampyrus, con 12,34 mm de diámetro.[34] El iris suele ser marrón, pero puede ser rojo o naranja, como en Desmalopex, Mirimiri, Pteralopex y algunos Pteropus.[35]
Con altos niveles de brillo su agudeza visual es más pobre que la de los humanos, mientras que con poco brillo es superior.[33] Un estudio que examinó los ojos de algunas especies de Rousettus, Epomophorus, Eidolon y Pteropus concluyó que los tres primeros poseen tapetum lucidum, una estructura reflectante en los ojos que mejora la visión con bajos niveles de luz, mientras que las especies de Pteropus no.[32] Todas las especies examinadas tenían retinas con células fotosensibles tanto conos (responsables de la percepción del color) como bastones, pero solo las especies de Pteropus tenían conos tipo S, que detectan las longitudes de onda más cortas de la luz; debido a que no fue discernible la sintonía espectral de las opsinas, no está claro si los conos S de Pteropus detectan la luz azul o ultravioleta. Las especies de Pteropus son dicromáticas, ya que poseen dos tipos de células cono; los otros tres géneros, que carecen de conos S, son monocromáticos, incapaces de percibir el color. En todos los géneros se encontraron densidades muy altas de células bastón, lo que se traduce en una alta sensibilidad a la luz, que se corresponde con sus patrones de actividad nocturna; en Pteropus y Rousettus las densidades de bastones medidas fueron de 350 000 a 800 000 por milímetro cuadrado, igual o superior a las de otros animales nocturnos o crepusculares como el ratón común (Mus musculus), el gato (Felis silvestris catus) o el conejo doméstico (Oryctolagus cuniculus domesticus).[32]
Olfato
Cuentan con un agudo sentido del olfato, similar al del perro doméstico (Canis lupus familiaris),[36] que utilizan para encontrar fuentes de alimento como la fruta y el néctar.[37] Los murciélagos frugívoros del género Nyctimene, como N. robinsoni, tienen un olfato estereoscópico, lo que les permite trazar un mapa y seguir rastros de olor en tres dimensiones.[36] Como la mayoría (o probablemente todas) las demás especies de murciélagos, las madres y las crías de los megamurciélagos también utilizan el olfato para reconocerse entre sí o a otros individuos.[37] Los machos de las especies de zorros voladores (Acerodon y Pteropus) tienen en los hombros glándulas sebáceas agrandadas y sensibles a los andrógenos que utilizan para marcar su territorio con olor, especialmente durante la época de apareamiento; las secreciones de estas glándulas varían según la especie.[38] Los machos también se lavan o se cubren con su propia orina.[38][39]
Gusto
Los miembros de esta familia poseen el gen TAS1R2, lo que significa que tienen la capacidad de percibir el sabor dulce de los alimentos; este gen está presente en todos los murciélagos, excepto en los vampiros. Como todos los demás murciélagos, los pteropódidos no pueden percibir el sabor umami, debido a la ausencia del gen TAS1R1; de entre los otros mamíferos, solo los pandas gigantes han demostrado carecer de este gen.[37] Los pteropódidos también poseen múltiples genes TAS2R, lo que indica que pueden percibir el sabor amargo.[40]
Reproducción y ciclo vital

Entre los mamíferos, al igual que todos los murciélagos, son longevos en relación con su tamaño; algunos ejemplares en cautiverio han superado los 30 años.[22] También en relación con su tamaño, tienen un bajo rendimiento reproductivo y una madurez sexual tardía; las hembras de la mayoría de las especies de la familia no dan a luz hasta alcanzar uno o dos años de edad.[41] Sus hábitos de apareamiento son muy variables y en gran medida desconocidos.[42] Algunos megamurciélagos aparentemente pueden reproducirse durante todo el año, pero la mayoría de las especies probablemente se reproducen de forma estacional.[22] El apareamiento se realiza en su lugar de cobijo, en la rama de un árbol.[43] La duración de la gestación es variable,[44] pero en la mayoría de las especies es de cuatro a seis meses. Varias especies muestran adaptaciones reproductivas que prolongan el período entre la cópula y el parto; algunas, como Eidolon helvum, utilizan la implantación diferida y, aunque la cópula se produce en junio o julio, el cigoto no se implanta en la pared uterina hasta meses más tarde, en noviembre.[41] Haplonycteris fischeri, debido a esta adaptación reproductiva del retraso de la implantación, tiene la mayor duración de la gestación de todas las especies de murciélagos, de hasta 11,5 meses.[44] Este retraso implica que el desarrollo del embrión se suspende hasta ocho meses después de la implantación en la pared uterina, de ahí sus larguísimos períodos de gestación.[41] En Cynopterus sphinx la duración de la gestación es más corta, de unos tres meses.[45]
Como norma general todas las especies de la familia paren una única cría,[41] aunque existen escasos registros de dos en Pteropus rufus, Epomops dobsoni, Pteropus poliocephalus, Pteropus alecto, Pteropus conspicillatus[46] Cynopterus sphinx,[47] Epomophorus crypturus, Hypsignathus monstrosus, Eidolon helvum, Myonycteris torquata, Rousettus aegyptiacus o Rousettus leschenaultii,[48] aunque en estos casos es raro que ambas crías sobrevivan.[46] Debido a que los pteropódidos, como todos los murciélagos, tienen bajas tasas de reproducción, en caso de disminución de su número, las poblaciones tardan en recuperarse.[49]
Al nacer, las crías de megamurciélagos tienen un peso, en promedio, del 17,5 % del peso postparto de su madre, la menor relación de peso madre/cría de todas las familias de murciélagos, que es de media del 22,3 %. No es fácil clasificar las crías de los megamurciélagos en las categorías tradicionales de altriciales (indefensos al nacer) o precociales (capaces al nacer); especies como Cynopterus sphinx nacen con los ojos abiertos (un signo de precodidad), mientras que los ojos de las crías de Rousettus aegyptiacus no se abren hasta nueve días después del nacimiento (un signo de altricialidad).[50]
Como en casi todas las especies de murciélagos, los machos no participan con las hembras en el cuidado parental.[51] Las crías permanecen con sus madres hasta que son destetadas; el tiempo que transcurre hasta el destete varía según las especies. Como todos los murciélagos, los pteropódidos tienen períodos de lactancia relativamente largos: las crías se amamantan hasta que alcanzan aproximadamente el 71 % de la masa corporal adulta, a diferencia del 40 % en los demás mamíferos.[52] Las especies del género Micropteropus destetan a sus crías a las siete u ocho semanas de edad, mientras que Pteropus medius lo hace a los cinco meses.[53] Aunque muy inusualmente, hay registros de individuos machos de dos especies de megamurciélagos, Pteropus capistratus y Dyacopterus spadiceus, produciendo leche, pero en estos casos nunca se ha observado un macho lactante;[54] no está claro si esta lactancia es funcional y los machos realmente amamantan a las crías o si es el resultado del estrés o la malnutrición.[55]
Comportamiento y sistemas sociales

Muchas especies de esta familia son altamente gregarias o sociales. Los megamurciélagos vocalizan para comunicarse entre sí, con ruidos descritos como «ráfagas de sonido similares a trinos»,[56] graznidos[57] o llamadas fuertes similares a balidos[58] en varios géneros. Al menos una especie, Rousettus aegyptiacus, es capaz de un tipo aprendizaje de producción vocal, definido como «capacidad de modificar las vocalizaciones en respuesta a interacciones con congéneres».[59][60] Los jóvenes de esta especie son capaces de adquirir un determinado grupo de variaciones vocales escuchando a sus madres, así como a otros individuos de sus colonias; se ha postulado que estas diferencias de variaciones vocales pueden dar lugar, por ejemplo, a que los individuos de distintas colonias se comuniquen a distintas frecuencias.[61][62]
Entre los comportamientos sociales de los megamurciélagos se incluye el uso de conductas sexuales para algo más que la reproducción. Existen estudios que muestran la posibilidad de que las hembras de Rousettus aegyptiacus reciben comida de los machos a cambio de sexo; pruebas de paternidad confirmaron que los machos de los que cada hembra obtenía comida tenían una mayor probabilidad de engendrar la descendencia de la hembra.[63] Se ha observado felación homosexual en al menos una especie, Pteropus pselaphon;[64][65] se ha planteado la hipótesis de que este comportamiento fomenta la formación de colonias de machos antagónicos en climas fríos.[64][65]
La mayoría de pteropódidos son nocturnos o crepusculares, aunque se han observado casos de ejemplares volando durante el día.[3] Algunas especies y subespecies isleñas son diurnas, un comportamiento que se cree que responde a la falta de depredadores; entre las especies diurnas están Pteropus niger, Pteropus molossinus, Pteropus seychellensis, una subespecie de Pteropus melanotus (P. m. natalis) y una de Pteropus pelagicus (P. p. insularis).[66]
En un estudio de 1992 realizado sobre cuarenta y un géneros de megamurciélagos se observó que veintinueve se cuelgan en ramas de árboles, once se resguardaban en cuevas y los seis géneros restantes en otros lugares, como estructuras humanas, minas o grietas. Las especies que se refugian en los árboles pueden ser solitarias o muy coloniales, llegando a formar agrupaciones de hasta un millón de individuos. Las que se refugian en cuevas forman grupos que van desde diez individuos hasta varios miles. Las especies muy coloniales suelen mantener sus dormideros y sus árboles o cuevas pueden ser utilizados durante muchos años. Las especies solitarias o las que se agrupan en menor número tienen menos fidelidad a sus dormideros.[67]
Alimentación

La mayoría de megamurciélagos son fundamentalmente frugívoros.[68] Entre todos los miembros de la familia consumen una gran variedad de frutas que abarca casi 188 géneros de plantas.[69] Algunas especies son también nectarívoras.[68] En Australia las flores de los eucaliptos son una fuente especialmente importante de alimento.[70] Además de sus principales fuentes de alimento pueden aprovechar otros recursos alimenticios como hojas, brotes, capullos, polen, vainas de semillas, savia, conos, corteza y ramitas.[71] Son grandes consumidores y pueden ingerir hasta 2,5 veces su propio peso corporal en fruta por noche.[69]
Utilizan el vuelo para desplazarse hacia los recursos de descanso y forrajeo. Por lo general vuelan recto y relativamente rápido en comparación con otros murciélagos, aunque algunas especies son más lentas y tienen mayor capacidad de maniobra. Algunas especies puede recorrer de 20 a 50 km en una noche. Las especies migratorias de los géneros Eidolon, Pteropus, Epomophorus, Rousettus, Myonycteris y Nanonycteris pueden recorrer distancias de hasta 750 km. La mayoría de los megamurciélagos tienen una relación de aspecto (medida que relaciona la envergadura y la superficie de las alas) inferior a la media de los murciélagos;[72] la carga alar, que mide el peso en relación con la superficie de las alas, es igual o superior a la media.[72]
Dispersión de semillas
Juegan un papel importante en la dispersión de semillas. Como consecuencia de la extensa historia evolutiva de los megamurciélagos, algunas plantas han desarrollado características adaptadas a sus sentidos, como frutos muy aromáticos, de colores brillantes y visiblemente expuestos lejos del follaje. Los colores brillantes y la posición del fruto pueden reflejar la dependencia de los murciélagos de las señales visuales y su incapacidad de navegar a través del desorden. En un estudio que examinó los frutos de más de cuarenta especies de higos, la mayoría de las especies eran consumidas por aves o megamurciélagos y solo una especie de higo era consumida por ambos; los higos que consumían las aves eran con frecuencia rojos o anaranjados, mientras que en el caso de los megamurciélagos generalmente fueron amarillos o verdes.[73] La mayoría de las semillas se excretan poco después de su consumo debido al rápido tiempo de tránsito intestinal, aunque algunas pueden permanecer en el intestino durante más de doce horas, lo que aumenta la capacidad de los megamurciélagos de dispersar las semillas lejos de los árboles de origen.[74] Como frugívoros con gran movilidad tienen la capacidad de restaurar el bosque en zonas deforestadas gracias a su dispersión de semillas.[75] Esta capacidad de dispersión se limita a las plantas con semillas pequeñas, de menos de 4 mm de longitud, ya que las semillas más grandes no las ingieren.[76]
Depredadores y parásitos
_(5021769088).jpg.webp)
Los pteropódidos, especialmente los que viven en islas, tienen pocos depredadores nativos; especies como Pteropus hypomelanus no tienen depredadores naturales conocidos.[77] Entre los depredadores no nativos de los zorros voladores se encuentran en los gatos domésticos y las ratas. El varano de manglar (Varanus indicus), un depredador nativo para algunas especies de pteropódidos pero introducido para otras, se alimenta ocasionalmente de estos murciélagos, ya que es un hábil trepador de árboles.[78] La serpiente arbórea marrón (Boiga irregularis) puede afectar gravemente a las poblaciones de megamurciélagos; como depredador no nativo en Guam, esta serpiente consume tantas crías que redujo el reclutamiento[n 6] de zorros voladores de las Marianas (Pteropus mariannus) a prácticamente cero y la isla se considera ahora un sumidero para este murciélago, ya que su población en ella depende más de los murciélagos que emigran de la cercana isla Rota para reforzarla que para una reproducción adecuada.[80] Entre los depredadores naturalmente simpátricos con los megamurciélagos se encuentra reptiles como cocodrilos, serpientes y grandes lagartos, además de aves como halcones, accipítridos y rapaces nocturnas.[81] El cocodrilo marino (Crocodylus porosus) es uno de sus depredadores conocidos, basándose en el análisis del contenido de su estómago en el norte de Australia.[82]
Son hospedadores de varios taxones de parásitos. Entre sus parásitos conocidos se encuentran las especies de dípteros de las familias Nycteribiidae y Streblidae (conocidas como «moscas de los murciélagos»),[83][84] así como ácaros del género Demodex.[85] Los parásitos de la sangre de la familia Haemoproteidae y los nematodos intestinales de Toxocaridae también afectan a algunas especies de megamurciélagos.[86][87]
Distribución y hábitat
Su área de distribución se extiendo por la zona intertropical del Viejo Mundo; están presentes en África, Asia, Australia y en todas las islas del océano Índico y Oceanía.[88] En 2013 había catalogados catorce géneros de pteropódidos en África con un total de veintiocho especies, de las cuales veinticuatro solo se encuentran en climas tropicales o subtropicales y las cuatro restantes se localizan sobre todo en los trópicos, aunque sus área de distribución también incluye climas templados. Por su hábitat, ocho se localizan exclusiva o mayoritariamente en zonas boscosas, nueve se encuentran tanto en bosques como en sabanas, nueve exclusiva o mayoritariamente en sabanas y dos en islas; solo una especie africana, Rousettus lanosus, se encuentra principalmente en los ecosistemas de montaña, aunque el área de distribución de otras trece también puede abarcar hábitats de montañosos.[89]
A excepción del Sudeste Asiático, los megamurciélagos tienen una relativamente baja diversidad de especies en Asia. Rousettus aegyptiacus es el único megamurciélago cuya área de distribución se encuentra principalmente en el paleártico;[90] Rousettus aegyptiacus y Eidolon helvum son las únicas especies que se encuentran en el Oriente Medio.[90][91] La región más septentrional del área de distribución de Rousettus aegyptiacus es la zona nororiental del mar Mediterráneo.[90] En Asia Oriental se encuentran únicamente en China y Japón; en China, solo se consideran residentes seis especies, mientras que otras siete están presentes de manera marginal (en el borde de su área de distribución), de forma dudosa (debido a una posible identificación errónea) o como migrantes accidentales;[92] cuatro especies, todas del género Pteropus, se encuentran en el Japón, pero ninguna en sus cinco islas principales.[93][94][95][96] En Asia Meridional, la diversidad de megamurciélagos varía desde dos especies en las Maldivas hasta trece especies en la India.[97] En el Sudeste Asiático van de cinco especies en el pequeño país de Singapur a setenta y siete en Indonesia.[97] De todas las especies que se encuentran en Asia, los bosques son el hábitat de la gran mayoría ellas; otros tipos de hábitat son sabanas, matorrales o pastizales.[97]
En Australia se encuentran cinco géneros (Pteropus, Syconycteris, Dobsonia, Nyctimene y Macroglossus)[98] y ocho especies. Las especies de Pteropus se distribuyen por diversos hábitats, como los bosques dominados por manglares, las selvas tropicales y los bosques esclerófilos húmedos de los montes australianos;[99] las especies de zorros voladores de Australia se encuentran a menudo en asociación con los seres humanos, ya que emplazan grandes colonias en zonas urbanas, especialmente en mayo y junio.[100]
En Oceanía el mayor número de especies se encuentran en Papúa Nueva Guinea, con treinta y cinco.[97] De las sesenta y una especies de Oceanía, el bosque es el hábitat todas ellas; algunas además se encuentran en otros tipos de hábitat como la sabana (6 especies) o matorrales (3).[97]
Se estima que el 19 % de todas las especies de megamurciélagos son endémicas de una única isla; de todas las familias de murciélagos, solo Myzopodidae tiene una tasa más alta de endemismo de una sola isla.[101]
Conservación
Estatus

La mayor fuente de amenaza para los megamurciélagos es por parte de los humanos, ya que son cazados como alimento y para usos medicinales. Además, son sacrificados por daños reales o supuestos a la agricultura, especialmente a la producción de frutas.[103]
En 2020 la Unión Internacional para la Conservación de la Naturaleza (UICN) tenía catalogadas 195 especies de pteropódidos, de las cuales más de un tercio fueron evaluadas como amenazadas, categoría que incluye las especies que figuran en su Lista Roja como en peligro crítico de extinción, en peligro de extinción y vulnerables:[97]
- Extintas: 6 especies (3,1 %)
- En peligro crítico de extinción: 7 especies (3,6 %)
- En peligro de extinción: 25 especies (12,8 %)
- Vulnerables: 35 especies (17,9 %)
- Casi amenazadas: 15 especies (7,7 %)
- Bajo preocupación menor: 89 especies (45,6 %)
- Con datos insuficientes: 18 especies (9,2 %)
Causas antropogénicas

Uno de los procesos que amenazan a los megamurciélagos es la destrucción de su hábitat por los humanos. La deforestación de sus territorios supone la pérdida de hábitats críticos para sus lugares de refugio y también provoca la pérdida de recursos alimentarios, ya que se talan los árboles frutales nativos. La deforestación y la creciente urbanización y construcción de nuevas carreteras facilita el acceso a sus colonias y su explotación excesiva, además de agravar las amenazas naturales, ya que los bosques fragmentados son más vulnerables a los daños causados por los tifones.[104] Las especies que se refugian en cuevas se ven amenazadas por las alteraciones humanas en sus lugares de descanso; la minería del guano y otros minerales en las cuevas es un medio de vida para los habitantes de algunos países dentro de su área de distribución y las cuevas también se ven perturbadas por el acceso de turistas.[105]
La mitad de todas las especies de megamurciélagos se cazan para obtener alimentos, en comparación con solo el 8 % de las especies insectívoras.[106] La persecución humana a causa de los daños aparentes que causan en los cultivos es también una de las principales razones de su caza. Existen registros de que algunos megamurciélagos prefieren los árboles frutales nativos a los cultivos agrícolas, pero la deforestación puede reducir su suministro de alimentos, haciendo que dependan de los cultivos frutales humanos.[105] Para matarlos se les dispara, se les golpea hasta la muerte o se les envenena; también se producen muertes al enredarse en las redes utilizadas para evitar que los murciélagos coman la fruta.[107] Las campañas de eliminación pueden reducir drásticamente las poblaciones de megamurciélagos; en Mauricio entre 2014 y 2016 se sacrificaron más de 40 000 ejemplares de Pteropus niger, lo que se estima que redujo la población de la especie en un 45 %.[108] También mueren por electrocución. Se calcula que en un huerto australiano murieron electrocutados 21 000 murciélagos en un período de ocho semanas.[109] Los agricultores colocan redes electrificadas sobre sus árboles frutales para matar a los murciélagos antes de que puedan consumir su cosecha, aunque son cuestionablemente efectivas para prevenir la pérdida de la cosecha, pues un granjero que operaba una red de este tipo estimó que aun así perdieron de 100 a 120 toneladas de fruta a causa de los zorros voladores en un año.[110] También se producen algunas muertes accidentales por electrocución, como cuando los murciélagos se estrellan contra las líneas eléctricas aéreas.[111]
El cambio climático también ocasiona la mortalidad de los zorros voladores y es motivo de preocupación para la supervivencia de muchas especies. Las olas de calor extremo en Australia han sido responsables de la muerte de más de 30 000 zorros voladores entre 1994 y 2008; las hembras y los murciélagos jóvenes son los más vulnerables al calor extremo, lo que afecta a la capacidad de recuperación de la población.[112] Los murciélagos también se ven amenazados por el aumento del nivel del mar asociado al cambio climático, ya que varias especies son endémicas de atolones de baja altitud.[113]
Causas naturales
Debido a que muchas especies son endémicas de una única isla, son vulnerables a fenómenos aleatorios como los tifones. Un tifón en 1979 redujo a la mitad la población de Pteropus rodricensis. Los tifones también provocan una mortalidad indirecta, ya que a causa de la defoliación que provocan en los árboles hacen que los murciélagos sean más visibles y, por lo tanto, más fáciles de cazar por los seres humanos. Tras estas grandes tormentas sus recursos alimentarios se vuelven escasos y tienen que recurrir a estrategias de búsqueda más arriesgadas, como el consumo de los frutos caídos del suelo, donde son más vulnerables a la depredación por parte de los gatos, perros y cerdos domésticos.[114] Como muchas especies de megamurciélagos se encuentran en el tectónicamente activo cinturón de Fuego del Pacífico, también están amenazadas por las erupciones volcánicas; los zorros voladores, como Pteropus mariannus, que está en peligro de extinción,[96][115] han sido casi exterminados de la isla de Anatahan tras una serie de erupciones que comenzaron en 2003.[116]
Taxonomía y evolución
Historia taxonómica
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relaciones internas de los pteropódidos africanos basadas en la evidencia combinada de ADN mitocondrial y nuclear. Se incluyeron como grupos externos una especie de Pteropodinae, una de Nyctimeninae y una de Cynopterinae, que no se encuentran en África.[117] |
La familia Pteropodidae fue descrita por primera vez en 1821 por el zoólogo británico John Edward Gray. La denominó «Pteropidae» (a partir del género Pteropus) y la situó dentro del ahora desaparecido orden Fructivorae.[118] Fructivorae contenía otra familia, la ya desaparecida Cephalotidae, que incluía un género, Cephalotes[118] (ahora reconocido como sinónimo de Dobsonia).[13] La asignación del nombre por parte de Gray se basaba posiblemente en una utilización errónea del sufijo de «Pteropus».[5] Pteropus proviene del griego πτερο ptero 'ala' y πούς poús 'pie';[119][120] la palabra griega poús proviene de la raíz pod-, por lo que al latinizar Pteropus el prefijo correcto sería «Pteropod-».[121] El biólogo francés Charles Lucien Bonaparte fue el primero en utilizar la ortografía corregida de Pteropodidae en 1838.[121]
En 1875 el zoólogo irlandés George Edward Dobson fue el primero en dividir el orden Chiroptera (murciélagos) en dos subórdenes: Megachiroptera (a veces catalogado como Macrochiroptera) y Microchiroptera, que se conocen comúnmente como megamurciélagos y micromurciélagos.[122] Dobson eligió estos nombres para hacer referencia a las diferencias de tamaño corporal de los dos grupos, ya que muchos murciélagos frugívoros son de mayor tamaño que los murciélagos insectívoros. Pteropodidae fue la única familia que incluyó dentro de Megachiroptera.[5][122]
En un estudio realizado en 2001 se comprobó que la dicotomía entre los megamurciélagos y los micromurciélagos no reflejaba con exactitud sus relaciones evolutivas por lo que, en lugar de Megachiroptera y Microchiroptera, los autores del estudio propusieron los nuevos subórdenes Yinpterochiroptera y Yangochiroptera.[123] Este esquema de clasificación se ha revisado posteriormente en varias ocasiones y actualmente (2019) sigue contando con un amplio apoyo.[124][125][126][127] Yinpterochiroptera (desde 2005 este suborden se denomina también Pteropodiformes)[128] contiene especies que antes estaban incluidas en Megachiroptera (todos los pteropódidos), así como varias familias que antes estaban incluidas en Microchiroptera: Megadermatidae, Rhinolophidae, Nycteridae, Craseonycteridae y Rhinopomatidae.[123] Yinpterochiroptera se divide en dos superfamilias: Rhinolophidea, que contiene las familias anteriormente mencionadas en el Microchiroptera y Pteropodoidea, que solo contiene Pteropodidae.[129]
En 1917 el mastozoólogo danés Knud Andersen dividió Pteropodidae en tres subfamilias: Macroglossinae, Pteropinae (modificado a Pteropodinae) y Harpyionycterinae.[130] En un estudio realizado en 1995 se descubrió que tal como se había definido anteriormente Macroglossinae, que contenía los géneros Eonycteris, Notopteris, Macroglossus, Syconycteris, Melonycteris y Megaloglossus, era parafilético, lo que implicaba que la subfamilia no agrupaba a todos los descendientes de un antepasado común.[131] En publicaciones posteriores se considera a Macroglossini como una tribu dentro de Pteropodinae que contiene solo Macroglossus y Syconycteris.[132][88] Eonycteris y Melonycteris están ubicados dentro de otras tribus en Pteropodinae,[117][88] Megaloglossus se situó en la tribu Myonycterini de la subfamilia Rousettinae y Notopteris es de ubicación incierta.[88]
Otras subfamilias y tribus dentro de Pteropodidae también han sufrido cambios desde la publicación de Andersen en 1917.[88] En 1997 los pteropódidos se clasificaron en seis subfamilias y nueve tribus en función de su morfología o características físicas.[88] En un estudio genético de 2011 se llegó a la conclusión de que algunas de esas subfamilias eran parafiléticas y, por lo tanto, no describían con exactitud las relaciones entre las especies de megamurciélagos. Tres de las subfamilias propuestas en 1997 basadas en la morfología recibieron respaldo: Cynopterinae, Harpyionycterinae y Nyctimeninae. Los otros tres clados recuperados en este estudio consistieron en Macroglossini, Epomophorinae + Rousettini y Pteropodini + Melonycteris.[88] Un estudio genético de 2016 centrado únicamente en los pteropódidos africanos (Harpyionycterinae, Rousettinae y Epomophorinae) también cuestionó la clasificación de 1997. Todas las especies anteriormente incluidas en Epomophorinae se trasladaron a Rousettinae, que se subdividió en varias tribus. El género Eidolon, que antes pertenecía a la tribu Rousettini de Rousettinae, fue trasladado a su propia subfamilia, Eidolinae.[117]
En 1984 se propuso una subfamilia adicional de pteropódidos, Propottinininae, que representaba una especie extinta descrita a partir de un fósil descubierto en África, Propotto leakeyi,[133] pero en 2018 se reexaminaron los fósiles y se determinó que correspondían a un lémur.[134] En 2018 había descritas 197 especies de la familia Peteropodidae,[135] de las cuales alrededor de un tercio son zorros voladores del género Pteropus.[136]
Registro fósil y períodos de divergencia
El registro fósil de los pteropódidos es el más incompleto de todas las familias de murciélagos. Se estima que más del 98 % de la historia fósil de esta familia ha desaparecido.[127] Entre los posibles factores que podrían explicar el motivo de esta escasez de fósiles están que las regiones tropicales donde podrían encontrarse sus fósiles son menos estudiadas en relación con Europa y América del Norte, que las condiciones para la fosilización son malas en los trópicos, lo que podría dar lugar a un menor número de fósiles en general, o que es posible que se hayan originado, pero que hayan sido destruidos por la actividad geológica posterior.[137] A pesar de esta carencia, la edad y los períodos de divergencia de la familia todavía se pueden estimar utilizando la filogenética computacional. Pteropodidae se separó de la superfamilia Rhinolophoidea (que contiene todas las demás familias del suborden Yinpterochiroptera) hace aproximadamente 58 Ma.[127] El ancestro del grupo terminal de Pteropodidae, o todas las especies existentes, vivió hace aproximadamente 31 Ma.[138]
Biogeografía
De acuerdo con reconstrucciones biogeográficas realizadas, la familia Pteropodidae probablemente tiene sus orígenes en Australasia.[117] De otros análisis biogeográficos se desprende que las islas de la Melanesia, incluida Nueva Guinea, son un candidato plausible para el origen de la mayoría de las subfamilias de megamurciélagos, con la excepción de los Cynopterinae,[88] que, según los resultados de un análisis ponderado del área ancestral de seis genes nucleares y mitocondriales, probablemente tiene su origen en la plataforma de la Sonda.[138] Desde estas regiones colonizaron otras áreas, como el Asia continental y África. Según un estudio de 2016, los megamurciélagos llegaron a África en al menos cuatro eventos distintos; estos eventos propuestos están representados por (1) Scotonycteris, (2) Rousettus, (3) Scotonycterini y (4) el «clado endémico de África», que incluye Stenonycterini, Plerotini, Myonycterini y Epomophorini. Se desconoce cuándo llegaron a África, pero varias tribus (Scotonycterini, Stenonycterini, Plerotini, Myonycterini y Epomophorini) ya estaban presentes en el Mioceno tardío. También se desconoce cómo llegaron a África; se ha propuesto que podrían haber llegado a través de Oriente Medio antes de que se volviera más árido al final del Mioceno, o bien podrían haber llegado al continente a través del puente terrestre Gomphotherium, que conectaba la península arábiga con Eurasia. Se plantea que el género Pteropus, que no se encuentra en el continente africano, se ha dispersado desde la Melanesia mediante saltos entre islas a través del océano Índico;[139] algo menos probable para otros géneros de megamurciélagos, que son de menor tamaño y por tanto tienen una capacidad de vuelo más limitada.[117]
Ecolocalización
Los pteropódidos son la única familia de murciélagos sin capacidad de ecolocalización laríngea. No está claro si el antepasado común de todos los murciélagos poseía la capacidad de ecolocación y, por lo tanto, si esta capacidad se perdió en el linaje de los megamurciélagos o si varios linajes de murciélagos la desarrollaron de forma independiente (la superfamilia Rhinolophoidea y el suborden Yangochiroptera).[n 7]
Un estudio realizado en 2017 sobre la ontogenia (desarrollo embrionario) de los murciélagos encontró pruebas de que los embriones de los megamurciélagos tienen inicialmente una cóclea grande y desarrollada similar a la de los micromurciélagos ecolocalizadores, aunque al nacer tienen una cóclea pequeña similar a la de los mamíferos no ecolocalizadores; esta evidencia apoya que la ecolocalización laríngea evolucionó inicialmente entre los murciélagos y se perdió en los pteropódidos, en lugar de evolucionar de manera independiente.[141] Los miembros del género Rousettus poseen una forma primitiva de ecolocación mediante el chasquido de la lengua.[142] Se ha comprobado que algunas especies —Eonycteris spelaea, Cynopterus brachyotis y Macroglossus sobrinus— crean chasquidos similares a los de los murciélagos ecolocalizadores utilizando las alas.[143]
Tanto la ecolocalización como el vuelo son procesos que conllevan un gran coste energético.[144] Los murciélagos ecolocalizadores combinan la producción de sonido con los mecanismos de vuelo, lo que les permite reducir la carga energética adicional de la ecolocalización; en lugar de presurizar un bolo de aire para la producción de sonido, los murciélagos ecolocalizadores laríngeos probablemente utilizan la fuerza del batido de sus alas para presurizar el aire, reduciendo el coste energético al sincronizar el batido de las alas y la ecolocalización.[145] La pérdida de la capacidad de ecolocalización (o la no evolución) entre los megamurciélagos puede deberse a la disociación del vuelo y la ecolocalización.[146] El mayor tamaño corporal medio de los megamurciélagos en comparación con los murciélagos ecolocalizadores,[4] sugiere que un mayor tamaño corporal interrumpe el vínculo entre el vuelo y la ecolocalización y hace que ésta sea demasiado costosa energéticamente para conservarla.[146]
Géneros
La familia Pteropodidae se divide en 6 subfamílias y 46 géneros:[117][88]
Familia Pteropodidae
- subfamilia Cynopterinae[88]
- género Aethalops
- género Alionycteris
- género Balionycteris
- género Chironax
- género Cynopterus
- género Dyacopterus
- género Haplonycteris
- género Latidens
- género Megaerops
- género Otopteropus
- género Penthetor
- género Ptenochirus
- género Sphaerias
- género Thoopterus
- subfamila Eidolinae[117]
- género Eidolon
- subfamila Harpiyonycterinae[117]
- subfamila Nyctimeninae[88]
- género Nyctimene
- género Paranyctimene
- subfamila Pteropodinae
- género Melonycteris[88]
- tribu Pteropodini[88]
- género Acerodon
- género Pteralopex
- género Pteropus
- género Styloctenium
- subfamila Rousettinae
- tribu Eonycterini[117]
- género Eonycteris
- tribu Epomophorini[117][88]
- género Epomophorus
- género Epomops
- género Hypsignathus
- género Micropteropus
- género Nanonycteris
- tribu Myonycterini[117]
- género Megaloglossus
- género Myonycteris
- tribu Plerotini[117]
- género Plerotes
- tribu Rousettini[117]
- género Rousettus
- tribu Scotonycterini[117]
- género Casinycteris
- género Scotonycteris
- tribu Stenonycterini[117]
- género Stenonycteris
- tribu Eonycterini[117]
- Incertae sedis
Relación con los humanos
Como alimento
Los pteropódidos son una fuente de carne de animal silvestre y consumidos en toda su área de distribución. Los murciélagos son una fuente de alimento generalizada en toda Asia, así como en las islas del océano Índico occidental y el Pacífico, donde las especies de Pteropus son objeto de caza intensiva. En el África continental, donde no se encuentra ninguna especie de Pteropus, el megamurciélago de mayor tamaño de la región, Eidolon helvum, es un blanco de caza habitual.[148]
En Guam el consumo de Pteropus mariannus expone a los habitantes a la neurotoxina beta-metilamino-L-alanina (BMAA, por sus siglas en inglés), que puede provocar enfermedades neurodegenerativas; la BMAA puede biomagnificarse en los seres humanos que consumen zorros voladores, que están expuestos a esta toxina al comer frutos de cícadas.[149][150][151]
Como reservorio natural

Los megamurciélagos son un reservorio natural de algunos virus que pueden afectar a los humanos y provocarles enfermedades. Pueden portar filovirus, como el virus del Ébola (Ebolavirus) o el virus de Marburgo (Marburgvirus).[152]
La presencia de Marburgvirus, que causa la fiebre hemorrágica de Marburgo, una enfermedad rara pero en la que la tasa de mortalidad de un brote puede llegar hasta el 88 %, ha sido confirmada en Rousettus aegyptiacus.[152][153] Este virus fue reconocido por primera vez tras brotes simultáneos en Marburgo y Fráncfort (Alemania), así como en Belgrado (Serbia) en 1967,[153] donde 31 personas enfermaron y siete murieron.[154] El virus puede pasar de un murciélago huésped a un humano (que por lo general ha pasado un período prolongado en una mina o cueva donde viven Rousettus aegyptiacus) y propagarse de persona a persona mediante el contacto con fluidos corporales infectados como la sangre y el semen.[153] Los Centros para el Control y Prevención de Enfermedades de Estados Unidos registraron un total de 601 casos confirmados de fiebre hemorrágica de Marburgo entre 1967 y 2014, de los cuales 373 personas murieron (tasa de mortalidad del 62 %).[154]
Entre las especies de pteropódidos en las que se ha confirmado la presencia de Ebolavirus se encuentran Epomops franqueti, Hypsignathus monstrosus y Myonycteris torquata. Además se han identificado anticuerpos contra el virus del Ébola en Eidolon helvum, Epomophorus gambianus, Micropteropus pusillus, Nanonycteris veldkampii, Rousettus leschenaultii y Rousettus aegyptiacus.[152] Aunque se desconoce en gran medida la forma en que los humanos contraen el virus del Ébola, los científicos tienen la hipótesis de que los humanos se infectan inicialmente a través del contacto con un animal infectado como un megamurciélago o un primate[155] y posteriormente se transmite entre humanos a través de fluidos o secreciones corporales como heces, orina, saliva o semen.[156] Se supone que los megamurciélagos son un reservorio natural del virus del Ébola, aunque no se ha establecido con certeza.[157] También se está investigando a los micromurciélagos como reservorio del virus, ya que en 2019 se descubrió que Miniopterus inflatus albergaba una quinta parte del genoma del virus, aunque no dio positivo para el virus propiamente dicho (a fecha enero de 2019).[158] Debido a la probable asociación entre la infección por Ebolavirus y «la caza, la matanza y la elaboración de productos cárnicos de animales infectados», varios países de África occidental prohibieron la carne de animales silvestres (incluidos los megamurciélagos) o emitieron advertencias al respecto durante la epidemia de ébola de 2014-2016, aunque desde entonces se han levantado muchas prohibiciones.[159]
Especies del género Pteropus pueden transmitir el lisavirus australiano de murciélago, que, junto con el virus de la rabia, causa la rabia. El lisavirus australiano de murciélago fue identificado por primera vez en un ejemplar de Pteropus alecto. La transmisión se produce por la mordedura o el arañazo de un animal infectado, o por la penetración de la saliva del animal infectado en una membrana mucosa o una herida abierta; la simple exposición a sangre, orina o heces de zorros voladores no puede causar infecciones del virus del murciélago australiano. Es muy raro que se transmita a los humanos pero, aunque solo se han registrado tres casos de personas que se infectaron con él en 1996 en Queensland, en todos los casos resultó mortal.[160]
Los zorros voladores también son reservorios de Henipavirus como el virus Hendra y el Nipah. El virus Hendra fue identificado por primera vez en 1994 y rara vez se desarrolla en los seres humanos; entre 1994 y 2013 se han notificado siete casos de este virus que afectaron a personas, aunque cuatro de ellos fueron mortales. No existen casos documentados de transmisión directa entre los zorros voladores y los seres humanos.[161] Se ha planteado la hipótesis de que la vía principal de infección en humanos es a través del contacto con caballos que han entrado en contacto con orina de zorro volador;[162] desde 2012 se dispone de una vacuna para los caballos con el fin de disminuir la probabilidad de infección y transmisión.[163][164]
El virus Nipah se identificó por primera vez en 1998 en Malasia. Desde 1998 se han producido varios brotes de este virus en Malasia, Singapur, la India y Bangladés, que han causado más de 100 víctimas. Un brote en 2018 en Kerala (India) provocó la enfermedad de 19 personas infectadas, 17 de las cuales murieron.[165] La tasa global de mortalidad es del 40 al 75 %. Los seres humanos pueden contagiarse por contacto directo con zorros voladores o sus fluidos, por exposición a un huésped intermedio como los cerdos domésticos, o por contacto con una persona infectada.[166] En un estudio realizado en 2014 sobre Pteropus medius y el virus Nipah se descubrió que, si bien los brotes del virus son más probables en las zonas frecuentadas por los zorros voladores, «la presencia de murciélagos en sí no se considera un factor de riesgo de infección por el virus Nipah». En cambio el consumo de la savia de la palmera datilera (Phoenix dactylifera) es una importante vía de transmisión. La práctica de la recolección de la savia de las palmeras datileras consiste en colocar macetas de recolección en las palmeras datileras y se han observado Pteropus medius lamiendo la savia cuando fluye hacia las cubetas, así como defecando y orinando en las proximidades de las mismas y, de esta manera, los humanos que beben vino de palma pueden estar expuestos a los henipavirus.[167]
Los zorros voladores también pueden transmitir varias enfermedades no letales, como el virus Menangle y el virus de la bahía de Nelson.[168][169] Estos virus raramente afectan a los humanos y se han reportado pocos casos.[168][169] No se sospecha que los megamurciélagos sean vectores de coronavirus.[170]
En la cultura

Los megamurciélagos, en particular los zorros voladores, están presentes en las culturas y tradiciones indígenas y se encuentran en historias populares de Australia y Papúa Nueva Guinea.[171][172] También se representaron en el arte rupestre indígena australiano, como lo demuestran varios ejemplos que se conservan.[173]
Las sociedades indígenas de Oceanía utilizaban partes de zorros voladores como armas funcionales o ceremoniales. En las Islas Salomón los habitantes elaboraban cuchillas a partir de sus huesos para usarlas en lanzas.[174] En Nueva Caledonia decoraban hachas ceremoniales de jade con trenzas de piel de zorro volador.[175] Los asmat de Indonesia representaban alas de zorro volador sus escudos de guerra, pues creían que las alas ofrecían protección a sus guerreros.[176]
Existen referencias modernas e históricas sobre la utilización de partes de zorros voladores como moneda. En Nueva Caledonia su piel trenzada se usó como moneda.[174] En la isla de Makira, que forma parte de las Islas Salomón, los pueblos indígenas todavía cazan zorros voladores tanto por sus dientes como por su carne. Los dientes caninos los ensartan en collares que se usan como moneda;[177] los dientes de Pteropus tonganus son particularmente apreciados ya que suelen ser lo suficientemente grandes como para hacerles agujeros, aunque también utilizan los de Pteropus cognatus, a pesar de sus dientes más pequeños.[178][177]
Notas
- Pequeña protuberancia cartilaginosa situada enfrente de la concha de la oreja, especialmente desarrollada en otros murciélagos.[7]
- Proyección en el hueso frontal cerca del borde superior posterior de la cuenca del ojo. En muchos mamíferos llega hasta el arco cigomático, formando la barra postorbital.
- La relación de intercambio respiratorio (RER, por sus siglas en inglés) es la relación entre la cantidad de dióxido de carbono (CO2) producido en el metabolismo y el oxígeno (O2) utilizado.[26]
- Un picogramo es igual a 978 megabases.[30]
- LINE1 es un tipo de elemento nuclear intercalado largo (LINE, por sus siglas en inglés), un grupo de retrotransposón sin LTR
- En biología, reclutamiento se refiere a la entrada de nuevos individuos en una población mediante reproducción o inmigración.[79]
- Este elemento desconocido de la evolución de los murciélagos ha sido calificado como «un gran desafío en la biología» por algunos autores.[140]
Referencias
- McKenna, M. C.; Bell, S. K. (1997). Classification of mammals: above the species level. Columbia University Press. p. 296. ISBN 9780231528535.
- Flannery, T. (1995). Mammals of the South-West Pacific & Moluccan Islands. Cornell University Press. p. 271. ISBN 0801431506.
- Nowak, R. M.; Walker, E. P.; Kunz, T. H.; Pierson, E. D. (1994). Walker's bats of the world. JHU Press. pp. 48-49. ISBN 9780801849862.
- Hutcheon, J. M.; Garland, T. J. (2004). «Are megabats big?». Journal of Mammalian Evolution 11 (3/4): 257-277. doi:10.1023/B:JOMM.0000047340.25620.89.
- Hutcheon, J. M.; Kirsch, J. A. (2006). «A moveable face: deconstructing the Microchiroptera and a new classification of extant bats». Acta Chiropterologica 8 (1): 1-10. doi:10.3161/1733-5329(2006)8[1:AMFDTM]2.0.CO;2.
- Geist, V.; Kleiman, D. G.; McDade, M. C. (2004). Grzimek's Animal Life Encyclopedia Mammals II 13 (2.ª edición). Gale. p. 309.
- Lawrence, 2003, p. 615.
- Nelson, 1989, p. 4.
- Santana, S. E.; Dial, T. O.; Eiting, T. P.; Alfaro, M. E. (2011). «Roosting Ecology and the Evolution of Pelage Markings in Bats». PLOS One 6 (10): e25845. Bibcode:2011PLoSO...625845S. PMC 3185059. PMID 21991371. doi:10.1371/journal.pone.0025845.
- Hall, L. S.; Richards, G. (2000). Flying Foxes: Fruit and Blossom Bats of Australia. UNSW Press. ISBN 9780868405612.
- Ingleby, S.; Colgan, D. (2003). «Electrophoretic studies of the systematic and biogeographic relationships of the Fijian bat genera Pteropus, Pteralopex, Chaerephon and Notopteris». Australian Mammalogy 25: 13-29. doi:10.1071/AM03013.
- Vaughan, T. A.; Ryan, J. M.; Czaplewski, N. J. (2013). Mammalogy (6.ª edición). Jones & Bartlett Publishers. pp. 255-256. ISBN 9781284032185.
- Miller Jr., Gerrit S. (1907). «The Families and Genera of Bats». United States National Museum Bulletin 57: 63.
- Simmons, Nancy B.; Conway, Tenley M. (2001). «Phylogenetic Relationships of Mormoopid Bats (Chiroptera: Mormoopidae) Based on Morphological Data». Bulletin of the American Museum of Natural History 258: 1-100. ISSN 0003-0090. doi:10.1206/0003-0090(2001)258<0001:PROMBC>2.0.CO;2.
- Lindenau, Christa (2011). «Middle Pleistocene bats (Mammalia: Chiroptera) from the Yarimburgaz Cave in Turkish Thrace (Turkey)». E&G - Quaternary Science Journal 55: 122-148. doi:10.23689/fidgeo-999.
- Tate, G. H. H. (1942). «Results of the Archbold Expeditions No. 48: Pteropodidae (Chiroptera) of the Archbold Collections». Bulletin of the American Museum of Natural History 80: 332-335.
- Giannini, N. P.; Simmons, N. B. (2007). «Element homology and the evolution of dental formulae in megachiropteran bats (Mammalia: Chiroptera: Pteropodidae)». American Museum Novitates 3559: 1-27. doi:10.1206/0003-0082(2007)3559[1:EHATEO]2.0.CO;2.
- Juste, J.; Ibáñez, C. (1993). «An asymmetric dental formula in a mammal, the Sao Tomé Island fruit bat Myonycteris brachycephala (Mammalia: Megachiroptera)». Canadian Journal of Zoology 71 (1): 221-224. doi:10.1139/z93-030.
- Vaughan, T. (1970). «Chapter 3: The Skeletal System». En Wimsatt, W., ed. Biology of Bats. Academic Press. pp. 103-136. ISBN 9780323151191.
- Luo, Z. X.; Kielan-Jaworowska, Z.; Cifelli, R. L. (2004). «Evolution of dental replacement in mammals». Bulletin of Carnegie Museum of Natural History 2004 (36): 159-176. doi:10.2992/0145-9058(2004)36[159:EODRIM]2.0.CO;2.
- Nelson, 1989, p. 5.
- Nowak, R. M.; Pillsbury Walker, E. (1999). Walker's Mammals of the World 1. JHU Press. p. 258. ISBN 9780801857898.
- Bennett, M. B. (1993). «Structural modifications involved in the fore- and hind limb grip of some flying foxes (Chiroptera: Pteropodidae)». Journal of Zoology 229 (2): 237-248. doi:10.1111/j.1469-7998.1993.tb02633.x.
- Schutt, W. A.; Simmons, N. B. (1998). «Morphology and Homology of the Chiropteran Calca, with Comments on the Phylogenetic Relationships of Archaeopteropus». Journal of Mammalian Evolution 5: 2. doi:10.1023/A:1020566902992.
- Maina, J. N.; King, A. S. (1984). «Correlations between structure and function in the design of the bat lung: a morphometric study». Journal of Experimental Biology 11: 43-61.
- Schmidt-Nielsen, Knut (1997). Animal Physiology. Cambridge: Cambridge University Press. p. 171. ISBN 0-521-57098-0.
- Carpenter, R. E. (1986). «Flight Physiology of Intermediate-Sized Fruit Bats (Pteropodidae)». Journal of Experimental Biology 120: 84-93.
- Richards, G. C. (1983). «Fruit-bats and their relatives». En Strahan, R., ed. Complete book of Australian mammals. National Photographic Index of Australian Wildlife (1.ª edición). Londres: Angus & Robertson. pp. 271-273. ISBN 978-0207144547.
- Schmidt-Rhaesa, A., ed. (2017). Comparative Anatomy of the Gastrointestinal Tract in Eutheria II. Walter de Gruyter GmbH & Co KG. pp. 328-330. ISBN 9783110560671.
- Dolezel, J.; Bartoš, J.; Voglmayr, H.; Greilhuber, J. (2003). «Nuclear DNA content and genome size of trout and human». Cytometry Part A 51 (2): 127-128. PMID 12541287. doi:10.1002/cyto.a.10013.
- Smith, J. D. L.; Gregory, T. R. (2009). «The genome sizes of megabats (Chiroptera: Pteropodidae) are remarkably constrained». Biology Letters 5 (3): 347-351. PMC 2679926. PMID 19324635. doi:10.1098/rsbl.2009.0016.
- Müller, B.; Goodman, S. M.; Peichl, L. (2007). «Cone Photoreceptor Diversity in the Retinas of Fruit Bats (Megachiroptera)». Brain, Behavior and Evolution 70 (2): 90-104. PMID 17522478. doi:10.1159/000102971.
- Graydon, M.; Giorgi, P.; Pettigrew, J. (1987). «Vision in Flying-Foxes (Chiroptera:Pteropodidae)». Journal of the Australian Mammal Society 10 (2): 101-106.
- Thiagavel, J.; Cechetto, C.; Santana, S. E.; Jakobsen, L.; Warrant, E. J.; Ratcliffe, J. M. (2018). «Auditory opportunity and visual constraint enabled the evolution of echolocation in bats». Nature Communications 9 (1): 98. Bibcode:2018NatCo...9...98T. PMC 5758785. PMID 29311648. doi:10.1038/s41467-017-02532-x.
- Giannini, N. P.; Almeida, F. C.; Simmons, N. B.; Helgen, K. M. (2008). «The systematic position of Pteropus leucopterus and its bearing on the monophyly and relationships of Pteropus (Chiroptera: Pteropodidae)». Acta Chiropterologica 10: 11-20. doi:10.3161/150811008X331054.
- Schwab, I. R. (2005). «A choroidal sleight of hand». British Journal of Ophthalmology 89 (11): 1398. PMC 1772916. PMID 16267906. doi:10.1136/bjo.2005.077966.
- Jones, G.; Teeling, E. C.; Rossiter, S. J. (2013). «From the ultrasonic to the infrared: Molecular evolution and the sensory biology of bats». Frontiers in Physiology 4: 117. PMC 3667242. PMID 23755015. doi:10.3389/fphys.2013.00117.
- Wood, W. F.; Walsh, A.; Seyjagat, J.; Weldon, P. J. (2005). «Volatile Compounds in Shoulder Gland Secretions of Male Flying Foxes, Genus Pteropus (Pteropodidae, Chiroptera)». Z Naturforsch C 60 (9-10): 779-784. PMID 16320623. doi:10.1515/znc-2005-9-1019.
- Wagner, J. (2008). «Glandular secretions of male Pteropus (Flying foxes): preliminary chemical comparisons among species». Independent Study Project (Isp) Collection.
- Li, D.; Zhang, J. (2014). «Diet Shapes the Evolution of the Vertebrate Bitter Taste Receptor Gene Repertoire». Molecular Biology and Evolution 31 (2): 303-309. PMC 3907052. PMID 24202612. doi:10.1093/molbev/mst219.
- Mickleburgh, Hutson y Racey, 1992, p. 6.
- Luzynski, K.; Sluzas, E.; Wallen, M. (2009). «Pteropodidae. Old World fruit bats». Animal Diversity Web. Consultado el 11 de noviembre de 2020.
- Hengjan, Yupadee; Iida, Keisuke; Doysabas, Karla C. C.; Phichitrasilp, Thanmaporn; Ohmori, Yasushige; Hondo, Eiichi (2017). «Diurnal behavior and activity budget of the golden-crowned flying fox (Acerodon jubatus) in the Subic bay forest reserve area, the Philippines». Journal of Veterinary Medical Science 79 (10): 1667-1674. PMC 5658557. PMID 28804092. doi:10.1292/jvms.17-0329.
- Heideman, P. D. (1988). «The timing of reproduction in the fruit bat Haplonycteris fischeri (Pteropodidae): Geographic variation and delayed development». Journal of Zoology 215 (4): 577-595. doi:10.1111/j.1469-7998.1988.tb02396.x.
- Nowak, R. M.; Pillsbury Walker, E. (1999). Walker's Mammals of the World 1. JHU Press. p. 287. ISBN 9780801857898.
- Fox, S.; Spencer, H.; O'Brien, G. M. (2008). «Analysis of twinning in flying-foxes (Megachiroptera) reveals superfoetation and multiple-paternity». Acta Chiropterologica 10 (2): 271-278. doi:10.3161/150811008X414845.
- Sreenivasan, M. A.; Bhat, H. R.; Geevarghese, G. (1974). «Observations on the Reproductive Cycle of Cynopterus sphinx sphinx Vahl, 1797 (Chiroptera: Pteropidae)». Journal of Mammalogy 55 (1): 200-202. JSTOR 1379269. PMID 4819592. doi:10.2307/1379269.
- Douglass Hayssen, Van Tienhoven y Van Tienhoven, 1993, pp. 85-87.
- Altringham, J. D.; McOwat, T.; Hammond, L. (2011). Bats: from evolution to conservation (2.ª edición). Oxford y Nueva York: Oxford University Press. p. xv. ISBN 978-0-19-920711-4.
- Kunz, T. H.; Kurta, A. (1987). «Size of bats at birth and maternal investment during pregnancy». Symposia of the Zoological Society of London 57: 79-106.
- Safi, K. (2008). «Social Bats: The Males' Perspective». Journal of Mammalogy 89 (6): 1342-1350. doi:10.1644/08-MAMM-S-058.1.
- Crichton, E. G.; Krutzsch, P. H., eds. (2000). Reproductive Biology of Bats. Academic Press. p. 433. ISBN 9780080540535.
- Douglass Hayssen, Van Tienhoven y Van Tienhoven, 1993, p. 89.
- Racey, D. N.; Peaker, M.; Racey, P. A. (2009). «Galactorrhoea is not lactation». Trends in Ecology & Evolution 24 (7): 354-355. PMID 19427057. doi:10.1016/j.tree.2009.03.008.
- Kunz, T. H; Hosken, David J (2009). «Male lactation: Why, why not and is it care?». Trends in Ecology & Evolution 24 (2): 80-85. PMID 19100649. doi:10.1016/j.tree.2008.09.009.
- Schoeman, M. C.; Goodman, S. M. (2012). «Vocalizations in the Malagasy Cave-Dwelling Fruit Bat, Eidolon dupreanum: Possible Evidence of Incipient Echolocation?». Acta Chiropterologica 14 (2): 409-416. doi:10.3161/150811012X661729.
- «Hammer-headed Fruit Bat». Bats Magazine 34 (1). 2015.
- Loveless, A. M.; McBee, K. (2017). «Nyctimene robinsoni (Chiroptera: Pteropodidae)». Mammalian Species 49 (949): 68-75. doi:10.1093/mspecies/sex007.
- Prat, Y.; Taub, M.; Yovel, Y. (2015). «Vocal learning in a social mammal: Demonstrated by isolation and playback experiments in bats». Science Advances 1 (2): e1500019. ISSN 2375-2548. PMC 4643821. PMID 26601149. doi:10.1126/sciadv.1500019.
- Vernes, S. C. (2017). «What bats have to say about speech and language». Psychonomic Bulletin & Review 24 (1): 111-117. PMC 5325843. PMID 27368623. doi:10.3758/s13423-016-1060-3.
- Prat, Y.; Azoulay, L.; Dor, R.; Yovel, Y. (2017). «Crowd vocal learning induces vocal dialects in bats: Playback of conspecifics shapes fundamental frequency usage by pups». PLOS Biology 15 (10): e2002556. ISSN 1545-7885. PMC 5663327. PMID 29088225. doi:10.1371/journal.pbio.2002556.
- Zimmer, K. (2018). «What Bat Quarrels Tell Us About Vocal Learning». The Scientist.
- Harten, L.; Prat, Y.; Ben Cohen, S.; Dor, R.; Yovel, Y. (2019). «Food for Sex in Bats Revealed as Producer Males Reproduce with Scrounging Females». Current Biology 29 (11): 1895-1900.e3. PMID 31130455. doi:10.1016/j.cub.2019.04.066.
- Sugita, N. (2016). «Homosexual Fellatio: Erect Penis Licking between Male Bonin Flying Foxes Pteropus pselaphon». PLOS One 11 (11): e0166024. Bibcode:2016PLoSO..1166024S. PMC 5100941. PMID 27824953. doi:10.1371/journal.pone.0166024.
- Tan, M.; Jones, G.; Zhu, G.; Ye, J.; Hong, T.; Zhou, S.; Zhang, S.; Zhang, L. (2009). «Fellatio by Fruit Bats Prolongs Copulation Time». PLOS One 4 (10): e7595. Bibcode:2009PLoSO...4.7595T. PMC 2762080. PMID 19862320. doi:10.1371/journal.pone.0007595.
- Pierson y Rainey, 1992, p. 9.
- Mickleburgh, Hutson y Racey, 1992, p. 2.
- Dumont, E. R.; O'Neal, R. (2004). «Food Hardness and Feeding Behavior in Old World Fruit Bats (Pteropodidae)». Journal of Mammalogy 85: 8-14. doi:10.1644/BOS-107.
- Yin, Q.; Zhu, L.; Liu, D.; Irwin, D. M.; Zhang, S.; Pan, Y. (2016). «Molecular Evolution of the Nuclear Factor (Erythroid-Derived 2)-Like 2 Gene Nrf2 in Old World Fruit Bats (Chiroptera: Pteropodidae)». PLOS One 11 (1): e0146274. Bibcode:2016PLoSO..1146274Y. PMC 4703304. PMID 26735303. doi:10.1371/journal.pone.0146274.
- Nelson, 1989, p. 10.
- Courts, S. E. (1998). «Dietary strategies of Old World Fruit Bats (Megachiroptera, Pteropodidae): How do they obtain sufficient protein?». Mammal Review 28 (4): 185-194. doi:10.1046/j.1365-2907.1998.00033.x.
- Norberg, U. M.; Rayner, J. M. V. (1987). «Ecological morphology and flight in bats (Mammalia: Chiroptera): wing adaptations, flight performance, foraging strategy and echolocation». Philosophical Transactions of the Royal Society B 316 (1179): 335-427. Bibcode:1987RSPTB.316..335N. doi:10.1098/rstb.1987.0030.
- Hodgkison, R.; Balding, S. T.; Zubaid, A.; Kunz, T. H. (2003). «Fruit Bats (Chiroptera: Pteropodidae) as Seed Dispersers and Pollinators in a Lowland Malaysian Rain Forest1». Biotropica 35 (4): 491-502. doi:10.1111/j.1744-7429.2003.tb00606.x.
- Shilton, L. A.; Altringham, J. D.; Compton, S. G.; Whittaker, R. J. (1999). «Old World fruit bats can be long-distance seed dispersers through extended retention of viable seeds in the gut». Proceedings of the Royal Society of London. Series B: Biological Sciences 266 (1416): 219-223. PMC 1689670. doi:10.1098/rspb.1999.0625.
- Oleksy, R.; Racey, P. A.; Jones, G. (2015). «High-resolution GPS tracking reveals habitat selection and the potential for long-distance seed dispersal by Madagascan flying foxes Pteropus rufus». Global Ecology and Conservation 3: 678-692. doi:10.1016/j.gecco.2015.02.012.
- Corlett, R. T. (2017). «Frugivory and seed dispersal by vertebrates in tropical and subtropical Asia: An update». Global Ecology and Conservation 11: 1-22. doi:10.1016/j.gecco.2017.04.007.
- Reeder, D. M.; Kunz, T. H.; Widmaier, E. P. (2004). «Baseline and stress-induced glucocorticoids during reproduction in the variable flying fox, Pteropus hypomelanus (Chiroptera: Pteropodidae)». Journal of Experimental Zoology. 301A (8): 682-690. PMID 15286948. doi:10.1002/jez.a.58.
- Buden, D.; Helgen, K. M.; Wiles, G. (2013). «Taxonomy, distribution, and natural history of flying foxes (Chiroptera, Pteropodidae) in the Mortlock Islands and Chuuk State, Caroline Islands». ZooKeys (345): 97-135. PMC 3817444. PMID 24194666. doi:10.3897/zookeys.345.5840.
- Lawrence, 2003, p. 535.
- Esselstyn, J. A.; Amar, A.; Janeke, D. (2006). «Impact of Posttyphoon Hunting on Mariana Fruit Bats (Pteropus mariannus)». Pacific Science 60 (4): 531-532. doi:10.1353/psc.2006.0027.
- Mickleburgh, Hutson y Racey, 1992, p. 5.
- Adame, M. F.; Jardine, T. D.; Fry, B.; Valdez, D.; Lindner, G.; Nadji, J.; Bunn, S. E. (2018). «Estuarine crocodiles in a tropical coastal floodplain obtain nutrition from terrestrial prey». PLOS One 13 (6): e0197159. Bibcode:2018PLoSO..1397159A. PMC 5991389. PMID 29874276. doi:10.1371/journal.pone.0197159.
- Ramasindrazana, B.; Goodman, S. M.; Gomard, Y.; Dick, C. W.; Tortosa, P. (2017). «Hidden diversity of Nycteribiidae (Diptera) bat flies from the Malagasy region and insights on host-parasite interactions». Parasites & Vectors 10 (1): 630. PMC 5747079. PMID 29284533. doi:10.1186/s13071-017-2582-x.
- Ramanantsalama, R. V.; Andrianarimisa, A.; Raselimanana, A. P.; Goodman, S. M. (2018). «Rates of hematophagous ectoparasite consumption during grooming by an endemic Madagascar fruit bat». Parasites & Vectors 11 (1): 330. PMC 5984742. PMID 29859123. doi:10.1186/s13071-018-2918-1.
- Desch, C. E. (1981). «A new species of demodicid mite (Acari: Prostigmata) from Western Australia parasitic on Macroglossus minimus (Chiroptera: Pteropodidae)». Records of the Western Australian Museum 9 (1): 41-47.
- Nelson, 1989, p. 11.
- Landau, I.; Chavatte, J. M.; Karadjian, G.; Chabaud, A.; Beveridge, I. (2012). «The haemosporidian parasites of bats with description of Sprattiella alectogen. Nov., sp. Nov». Parasite 19 (2): 137-146. PMC 3671437. PMID 22550624. doi:10.1051/parasite/2012192137.
- Almeida, F. C.; Giannini, N. P.; Desalle, R.; Simmons, N. B. (2011). «Evolutionary relationships of the old world fruit bats (Chiroptera, Pteropodidae): Another star phylogeny?». BMC Evolutionary Biology 11: 281. doi:10.1186/1471-2148-11-281.
- Kingdon, J.; Happold, D.; Butynski, T.; Hoffmann, M.; Happold, M.; Kalina, J. (2013). Mammals of Africa 4. A&C Black. p. 226. ISBN 9781408189962.
- Benda, P.; Vallo, P.; Hulva, P.; Horáček, I. (2012). «The Egyptian fruit bat Rousettus aegyptiacus (Chiroptera: Pteropodidae) in the Palaearctic: Geographical variation and taxonomic status». Biologia 67 (6). doi:10.2478/s11756-012-0105-y.
- Mickleburgh, S.; Hutson, A. M.; Bergmans, W.; Fahr, J.; Racey, P. A. (2008). «Eidolon helvum». The IUCN Red List of Threatened Species 2008: e.T7084A12824968. doi:10.2305/IUCN.UK.2008.RLTS.T7084A12824968.en.
- Zhang, Jin-Shuo; Jones, G.; Zhang, Li-Biao; Zhu, Guang-Jian; Zhang, Shu-Yi (2010). «Recent Surveys of Bats (Mammalia: Chiroptera) from China II. Pteropodidae». Acta Chiropterologica 12: 103-116. doi:10.3161/150811010X504626.
- Vincenot, C. (2017). «Pteropus dasymallus». The IUCN Red List of Threatened Species (IUCN): e.T18722A22080614. doi:10.2305/IUCN.UK.2017-2.RLTS.T18722A22080614.en.
- Maeda, K. (2008). «Pteropus loochoensis». The IUCN Red List of Threatened Species 2008: e.T18773A8614831. doi:10.2305/IUCN.UK.2008.RLTS.T18773A8614831.en.
- Vincenot, C. (2017). «Pteropus pselaphon». The IUCN Red List of Threatened Species (IUCN): e.T18752A22085351. doi:10.2305/IUCN.UK.2017-2.RLTS.T18752A22085351.en.
- Allison, A.; Bonaccorso, F.; Helgen, K.; James, R. (2008). «Pteropus mariannus». The IUCN Red List of Threatened Species (IUCN): e.T18737A8516291. doi:10.2305/IUCN.UK.2008.RLTS.T18737A8516291.en.
- «Family Pteropodidae». The IUCN Red List of Threatened Species (IUCN).
- Nelson, 1989, p. 3.
- Nelson, 1989, p. 7.
- Tait, J.; Perotto-Baldivieso, H. L.; McKeown, A.; Westcott, D. A. (2014). «Are Flying-Foxes Coming to Town? Urbanisation of the Spectacled Flying-Fox (Pteropus conspicillatus) in Australia». PLOS One 9 (10): e109810. Bibcode:2014PLoSO...9j9810T. PMC 4190360. PMID 25295724. doi:10.1371/journal.pone.0109810.
- Jones, K. E.; Mickleburgh, S. P.; Sechrest, W.; Walsh, A. L. «Global Overview of the Conservation of Island Bats: Importance, Challenges, and Opportunities». En Fleming, T. H.; Racey, P. A., eds. Evolution ecology and conservation of Island bats. University of Chicago Press. pp. 496-530.
- Pierson y Rainey, 1992, p. 11.
- Aziz, S. A.; Olival, K. J.; Bumrungsri, S.; Richards, G. C.; Racey, P. A. (2016). «The Conflict Between Pteropodid Bats and Fruit Growers: Species, Legislation and Mitigation». En Voigt, C.; Kingston, T., eds. Bats in the Anthropocene: Conservation of Bats in a Changing World. Springer. ISBN 978-3-319-25220-9. doi:10.1007/978-3-319-25220-9_13.
- Mickleburgh, Hutson y Racey, 1992, p. 7.
- Mickleburgh, Hutson y Racey, 1992, p. 8.
- Mildenstein, T.; Tanshi, I.; Racey, P. A. (2016). «Exploitation of Bats for Bushmeat and Medicine». Bats in the Anthropocene: Conservation of Bats in a Changing World. Springer. p. 327. ISBN 978-3-319-25218-6. doi:10.1007/978-3-319-25220-9_12.
- Vincenot, C. E.; Koyama, L.; Russo, D. (2015). «Near threatened? First report of unsuspected human-driven decline factors in the Ryukyu flying fox (Pteropus dasymallus) in Japan». Mammalian Biology - Zeitschrift für Säugetierkunde 80 (4): 273-277. doi:10.1016/j.mambio.2015.03.003.
- Vincenot, C. E.; Florens, F. B. V.; Kingston, T. (2017). «Can we protect island flying foxes?». Science 355 (6332): 1368-1370. Bibcode:2017Sci...355.1368V. PMID 28360279. doi:10.1126/science.aam7582.
- McIlwee, A. P.; Martin, L. (2002). «On the intrinsic capacity for increase of Australian flying-foxes (Pteropus spp., Megachiroptera)». Australian Zoologist 32: 76-100. doi:10.7882/AZ.2002.008.
- Martin, L. (2011). «Is the fruit you eat flying-fox friendly? The effects of orchard electrocution grids on Australian flying-foxes (Pteropus spp., Megachiroptera)». The Biology and Conservation of Australasian Bats. Royal Zoological Society of New South Wales. pp. 380-390. ISBN 978-0-9803272-4-3. doi:10.7882/FS.2011.039.
- Chlopicki, K. (28 de octubre de 2016). «Electric wires threaten flying foxes and their new babies». The Daily Telegraph. Consultado el 26 de noviembre de 2020.
- Welbergen, J. A.; Klose, S. M.; Markus, N.; Eby, P. (2008). «Climate change and the effects of temperature extremes on Australian flying-foxes». Proceedings of the Royal Society B: Biological Sciences 275 (1633): 419-425. PMC 2596826. PMID 18048286. doi:10.1098/rspb.2007.1385.
- Buden, D.; Helgen, K. M.; Wiles, G. (2013). «Taxonomy, distribution, and natural history of flying foxes (Chiroptera, Pteropodidae) in the Mortlock Islands and Chuuk State, Caroline Islands». ZooKeys (345): 124. PMC 3817444. PMID 24194666. doi:10.3897/zookeys.345.5840.
- Pierson y Rainey, 1992, p. 10.
- Valdez, E. W. (2010). «Population Assessment of the Mariana Fruit Bat (Pteropus mariannus mariannus) on Anatahan, Sarigan, Guguan, Alamagan, Pagan, Agrihan, Asuncion, and Maug». USGS. p. 2. Archivado desde el original el 23 de marzo de 2019. Consultado el 30 de octubre de 2020.
- Fleming, T. H.; Racey, P. A., eds. (2010). Island Bats: Evolution, Ecology, and Conservation. University of Chicago Press. p. 415. ISBN 9780226253312.
- Almeida, F.; Giannini, N. P.; Simmons, N. B. (2016). «The Evolutionary History of the African Fruit Bats (Chiroptera: Pteropodidae)». Acta Chiropterologica 18 (1): 73-90. doi:10.3161/15081109ACC2016.18.1.003.
- Gray, J. E. (1821). «On the natural arrangement of vertebrose animals». London Medical Repository (25): 299 – via Rhino Resource Center.
- Real Academia Española. «ptero-». Diccionario de la lengua española (23.ª edición).
- Real Academia Española. «podo-». Diccionario de la lengua española (23.ª edición).
- Jackson, Jackson y Groves, 2015, p. 230.
- Dobson, G. E. (1875). «Conspectus of the suborders, families, and genera of Chiroptera arranged according to their natural affinities». The Annals and Magazine of Natural History; Zoology, Botany, and Geology. 4 16 (95).
- Springer, M. S.; Teeling, E. C.; Madsen, O.; Stanhope, M. J.; De Jong, W. W. (2001). «Integrated fossil and molecular data reconstruct bat echolocation». Proceedings of the National Academy of Sciences 98 (11): 6241-6246. doi:10.1073/pnas.111551998.
- Lei, M.; Dong, D. (2016). «Phylogenomic analyses of bat subordinal relationships based on transcriptome data». Scientific Reports 6 (27726): 27726. doi:10.1038/srep27726.
- Tsagkogeorga, G.; Parker, J.; Stupka, E.; Cotton, J. A.; Rossiter, S. J. (2013). «Phylogenomic Analyses Elucidate the Evolutionary Relationships of Bats». Current Biology 23 (22): 2262-2267. doi:10.1016/j.cub.2013.09.014.
- Szcześniak, M.; Yoneda, M.; Sato, H.; Makałowska, I.; Kyuwa, S.; Sugano, S.; Suzuki, Y.; Makałowski, W. et al. (2014). «Characterization of the mitochondrial genome of Rousettus leschenaulti». Mitochondrial DNA 25 (6): 443-444. doi:10.3109/19401736.2013.809451.
- Teeling, E. C.; Springer, M. S.; Madsen, O.; Bates, P.; O'Brien, S. J.; Murphy, W. J. (2005). «A Molecular Phylogeny for Bats Illuminates Biogeography and the Fossil Record». Science 307 (5709): 580-584. doi:10.1126/science.1105113.
- Jackson, Jackson y Groves, 2015, pp. 520-521.
- Ungar, P. (2010). Mammal Teeth: Origin, Evolution, and Diversity. JHU Press. p. 166. ISBN 978-0-8018-9951-5.
- Giannini, N. P.; Simmons, N. B. (2003). «A phylogeny of megachiropteran bats (Mammalia: Chiroptera: Pteropodidae) based on direct optimization analysis of one nuclear and four mitochondrial genes». Cladistics 19 (6): 496-511. doi:10.1111/j.1096-0031.2003.tb00385.x.
- Colgan, D. J.; Flannery, T. F. (1995). «A Phylogeny of Indo-West Pacific Megachiroptera Based on Ribosomal DNA». Systematic Biology 44 (2): 209-220. doi:10.1093/sysbio/44.2.209.
- Bergmans, W. (1997). «Taxonomy and biogeography of African fruit bats (Mammalia, Megachiroptera). 5. The genera Lissonycteris Andersen, 1912, Myonycteris Matschie, 1899 and Megaloglossus Pagenstecher, 1885; general remarks and conclusions; annex: key to all species». Beaufortia 47 (2): 11-90.
- Butler, P. M. (1984). «Macroscelidea, Insectivora and Chiroptera from the Miocene of east Africa». Palaeovertebrata 14 (3): 117-200.
- Gunnell, G. F.; Boyer, D. M.; Friscia, A. R.; Heritage, S.; Manthi, F. K.; Miller, E. R.; Sallam, H. M.; Simmons, N. B.; Stevens, N. J.; Seiffert, E. R. (2018). «Fossil lemurs from Egypt and Kenya suggest an African origin for Madagascar's aye-aye». Nature Communications 9 (1): 3193. doi:10.1038/s41467-018-05648-w.
- Burgin, C. J.; Colella, J. P.; Kahn, P. L.; Upham, N. S. (2018). «How many species of mammals are there?». Journal of Mammalogy 99 (1): 1-14. ISSN 0022-2372. doi:10.1093/jmammal/gyx147.
- «Pteropus». IUCN Red List of Threatened Species. 2019. Consultado el 30 de octubre de 2020.
- Eiting, T. P.; Gunnell, G. F. (2009). «Global Completeness of the Bat Fossil Record». Journal of Mammalian Evolution 16 (3): 151-173. doi:10.1007/s10914-009-9118-x.
- Almeida, F. C.; Giannini, N. P.; Desalle, Rob; Simmons, N. B. (2009). «The phylogenetic relationships of cynopterine fruit bats (Chiroptera: Pteropodidae: Cynopterinae)». Molecular Phylogenetics and Evolution 53 (3): 772-783. PMID 19660560. doi:10.1016/j.ympev.2009.07.035.
- O'Brien, J.; Mariani, C.; Olson, L.; Russell, A. L.; Say, L.; Yoder, A. D.; Hayden, T. J. (2009). «Multiple colonisations of the western Indian Ocean by Pteropus fruit bats (Megachiroptera: Pteropodidae): The furthest islands were colonised first». Molecular Phylogenetics and Evolution 51 (2): 294-303. PMID 19249376. doi:10.1016/j.ympev.2009.02.010.
- Teeling, E. C.; Jones, G.; Rossiter, S. J. (2016). «Phylogeny, Genes, and Hearing: Implications for the Evolution of Echolocation in Bats». En Fenton, M. B.; Grinnell, A. D.; Popper, A. N. et al., eds. Bat Bioacoustics 54. Nueva York: Springer. pp. 25-54. ISBN 9781493935277. doi:10.1007/978-1-4939-3527-7_2.
- Wang, Zhe; Zhu, Tengteng; Xue, Huiling; Fang, Na; Zhang, Junpeng; Zhang, Libiao; Pang, Jian; Teeling, Emma C. et al. (2017). «Prenatal development supports a single origin of laryngeal echolocation in bats». Nature Ecology & Evolution 1 (2): 21. PMID 28812602. doi:10.1038/s41559-016-0021.
- Holland, R. A.; Waters, D. A.; Rayner, J. M. (2004). «Echolocation signal structure in the Megachiropteran bat Rousettus aegyptiacus Geoffroy 1810». The Journal of Experimental Biology 207 (Pt 25): 4361-4369. PMID 15557022. doi:10.1242/jeb.01288.
- Boonman, A.; Bumrungsri, S.; Yovel, Y. (2014). «Nonecholocating fruit bats produce biosonar clicks with their wings». Current Biology 24 (24): 2962-2967. PMID 25484290. doi:10.1016/j.cub.2014.10.077.
- Speakman, J. R.; Racey, P. A. (1991). «No cost of echolocation for bats in flight». Nature 350 (6317): 421-423. PMID 2011191. doi:10.1038/350421a0.
- Lancaster, W. C.; Henson, O. W.; Keating, A. W. (1995). «Respiratory muscle activity in relation to vocalization in flying bats». The Journal of Experimental Biology 198 (Pt 1): 175-191. PMID 7891034.
- Altringham, J. D. (2011). «Echolocation and other senses». Bats: From Evolution to Conservation. Oxford University Press. ISBN 9780199207114.
- Gunnell, Gregg F.; Manthi, Fredrick K. (2018). «Pliocene bats (Chiroptera) from Kanapoi, Turkana Basin, Kenya». Journal of Human Evolution 140: 4. ISSN 0047-2484. PMID 29628118. doi:10.1016/j.jhevol.2018.01.001.
- Mickleburgh, S.; Waylen, K.; Racey, P. (2009). «Bats as bushmeat: A global review». Oryx 43 (2): 217-234. doi:10.1017/s0030605308000938.
- Banack, S. A.; Murch, S. J.; Cox, P. A. (2006). «Neurotoxic flying foxes as dietary items for the Chamorro people, Marianas Islands». Journal of Ethnopharmacology 106 (1): 97-104. PMID 16457975. doi:10.1016/j.jep.2005.12.032.
- Cox, P.; Davis, D.; Mash, D.; Metcalf, J. S.; Banack, S. A. (2016). «Dietary exposure to an environmental toxin triggers neurofibrillary tangles and amyloid deposits in the brain». Proceedings of the Royal Society B 283 (3): 1-10. PMC 4795023. PMID 26791617. doi:10.1098/rspb.2015.2397.
- Holtcamp, W. (2012). «The emerging science of BMAA: do cyanobacteria contribute to neurodegenerative disease?». Environmental Health Perspectives 120 (1823): a110-a116. PMC 3295368. PMID 22382274. doi:10.1289/ehp.120-a110.
- Hassanin, A.; Nesi, N.; Marin, J.; Kadjo, B.; Pourrut, X.; Leroy, É.; Gembu, G.; Musaba Akawa, P.; Ngoagouni, C.; Nakouné, E.; Ruedi, M.; Tshikung, D.; Pongombo Shongo, C.; Bonillo, C. (2016). «Comparative phylogeography of African fruit bats (Chiroptera, Pteropodidae) provide new insights into the outbreak of Ebola virus disease in West Africa, 2014-2016». Comptes Rendus Biologies 339 (11-12): 517-528. PMID 27746072. doi:10.1016/j.crvi.2016.09.005.
- «Marburg Haemorrhagic Fever». World Health Organization. Consultado el 22 de noviembre de 2020.
- «Chronology of Marburg Hemorrhagic Fever Outbreaks». Centers for Disease Control and Prevention. 9 de octubre de 2014. Consultado el 22 de noviembre de 2020.
- «Ebola (Ebola Virus Disease): Transmission». Centers for Disease Control and Prevention. 5 de noviembre de 2019. Consultado el 22 de noviembre de 2020.
- «Preguntas frecuentes sobre la enfermedad por el virus del Ebola». Organización Mundial de la Salud. mayo de 2017. Consultado el 22 de noviembre de 2020.
- «Ebola Reservoir Study». Centers for Disease Control and Prevention. 9 de julio de 2018. Consultado el 22 de noviembre de 2020.
- Kupferschmidt, K. (24 de enero de 2019). «This bat species may be the source of the Ebola epidemic that killed more than 11,000 people in West Africa». Science. Consultado el 22 de noviembre de 2020.
- Zon, H.; Petesch, C. (21 de septiembre de 2016). «Post-Ebola, West Africans flock back to bushmeat, with risk». Associated Press. Consultado el 22 de noviembre de 2020.
- «Rabies and Australian bat lyssavirus infection fact sheet». NSW Health. New South Wales Government. 26 de julio de 2019. Consultado el 22 de noviembre de 2020.
- Sánchez, C. A.; Baker, M. L. (2016). «Disease Risk Perception and Safety Practices: A Survey of Australian Flying Fox Rehabilitators». PLOS Neglected Tropical Diseases 10 (2): e0004411. PMC 4734781. PMID 26829399. doi:10.1371/journal.pntd.0004411.
- «Hendra Virus Disease(HeV)». Centers for Disease Control and Prevention. U. S. Department of Health & Human Services. Consultado el 22 de noviembre de 2020.
- «Hendra Virus». The Australian Veterinary Association. 19 de octubre de 2018. Consultado el 22 de noviembre de 2020.
- «The Hendra vaccine». Vet Voice. Australian Veterinary Association. Archivado desde el original el 14 de junio de 2018. Consultado el 22 de noviembre de 2020.
- Gulland, A. (12 de junio de 2018). «Nipah virus 'under control' in India - but Britain and the world must be alert for signs of infected travellers». The Telegraph. Consultado el 23 de noviembre de 2020.
- «Nipah virus». World Health Organization. 30 de mayo de 2018. Consultado el 23 de noviembre de 2020.
- Hahn, M. B.; Epstein, J. H.; Gurley, E. S.; Islam, M. S.; Luby, S. P.; Daszak, P.; Patz, J. A. (2014). «Roosting behaviour and habitat selection of Pteropus giganteus reveal potential links to Nipah virus epidemiology». Journal of Applied Ecology 51 (2): 376-387. PMC 4000083. PMID 24778457. doi:10.1111/1365-2664.12212.
- Bowden, T. R.; Westenberg, M.; Wang, L.; Eaton, B. T.; Boyle, D. B. (2001). «Molecular Characterization of Menangle Virus, a Novel Paramyxovirus which Infects Pigs, Fruit Bats, and Humans». Virology Journal 283 (2): 358-373. PMID 11336561. doi:10.1006/viro.2001.0893.
- Yamanaka, A. et al. (2014). «Imported Case of Acute Respiratory Tract Infection Associated with a Member of Species Nelson Bay Orthoreovirus». PLOS One 9 (3): e92777. Bibcode:2014PLoSO...992777Y. PMC 3965453. PMID 24667794. doi:10.1371/journal.pone.0092777.
- Smith, I.; Wang, L. (2013). «Bats and their virome: An important source of emerging viruses capable of infecting humans». Current Opinion in Virology 3 (1): 84-91. PMC 7102720. PMID 23265969. doi:10.1016/j.coviro.2012.11.006.
- Campbell-McLeod, P. (2013). «Nallawilli-Sit Down (and Listen): The Dreamtime Stories - An Oral Tradition». En MacDonald, M. R., ed. Traditional Storytelling Today: An International Sourcebook. Routledge. pp. 158-159. ISBN 978-1135917142.
- Slone, T. H., ed. (2001). One Thousand One Papua New Guinean Nights: Tales from 1972-1985 1. Masalai Press. ISBN 978-0971412712.
- Parish, S.; Richards, G.; Hall, L. (2012). A natural history of Australian Bats: working the night shift. Csiro Publishing. ISBN 978-0643103764.
- Joyce, T. A.; Dalton, O. M. (1910). British Museum. Dept. of British and Mediaeval Antiquities and Ethnography, ed. Handbook to the Ethnographical Collections. Oxford University Press. p. 125.
- Machray, R. (1899). «Strange Kinds of Money». The Harmsworth Monthly Pictorial Magazine 1: 639-641.
- Werness; H. B. (2003). Continuum Encyclopedia of Native Art: Worldview, Symbolism, and Culture in Africa, Oceania, and North America. A&C Black. p. 31. ISBN 978-0826414656.
- Choi, Ch. (16 de octubre de 2017). «In Makira, Flying Fox Teeth Are Currency…And That Could Save the Species». Discover. Kalmbach Media. Consultado el 25 de noviembre de 2020.
- Lavery, T. H.; Fasi, J. (2017). «Buying through your teeth: Traditional currency and conservation of flying foxes Pteropus spp. In Solomon Islands». Oryx 53 (3): 1-8. doi:10.1017/S0030605317001004.
Bibliografía
- Douglass Hayssen, V.; Van Tienhoven, Ari; Van Tienhoven, Ans (1993), Asdell's Patterns of Mammalian Reproduction: A Compendium of Species-specific Data, Cornell University Press, ISBN 9780801417535.
- Jackson, S.; Jackson, S. M.; Groves, C. (2015), Taxonomy of Australian Mammals, Csiro Publishing, ISBN 9781486300136.
- Lawrence, E., ed. (2003), Diccionario Akal de términos biológicos, Traducido por Codes, R. y Espino, F. J., Akal Ediciones, ISBN 84-460-1582-X.
- Mickleburgh, S. P.; Hutson, A. M.; Racey, P. A. (1992), Old World fruit bats: An action plan for their conservation, Gland, Suiza: Unión Internacional para la Conservación de la Naturaleza, ISBN 2-8317-0055-8.
- Nelson, J. E. (1989), «Pteropodidae», en Walton, D. W.; Richardson, B. J., eds., Fauna of Australia - Volume 1B: Mammalia, Australian Government Department of the Environment and Energy, ISBN 0-644-06056-5.
- Pierson, E. D.; Rainey, W. E. (1992), The biology of flying foxes of the genus Pteropus: a review, en Wilson, Don E.; Graham, Gary L., eds., «Pacific Island Flying Foxes: Proceedings of an International Conservation Conference», Biological Report 90 (23): 1-17.


_Photograph_By_Shantanu_Kuveskar.jpg.webp)
_Kolkata_West_Bengal_India_27042013.png.webp)

.jpg.webp)

_(cropped).jpg.webp)

