Metaloceno
En química, y en particular en química organometálica, un metaloceno es un compuesto de fórmula general (C5R5)2M que consiste en dos aniones ciclopentadienilo (Cp) unidos a un átomo metálico central con estado de oxidación II.
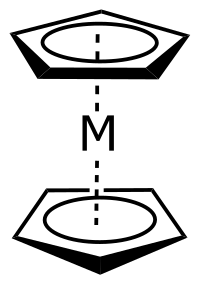
M = átomo metálico.
Existen diferentes tipos de compuestos metaloceno, basándonos en su geometría, dependiendo del metal que soporta los dos anillos de ciclopentadienilo.
Historia
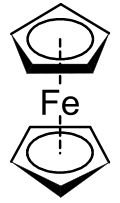
Los metalocenos fueron descubiertos en la década de 1950. El ferroceno es el compuesto metaloceno más conocido y el primero en descubrirse. Fue descubierto simultáneamente en 1951 por Keally y Pauson,[1] y Miller.[2] Keally y Pauson estaban tratando de sintetizar fulvaleno a través de la oxidación de un reactivo de Grignard de ciclopentadienilo con FeCl3 anhidro, cuando descubrieron un compuesto C10H10Fe como producto.[1][2]

Al mismo tiempo, Miller y sus compañeros informaron del mismo producto de hierro a partir de una reacción de ciclopentadieno con hierro en presencia de aluminio, potasio, o de óxidos de molibdeno.[2]

La estructura fue determinada independiente por Wilkinson[3] y Fischer[4] y fueron galardonados con el Premio Nobel de Química en 1973 por su trabajo sobre compuestos sándwich, incluyendo también la determinación estructural del ferroceno.[3] Se determinó que los átomos de carbono del ligando ciclopentadienilo (Cp) contribuyen por igual a la unión al metal, y que la unión se produce entre los orbitales d del metal y los electrones-π de los orbitales p de los ligandos Cp. Este complejo es conocido ahora como ferroceno, y el grupo de compuestos de metales de transición diciclopentadienilo se conocen como metalocenos, y tienen la fórmula general [(η5-C5H5)2M]. Fischer y su grupo fueron los primeros en preparar los derivados del ferroceno que implican Co y Ni en vez de Fe.
Síntesis
Hay tres rutas principales que se emplean normalmente en la formación de estos tipos de compuestos:[5]
1.- Uso de una sal metálica y reactivos de ciclopentadienilo:
- El ciclopentadienuro sodio (NaCp) es el reactivo preferido para este tipo de reacciones.
- MCl2 + 2 NaC5H5 → (C5H5)2M + 2 NaCl (M = V, Cr, Mn, Fe, Co; disolvente = THF, DME, NH3)
- CrCl3 + 3 NaC5H5 → [(C5H5)2Cr] + ½ C10H10 + 3 NaCl
2.- Uso de un metal y ciclopentadieno:
- Esta técnica ofrece ventajas sintéticas al utilizar los átomos de metal en la fase de vapor en vez del metal sólido. Los átomos o moléculas altamente reactivas se generan a una temperatura alta al vacío y se unen con los reactivos elegidos sobre una superficie fría.
- M + C5H6 → MC5H5 + ½ H2 (M = Li, Na, K)
- M + 2 C5H6 → [(C5H5)2M] + H2 (M = Mg, Fe)
3.- Uso de una sal metálica y ciclopentadieno:
- Si la sal de metal tiene poca basicidad no es capaz de desprotonar el ciclopentadieno, por lo que puede utilizarse una base fuerte para producir aniones ciclopentadienilo in situ:
- Tl2SO4 + 2 C5H6 + 2 OH− → 2 TlC5H5 + 2 H2O + SO42−
- Muchos otros métodos se han desarrollado. El cromoceno puede prepararse a partir de hexacarbonilo de cromo, por reacción directa con ciclopentadieno en presencia de dietilamina, en este caso, la desprotonación formal del ciclopentadieno es seguida por la reducción de los protones resultantes a gas hidrógeno, lo que facilita la oxidación del centro metálico:[6]
- Cr(CO)6 + 2 C5H6 → Cr(C5H5)2 + 6 CO + H2
- Los metalocenos tienen generalmente una alta estabilidad térmica. El ferroceno puede ser sublimado al aire a más de 100 °C sin descomponerse; los metalocenos se purifican generalmente mediante sublimación al vacío. Además, los metalocenos de carga neutra son solubles en disolventes orgánicos comunes. Los alquilo-sustituidos derivados son particularmente solubles, incluso en disolventes tan apolares como los alcanos.
Metalocenos más importantes[7]
| Fórmula | Color | Punto de fusión (°C) | Datos de interés | Nombre vulgar | Imagen |
|---|---|---|---|---|---|
| "(C5H5)2Ti" | verde | 200 (desc.) | dímero de fulvaleno | Titanoceno | 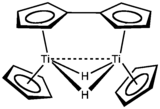 |
| (C5H5)2V | morado | 167 | muy sensible al aire | Vanadoceno |  |
| "(C5H5)2Nb" | amarillo | dímero con uniones η1 y η5 | |||
| (C5H5)2Cr | rojo oscuro | 173 | muy sensible al aire | Cromoceno | 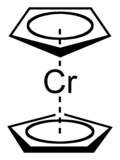 |
| (C5H5)2Mn | marrón | 173 | muy sensible al aire | Manganoceno |  |
| (C5H5)2Fe | naranja | 173 | estable pero fácilmente oxidable | Ferroceno |  |
| (C5H5)2Ru | amarillo pálido | 195 | muy similar al ferroceno | Rutenoceno |  |
| (C5H5)2Co | morado oscuro | 174 | sensible al aire | Cobaltoceno |  |
| (C5H5)2Ni | verde | 173 | lenta oxidación con el aire | Niqueloceno |  |
Referencias
- Kealy, T. J.; Pauson, P. L. (1951). «A New Type of Organo-Iron Compound». Nature 168 (4285): 1039. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0.
- Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). «114. Dicyclopentadienyliron». J. Chem. Soc.: 632-635. doi:10.1039/JR9520000632.
- Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). «The Structure of Iron Bis-Cyclopentadienyl». J. Am. Chem. Soc. 74 (8): 2125-2126. doi:10.1021/ja01128a527.
- Fischer, E. O.; Pfab, W. (1952). «Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels». Z. Naturforsch. B 7: 377-379.
- Long, N. J. (1998). Metallocenes: Introduction to Sandwich Complexes. London: Wiley-Blackwell. ISBN 978-0632041626.
- Fischer, E. O.; Hafner, W. (1955). «Cyclopentadienyl-Chrom-Tricarbonyl-Wasserstoff». Z. Naturforsch. B (en alemán) 10 (3): 140-143.
- Elschenbroich, Christoph (2006). Organometallics. Wiley-VCH. ISBN 3-527-29390-6.