Metilmercurio
El metilmercurio (a veces escrito como metil-mercurio) es un catión organometálico de fórmula química [CH3Hg]+.[1] Se trata de un compuesto neurotóxico capaz de concentrarse en el organismo (bioacumulación) y concentrarse así mismo en las cadenas alimentarias (biomagnificación),[2],[3] que ocupa un lugar especial debido a que un cierto porcentaje de la población mundial está expuesta a él de una forma u otra y su toxicidad está mejor caracterizada por la investigación médica que la de otros compuestos orgánicos del mercurio. Sus efectos en el envenenamiento por mercurio son de especial relevancia en los alimentos para los bebés y en los que toman las mujeres durante el embarazo, ya que en este último caso se transfiere por vía de la placenta al feto.[4]

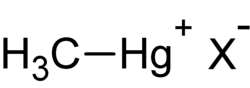
nota: El metilmercurio no debe ser confundido con el etilmercurio, un metabolito del timerosal, usado como preservante en algunas vacunas.
Características químicas
El metilmercurio es una forma abreviada de denominar al monometillmercurio aunque sea más correcto denominarlo como "catión de monometillmercurio". Está compuesto por un grupo metil (CH3-) enlazado a un átomo de mercurio. Su fórmula química es [CH3Hg]+, escrita en la literatura química como MeHg+. Al tratarse de un catión la molécula posee una carga positiva que puede combinarse fácilmente con otros compuestos, generalmente formados por aniones, tales como los cloruros (Cl-), hidróxidos (OH-) y nitratos (NO3-). Posee además una gran afinidad por los compuestos de azufre que contienen aniones como puede ser el sulfihidrilo (-SH) grupos de aminoácidos como la cisteína y por lo tanto en todas las proteínas que contengan la cisteína, formando un enlace covalente. Más de una molécula de cisteína puede coordinarse con el metilmercurio[5] y de esta forma puede migrar a otros enlaces metálicos en las posiciones de las proteínas.[6]
Fuentes del metilmercurio
Ambientales
El metilmercurio presente en el medio ambiente tiene dos orígenes:
- Fuentes antropogénicas: Surge de diversas fases en la industria de procesado del acetaldehído, que es un producto de partida en la síntesis de plásticos, pinturas, lacas, en la industria del caucho, de papel y en la del curtido del cuero. Sin embargo, los procesos causados por el hombre que actualmente generan cantidades importantes de metilmercurio son la combustión de la basura.[7] y la combustión de combustibles fósiles (en especial el carbón).
- Fuentes no antropogénicas: Destacan las emisiones de los volcanes,[8] las rocas que contienen mercurio, como el cinabrio, que reaccionan con la atmósfera, los organismos anaeróbicos presentes en los ríos y lagos que interaccionan con los compuestos de mercurio, los incendios forestales, etc.
Dietéticas
Debido a la formación del metilmercurio en el medio acuático principalmente es preocupante para las autoridades sanitarias la acumulación de metilmercurio en el pescado de gran tamaño.[2] Por regla general se trata del pescado que ocupa las últimas posiciones dentro de la cadena trófica.[9] En algunos casos puede ser biomagnificado en la cadena alimentaria, tal y como puede ocurrir en ciertos pescados proveniente de piscifactorías (que en algunos casos son alimentados a su vez de otros peces).[10],[11],[12] Los animales acuáticos más citados en la literatura científica por su contaminación con mercurio son: el atún denominado albacora (Thunnus alalunga) y el atún de aleta azul (Thunnus thynnus ),[13] el salmón,[10] la lubina,[14] el pez espada y ciertas especies de tiburón,[15] en incluso algunos mamíferos marinos como la beluga.[16]
Efectos sobre la salud
El metilmercurio es un compuesto que se absorbe casi en su totalidad por vía pulmonar y gastrointestinal, mientras que es moderada su absorción por vía dérmica.[17] Se consideraba que la vida media en el cuerpo humano era de unos 40-50 días,[18] pero en la actualidad se ha verificado que en ausencia de tratamiento, el metilmercurio en el cerebro se transforma en mercurio metálico y la vida media de este tipo de mercurio en el cerebro humano se aproxima a los 27,4 años.[19] El metilmercurio se acumula en ciertos órganos internos como puede ser el hígado y los riñones,[20] aunque su acumulación más severa es en el sistema nervioso. Por esto último es un neurotóxico.[3]
El metilmercurio posee una gran capacidad para traspasar la barrera placentaria y la barrera hermatoencefálica, por esto es objeto de especial vigilancia la exposición durante el periodo de embarazo,[21] pudiendo afectar al desarrollo del cerebro fetal. Afecta de igual forma a los infantes.[22] Algunos estudios indican que esta sustancia puede afectar igualmente al sistema cardiovascular.[23] La comunidad científica considera que dentro del grupo de los compuestos orgánicos de mercurio, aquellos como el alquilmercurio (en particular etilmercurio y el mismo metilmercurio), poseen una toxicidad similar (ambos han sido empleados como plaguicidas). Por el contrario, otros compuestos orgánicos que contienen mercurio, como puede ser el fenilmercurio, se asemejan más al mercurio inorgánico en lo que respecta a toxicidad.[18]
Entre las fuentes más preocupantes de metilmercurio se encuentra el pescado que entra en la cadena alimentaria sin controles por parte de las autoridades sanitarias. Un ejemplo es la llamada enfermedad de Minamata,[24] acaecida en la bahía de Minamata en los años 1950 (Japón)[25],[26] debido al consumo de pescado y marisco contaminado con vertidos de mercurio.
Dado que la ingestión de pescado supone beneficios para la salud, se admite que el consumo moderado (menos de 3 raciones semanales de piezas medianas) probablemente no presentará un nivel peligroso de exposición[27],[28],[29],.[30] Sin embargo, el riesgo se incrementa para los grupos poblacionales cuya dieta se basa en el consumo de grandes cantidades de pescado o de mamíferos marinos contaminados.[2]
Referencias
- «Metilmercurio - Scientific Committees». Comisión Europea - European Commission. Consultado el 1 de septiembre de 2022.
- Morel FMM, Kraepiel AML, Amyot M. 1998. The chemical cycle and bioaccumulation of mercury. Annual Review of Ecology and Systematics. 29: 543-566.
- Myers G, Davidson P W, Cox C, Shamlaye CF, Cernichiari E, Clarkson TW. 2000. Twenty-Seven Years Studying the Human Neurotoxicity of Methylmercury Exposure. Environmental Research 83 (3): 275-285.
- Steuerwald U, Weihe P, Jørgensen PJ, Bjerve K, Brock J, Heinzow B, Budtz-Jørgensen E, Grandjean P. 2000. Maternal seafood diet, methylmercury exposure, and neonatal neurologic function. Journal of Pediatrics 136 (5): 599-605.
- Govindaswamy N, Moy J. Millar M, Koch SA. 1992. A distorted mercury [Hg(SR)4]2- complex with alkanethiolate ligands: the fictile coordination sphere of monomeric [Hg(SR)x] complexes. Inorganic Chemistry 31 (26): 5343–5344.
- Erni I, y Geier G. 1979. Kinetics of Extremely Fast Ligand Exchange Reactions with Methylmercury(II)-complexes of 1-Methylpyridine-2-thione and 1-Methyl-quinaldine-4-thione: Rate-Equilibria Correlations. Helvetica Chimica Acta 62 (4): 1007-1015.
- van Velze D. Langenkamp H y Herb G. 2002. Review: Mercury in waste incineration. Waste Management and Research 20 (6): 556-568.
- Pyle DM y Mather TA. 2003. The importance of volcanic emissions for the global atmospheric mercury cycle. Atmospheric Environment 37 (36): 5115-5124.
- Magalhães MC, Costa V, Menezes GM, Pinho MR, Santos RS y Monteiro LR. 2007. Intra- and inter-specific variability in total and methylmercury bioaccumulation by eight marine fish species from the Azores. Marine Pollution Bulletin 54 (10): 1654-1662.
- Chou CL. 2007. A time series of mercury accumulation and improvement of dietary feed in net caged Atlantic salmon (Salmo salar). Marine Pollution Bulletin 54 (6): 720-725.
- Tollefson L. y Cordle F. 1986. Methylmercury in Fish: A Review of Residue Levels, Fish Consumption and Regulatory Action in the United States. Environmental Health Perspectives 68: 203-208.
- Choi MH y Cech JJ. 1998. Unexpectedly High Mercury Level In Pelleted Commercial Fish Feed. Environmental Toxicology and Chemistry 17 (10): 1979–1981.
- Storelli MM, Stuffler RG y Marcotrigiano GO. 2002. Total and methylmercury residues in tuna-fish from the Mediterranean sea. Food Additives and Contaminants: Part A 19 (8): 715-720.
- Abreu SN, Pereira E, Vale C y Duarte AC. 2000. Accumulation of Mercury in Sea Bass from a Contaminated Lagoon (Ria de Aveiro, Portugal). Marine Pollution Bulletin 40 (4): 293-297.
- Branco V, Vale C, Canário J y Santos MN. 2007. Mercury and selenium in blue shark (Prionace glauca, L. 1758) and swordfish (Xiphias gladius, L. 1758) from two areas of the Atlantic Ocean. Environmental Pollution 115 (3): 373-380.
- Wagemann R, Trebacz E, Boila G y Lockhart WL.1998.Methylmercury and total mercury in tissues of arctic marine mammals. The Science of The Total Environmental 218 (1): 19-31.
- Gochfeld M. 2003. Cases of mercury exposure, bioavailability, and absorption. Ecotoxicology and Environmental Safety 56 (1): 174–179.
- Tchounwou PB, Ayensu WK, Ninashvili N y Sutton D. 2003. Review: Environmental exposure to mercury and its toxicopathologic implications for public health. Environmental Toxicology 18 (3): 149-175.
- Rooney, J.P.K. (2014). «The retention time of inorganic mercury in the brain — A systematic review of the evidence». Toxicology and Applied Pharmacology 274 (3): 425-435. doi:10.1016/j.taap.2013.12.011.
- Brubaker PE, Lucier GW, Klein R. 1971. The effects of methylmercury on protein synthesis in rat liver. Biochemical and Biophysical Research Communications. 44 (6): 1552-1558.
- Davidson PW, Myers GJ, Weiss B. Shamlaye CF y Cox C. 2006. Prenatal methyl mercury exposure from fish consumption and child development: A review of evidence and perspectives from the Seychelles Child Development Study. Neurotoxicology, 27 (6): 1106-1109<
- Meyers GJ, Davidson PW, Shamlaye CF. 1998. A Review of Methylmercury on Child Development. Neurotoxicology 19: 313-328
- Choi AL, Weihe P, Budtz-Jørgensen E, Jørgensen PJ, Salonen JT, Tuomainen TP, Murata K, Nielsen HP, Petersen MS, Askham J, y Grandjean P. 2009. Methylmercury exposure and adverse cardiovascular effects in Faroese whaling men. Environmental Health Perspectives '117' (3):367-372.
- Komyo E. 200. Minamata disease. Neuropathology 20 (S1): 14-19.
- Harada M. 1995. Minamata Disease: Methylmercury Poisoning in Japan Caused by Environmental Pollution. Critical Reviews in Toxicology 25 (1): 1-24.
- McCurry J. 2006. Japan remembers Minamata. The Lancet 367 (9505): 99-100.
- Cohen JT, Bellinger DC, Connor WE, Kris-Etherton PM, Lawrence RS, Savitz DA, Shaywitz BA, Teutsch SM y Gray GM. 2005. A quantitative risk-benefit analysis of changes in population fish consumption. American Journal of Preventive Medicine 29 (4): 325-334.
- Groth E. 2006. Letters to the editor: Risks and Benefits of Seafood Consumption. American Journal of Preventive Medicine 30 (5): 439-440.
- Jeejeebhoy KN. 2008. Benefits and risks of a fish diet—should we be eating more or less? Nature Reviews Gastroenterology & Hepatology 5 (4): 178-179.
- Stern AH. 2007. Public health guidance on cardiovascular benefits and risks related to fish consumption. Environmental Health 6 (31): 1-4.
Referencias externas
- Evaluación mundial sobre el mercurio. Extracto del informe 2002. Programa de las Naciones Unidas para el Medio Ambiente. Ginebra. Suiza
- ATSDR - ToxFAQs™: Mercury
- ATSDR - Public Health Statement: Mercury
- ATSDR - ALERT! Patterns of Metallic Mercury Exposure, 6/26/97
- ATSDR - MMG: Mercury
- ATSDR - Toxicological Profile: Mercury
- Global Zero Mercury Campaign Project (proyecto de la Oficina Europea del Medio Ambiente de la UE).