Sapajus apella
Sapajus apella es un primate platirrino de Sudamérica. Es la especie de primate no humano más ampliamente distribuida en el Neotrópico.[2]
| Sapajus apella | ||
|---|---|---|
 | ||
| Estado de conservación | ||
 Preocupación menor (UICN)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Mammalia | |
| Orden: | Primates | |
| Suborden: | Haplorrhini | |
| Infraorden: | Simiiformes | |
| Parvorden: | Platyrrhini | |
| Familia: | Cebidae | |
| Género: | Sapajus | |
| Especie: |
S. apella (Linnaeus, 1758). | |
| Distribución | ||
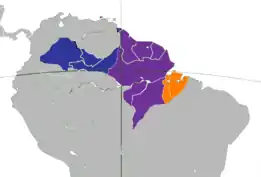 Distribución de las subespecies mono maicero | ||
| Subespecies | ||
S. a. apella Violeta | ||
| Sinonimia | ||
Cebus apella | ||
Nombres comunes
Sapajus apella es conocido distintos nombres, tales como caí o mono caí en Argentina; macaco-prego en Brasil; maicero o mico maicero en Colombia; mono silbador en Ecuador; bondo o kesi-kesi en Surinam; mono negro en Venezuela. [cita requerida]
Descripción
El mono maicero es un animal omnívoro, que se alimenta preferiblemente de frutos e invertebrados, aunque algunas veces atrapa pequeños vertebrados, tales como lagartijas y polluelos de aves; también se alimenta de otras partes de plantas. Este cébido puede encontrarse en diferentes tipos de ambientes, incluyendo la mayoría de los bosques tropicales y subtropicales, y en bosques de crecimiento secundario.
Está ampliamente distribuido en Sudamérica. Se caracteriza por presentar en el cuerpo un pelaje que varía de castaño claro a castaño oscuro o marrón a rojizo; en las extremidades y cola presenta una coloración que varía de marrón oscuro a negro, siendo estas últimas las partes más oscuras del cuerpo. En la frente presenta pelaje erecto semejando unos cachos de allí su nombre, el rostro puede presentar pelaje corto que se esparce sobre la piel negra. Es una especie relativamente grande, la longitud entre cabeza cuerpo está entre 35 y 49 cm, y posee una cola prensil de entre 38 y 49 cm, los machos pesan alrededor de 3,7 kg y las hembras 2,3 kg. Al igual que otros cebides habita en la selva húmeda tropical, se desplaza en árboles de gran altura y se caracterizan por presentar hábitos diurnos, ser activos e inquietos.
Su dieta está constituida principalmente por frutas, semillas, néctar, insectos, crustáceos, reptiles, ranas, huevos de las aves y pequeños mamíferos por lo tanto los maiceros pueden ser considerados como animales omnívoros. Respecto a su desplazamiento, aunque usualmente se apoyan en las cuatro extremidades pueden adoptar una postura bípeda, así mismo utilizan la cola prensil para desplazarse y alimentarse.
Al igual que otras especies de capuchinos (género Sapajus), son animales sociales. Vive en grupos sociales conformados por 6 a 18 individuos, en el cual hay un macho dominante el cual se puede reproducir con varias hembras. El área de dominio vital se ha calculado entre 90 y 158 ha y realizan desplazamiento por zonas descubiertas de vegetación para llegar de un fragmento de bosque a otro. En cuanto a la reproducción esta especie se caracteriza porque generalmente sólo tienen una cría en cada parto, con un período de gestación de 149 a 158 días y de lactancia de 270 días; el ciclo estral es de 18 días y los juveniles se valen por sí mismos al año y medio.
Taxonomía y filogenia
.jpg.webp)
Esta especie de primate platirrino (monos de Nuevo Mundo) pertenece a la familia Cebidae y al género Sapajus llamados genéricamente monos capuchinos robustos, debido a que la distribución y pelaje de la cabeza recuerda a los monjes. Carlos Linneo describió a los integrantes de este género como Simia capucina en su obra Systema Naturae (1758); posteriormente, Erxleben en 1777 acuñó el nombre pasado del género, Cebus.
Groves en Mammal Species of the World considera 6 subespecies de Sapajus apella:[2]
- Sapajus apella apella
- Sapajus apella fatuellus
- Sapajus apella macrocephalus
- Sapajus apella margaritae
- Sapajus apella peruanus
- Sapajus apella tocantinus
Silva en cambio estableció que Sapajus macrocephalus es una especie diferente.[3][4] Según el estudio genético de Ruiz García el linaje C. a. apella de Guayana francesa, Surinam, Guyana, nordeste de Venezuela en la cuenca norte del Amazonas y el interfluvio entre los ríos Tapajós y Xingú, se relaciona más cercanamente con C. a. fatuellus del oriente y centro de Colombia, sur de Venezuela y noroeste de Brasil; mientras que el linaje único y separado macrocephalus incluye a las anteriormente descritas subespecies C. a. macrocephalus, C. a. peruanus, C. a. maranonis y C. a. Pallidus y está ampliamente distribuido en la cuenca alta del oeste de la Amazonia, en el Perú, oriente del Ecuador, sureste de Colombia y norte de Bolivia.[5] Considerando entonces que S. macrocephalus es una especie diferente, se tendrían las iguientes subespecies de S. apella:
- Sapajus apella apella
- Sapajus apella fatuellus
- Sapajus apella margaritae
- Sapajus apella tocantinus
Los individuos (especialmente las hembras adultas y los machos subadultos) presentan un copete característico por lo que también se les conoce como maicero cornudo, cachón o cachudo.[6]
Descripción
Su longitud cabeza cuerpo varía entre 35 y 49 cm, y posee una cola prensil que tiene entre 38 y 49 cm y alcanza un peso alrededor de los 2 a 5 kg. Los machos son más grandes (3,7 kg en promedio) que las hembras (2,3 kg en promedio). El pelaje del cuerpo generalmente varia de color castaño claro hasta castaño oscuro o marrón rojizo; las piernas, brazos y cola van desde color marrón oscuro a negro pero siempre son más oscuros que el resto del cuerpo. A cada lado de la frente, presentan en la mayoría de los casos pelaje erecto a manera de «cachos». El rostro está cubierto por pelaje corto (a veces ausente) esparcido sobre la piel negra.[6]
Distribución geográfica y hábitat

En Colombia, Sapajus apella se encuentra en casi toda la Amazonía y en las tierras bajas del piedemonte amazónico de la cordillera oriental, donde alcanzan una altura de por lo menos 1300 m s. n. m. No se encuentran en algunas áreas bien definidas en el oriente del Vichada en el alto Cahuinarí (Amazonas), el trapecio amazónico colombiano y en el norte de Arauca, donde es desplazado ecológicamente por Cebus albifrons. Penetra en el alto valle del alto río Magdalena en el departamento del Huila, hasta una altura de 2700 m s. n. m. (en la región de San Agustín) y en la región de Tierraadentro en el departamento del Cauca, a alturas de hasta 2500 m s. n. m., cerca a Inzá.[7] Cebus apella tiene la distribución geográfica más amplia de cualquier especie de primate neotropical. Aunque en Colombia penetra al occidente de la cordillera Oriental en el alto valle del río Magdalena, la mayor parte de su distribución se encuentra al oriente de la misma y en general al oriente de los Andes al sur del río Arauca y Meta, por la Amazonia venezolana; en Guyana, Surinam, Guayana francesa; en el norte de Brasil y el centro y este de la Amazonia brasileña; y en el oriente del Ecuador y el Perú y en el noreste de Argentina, en la provincia de Misiones.[4][5]
Hábitat preferido
Se encuentra en gran diversidad de ecosistemas, desde bosque caducifolio de galería en los Llanos Orientales hasta bosque húmedo permanente (perenne), así como también en aquellos de crecimiento secundario. En algunas áreas de Colombia pueden ser considerados como plaga para la agricultura, pues se alimentan principalmente de cultivos de maíz (de ahí el nombre de «maicero»), caña de azúcar, cacao y árboles frutales, Sapajus apella es un generalista en términos de uso de hábitat, sin embargo a diferencia de Cebus albifrons, generalmente no se desplaza ni busca alimento en el bosque inundado, constituyendo esto una marcada diferencia entre estas dos especies de Cebidae.[8] S. apella prefiere ambientes más secos en bosques semi decicuos de los Llanos Orientales, mientras que C. albifrons utiliza más frecuentemente los bosques de palma espinosas, Bactris, las cuales crecen sobre los lechos secos y arenosos de los ríos. Adicionalmente en la Amazonia colombiana Cebus albifrons es más comúnmente encontrado en bosques que rodean colinas rocosas y en bosques que crecen sobre arenas blancas, mientras que Sapajus apella elige bosques más diversos y fértiles. Este último puede encontrarse también en bosques aislados, bosques de neblina y en manglares. Pueden también cruzar áreas de vegetación muy abierta, con el propósito de desplazarse de un segmento de bosque a otro. Durante sus actividades, S. apella utiliza con mayor frecuencia los estratos medio y bajo del bosque.[9] Los hábitat preferidos de S. apella son los bosques secundarios altos y en etapas sucesionales, en donde suele usar los estratos medios del dosel y el sotobosque. Es generalista en términos de uso de hábitats, opta por ambientes secos, diversos, y fértiles y normalmente utiliza árboles con copas pequeñas.[10]
.jpg.webp)
Tamaño de grupos
El promedio en los Llanos Orientales es de 8 a 9 individuos/grupo, compuestos generalmente por un macho adulto, varias hembras y juveniles.[11] En el parque nacional natural Tinigua, en el centro de investigaciones primatologicas La Macarena, los grupos están conformados hasta por 23 individuos, siendo 16 el tamaño promedio. Estos grupos están compuestos por machos de diferentes edades, varias hembras e individuos juveniles.[12][13][14] [15] En 1985 Janson encontró grupos de cerca de 10 individuos en el Parque Nacional Manu en el Perú.[16] Sobre el río Meta el tamaño del grupo fue de 6 a 12 individuos[17][18][19] Soini[19] en el parque nacional Pacaya Samiria al norte del Perú, registro de 6 a 11 individuos y una media de 8,7 animales por grupo.[6]
Área de dominio vital (ADV) y recorrido diario
Varía de acuerdo a la calidad del hábitat. Se han registrado ADV de 90 ha en el parque nacional natural El Tuparro.[11] 158 ha en el parque nacional natural Tinigua en Colombia[15] y para el parque nacional Manu en el Perú se cuenta con dos informes: 125 ha y 80 ha[14][20] Un grupo observado al norte de Manaus (Brasil) en el bosque sobre arenas blancas utilizaba un ADV de alrededor de 900 ha (Pedzonni, comunicación personal). Respecto a los recorridos diarios, Terborgh[20] calculó un promedio de 2070 m en el Parque Nacional Manu (Perú), mientras que en el parque nacional natural Tinigua es estimado un promedio de 1667 m (rango 370 a 2300 m).[15]
Densidad de la población
Se calculó en 16 individuos/km² para el parque nacional natural Tinigua,[15] mientras que en el Parque Nacional Manu fue de 40 individuos/km². En el parque nacional natural El Tuparro es de 16-17 individuos/km².[21] En la estación Biológica Caparú, al oriente de Colombia, las densidades llegan a 8 individuos por cada km² y en el río Puré a 5,8 individuos por cada km².[6]
Patrón de actividad
Terborgh[20] estimó la utilización del tiempo en el Parque Nacional Manu en Perú, así: 12% descanso, 21% desplazamiento, 66% forrajeo, del cual el 16% es sobre material vegetal y 50% sobre insectos.[20] En el parque nacional natural Tinigua,[15] registraron 7% de descanso, 27% de desplazamiento, 62% de alimentación y 4% de otras actividades.[6]
Locomoción y postura

Utiliza una amplia variedad de patrones de locomoción, sin embargo, su forma de desplazamiento más común es cuadrúpeda. Emplean también con frecuencia el galopear, correr, saltar y escalar. Por otra parte, es muy común que desciendan al suelo del bosque con el objeto de buscar invertebrados y lagartijas, y para beber agua de ríos y quebradas cuando esta no se encuentra disponible en los árboles, su fuerte cola prensil les permite adoptar posiciones seguras de alimentación similares a las utilizadas por los Atelinae y otras especies de Sapajus y de Cebus.[6]
Dormideros
Zhang[22] encontró que la mayoría de los dormideros en la Guyana Francesa eran sobre las hojas de la palma Oenocarpus bataua que se concentraba en un área particular de su dominio vital. Los maiceros también utilizan frecuentemente estas mismas palmas como dormideros en el oriente colombiano.[23][6]
Comportamiento
Dieta
Puede ser considerado omnívoro. Una porción extremadamente importante de su dieta la conforman los invertebrados, siendo estos representados por Lepidópteros, Himenópteros (especialmente hormigas) y ortópteros, cuyo conjunto representa en conjunto un 50% de su tiempo de alimentación.[20] También consumen huevos de aves y pueden capturar vertebrados tales como ranas, lagartijas, aves y pequeños mamíferos.[24][12][13][20][25]
Comportamiento social
Janson investigó las interacciones sociales de agresión en la especie,[16] encontrando diferencias en la tasa de alimentación de acuerdo al estatus social dentro del grupo. Los animales dominantes tenían una dieta con un 20% o más de energía total que la de los subordinados, y así mismo, los animales que recibían poca agresión tenían una dieta energéticamente alta. Por otra parte, un macho del grupo que emigro, tenía el nivel más bajo de consumo energético y los niveles de competencia dentro del grupo eran diez veces mayores que el nivel de competencia intergrupal. Los machos adultos pasan mayor cantidad de tiempo en la periferia del grupo, comen menos y vigilan más que las hembras, detectando a los predadores potenciales más frecuentemente que las hembras. El alto riesgo de predación puede ser una presión importante que desarrolla la capacidad de los machos dominantes para vivir por más largo tiempo.[26] Janson[11][14] plantea la posibilidad de que el sistema de apareamiento de Cebus albifrons y Sapajus apella puede haber determinado el sistema social que posee cada especie y encontró diferencias en el tamaño del parche de alimentación utilizados en las dos especies. Sapajus apella se alimenta en árboles mucho más pequeños que los utilizados por C. albifrons, asegurando así que los miembros de su grupo social permanezcan en promedio, mucho más cerca uno del otro que los miembros de un grupo de Cebus albifrons. De esta forma el macho dominante de Sapajus apella puede ofrecer beneficios a la hembra y sus crías, en respuesta a que muy probablemente ella se aparee con él y no con otro macho. Igualmente el macho dominante exhibe una mayor tolerancia hacia las hembras y sus crías en los árboles con espacios reducidos.[6] Por su parte, el macho dominante enfrenta a los predadores manteniéndose visible y avisando con un alarido particular, mientras los demás se esconden. Para ahuyentar la otra manada de una cosecha, él lidera el ataque, seguido de las hembras, y los machos subdominantes no participan.[27] Las hembras son filopátricas, con algunas excepciones en las que se ha notificado que abandonan el grupo y forman uno nuevo. Los machos suelen alejarse de su grupo natal para formar un grupo por su cuenta. Sin embargo, existe un conjunto de individuos que permanecen en el grupo por periodos relativamente largos.[10] Las hembras desarrollan afiliaciones unas con otras, se acicalan, interactúan entre ellas y se sientan juntas; por el contrario, los machos, interactúan agonística y afiliativamente tanto entre ellos como con las hembras. Las afiliaciones que se crean entre hembras al parecer son de tipo matrineal por parentesco.[10]
Comportamiento reproductivo
Las hembras presentan un periodo estral de 18 días.[28] y la gestación se ha calculado en 160 días.[29] Para copular el macho monta la hembra apoyándose directamente sobre el sustrato de la rama en que se encuentren o sosteniéndose con sus pies de las patas traseras de la hembra. En muchos grupos se presenta únicamente un macho reproductor, mientras que son las hembras fértiles.[30] encontraron que en los grupos más grandes esta situación puede cambiar y pueden presentarse otros machos en edad reproductiva, pero generalmente, el macho dominante hace prevalecer su derecho a copular, impidiendo a los otros acceder a las hembras. Igualmente las hembras muestran preferencia por el macho dominante.[11] Soini[19] observó nacimientos durante todos los meses excepto durante la estación seca (octubre a junio, en el Parque Nacional Pacaya Samiria) e Iwaza[25] para el río Duda, informaron nacimientos durante la época seca, la cual es más pronunciada en aquel sitio que en el lugar de estudio de Soini (en el Perú).[6]
Vocalización y despliegue
Freese y Oppenheimer[31][6] describen 17 vocalizaciones de Sapajus apella:
1) fu, fuerte y prolongado y consistente de 1-3 repeticiones, utilizado por todos los individuos para localizar el grupo
2) mik: emitido 2 o 3 veces por infantes y jóvenes cuando están asustados, para atraer la atención de la madre;
3) quejido, utilizado por todos los individuos para mantener contacto con el grupo;
4) pio vocalización corta y repetida, comúnmente utilizada por infantes para mantener contacto con la madre;
5) gruñido, vocalización pulsada de bajo tono, usualmente acompañada por una sacudida de cabeza, emitida por la hembra para apaciguar al infante;
6) como flauta, vocalización poco común, emitidas por los machos adultos cuando se acercan a una hembra en estro;
7) igk, trino común emitido por los machos adultos cuando se acercan a una hembra en estro;
8) kecker, vocalización común consistente en pulsos de amplia frecuencia, emitida por todos los individuos para demostrar miedo intenso o mientras persiguen o amenazan;
9) grito, vocalización común de amplia frecuencia emitida por todos los individuos para indicar miedo extremo;
10) moler dientes, poco común consiste en frotar los molares, y es utilizado por machos adultos como señal de amenaza;
11) iku, vocalización menos común de frecuencia baja, emitida por adultos en señal de alarma;
12) ika, vocalización común consistente en una larga seria de gritos entrecortados.
Amenazas
Parásitos
Los primates neotropicales comparten diversas enfermedades parasitarias, entre las que se encuentran:[32]
- Toxoplasmosis: transmitida por el parásito Toxoplasma gondii
- Malaria: transmitida por Plasmodium brazilianum
- Sarcocistosis: transmitida por Sarcocystis spp.
- Estrongilodiasis: transmitida por Strongyloides cebus.
Ectoparásitos
Las enfermedades causadas por parásitos externos en los primates neotropicales están poco documentadas. Se han descrito miasis causadas por larvas de moscas de la familia Cuterebridae como Cuterebra y Dermatobia, y Alouattamyia con procesos quísticos locales e infecciones secundarias.
Recientemente un sarcoptiforme, el Fonsecalges saimirii originalmente documentado como ectoparásito de mono ardilla, se ha visto en Sapajus apella.[32]
Predadores
Los monos maiceros se ven afectados por serpientes tales como Boa constrictor, felinos como Leopardus spp, y aves rapaces como Harpia harpyja.
Interacción con humanos
Los monos maiceros son mantenidos erróneamente como "mascotas", pero la mayor parte de ellos son empleados en investigación biomédica.[32]
Estado de conservación
Se encuentra en el apéndice II del CITES (siglas del inglés Convention International for the Traffic of Endangered Flora and Fauna Species), aunque se considera abundante en vida silvestre. Recientemente la especie fue catalogada LC o preocupación menor en la Lista Roja de la UICN. La decisión se justifica en la amplia zona de distribución y que en la actualidad no existen amenazas significativas que puedan producir una disminución marcada del total de individuos de la especie.[1] Sin embargo 2 de las subespecies están en estado crítico o vulnerable (S.a marginatae y S.a. robustus respectivamente). La subespecie que habita en territorio colombiano, Sapajus apella apella no se encuentra amenazada y se encuentra en la categoría de la UICN en bajo riesgo, así como en el libro rojo de mamíferos de Colombia.[6][32]
Referencias
- Rylands, A.B., Boubli, J.-P., Mittermeier, R.A., Wallace, R.B. & Ceballos-Mago, N. (2008). «Sapajus apella». Lista Roja de especies amenazadas de la UICN 2010.3 (en inglés). ISSN 2307-8235. Consultado el 19 de noviembre de 2010.
- Wilson, Don E.; Reeder, DeeAnn M., eds. (2005). Mammal Species of the World (en inglés) (3ª edición). Baltimore: Johns Hopkins University Press, 2 vols. (2142 pp.). ISBN 978-0-8018-8221-0.
- Silva, J. de S., Jr (2001) "Especiaça˜o nos macacos-prego e cairaras, gênero Cebus Erxleben, 1777 (Primates, Cebidae)2. PhD Thesis, Universidade Federal do Rio de Janeiro, Rio de Janeiro, Brazil.
- Silva, J. de S., Jr (2002) "Taxonomy of capuchin monkeys, Cebus Erxleben, 1777"; Neotropical Primates 10: 29.
- Ruiz-García, Manuel; Maria Ignacia Castillo; Nicolás Lichilín-Ortiz; Myreya Pinedo-Castro (2012) "Molecular Relationships and Classification of Several Tufted Capuchin Lineages (Cebus apella , Cebus xanthosternos and Cebus nigritus , Cebidae), by Means of Mitochondrial Cytochrome Oxidase II Gene Sequence"; Folia Primatologica 83 (2): 100-125.
- Defler, Thomas (2003). Primates de Colombia. Conservación Internacional Colombia,Panamericana Formas e Impresos.543pp.
- J. Hernández Camacho, y R. W. Cooper (1976): «The nonhuman primates of Colombia» (págs. 35-69). En: R. Thorington, y P. G. Heltner (eds.): Neotropical primates and conservation. Washington: National Academy of Sciences, 1976.
- T. R. Defler (1985 a): «Contiguous distribution of two species of cebus monkeys in the Tuparro National Park (Colombia)». En: American Journal Primatology, 8: págs. 101-112; 1985.
- Fleagle, R.A. Mittermeier & A.L. Skopec 1981. Differencital habitat use by Cebus apella and Saimiri sciureus in Central Suriman. Primates 22:361-367
- Sussman, R (2000). Primate ecology and social structure. First Edition. Pearson Custom Publishing. 204pp.
- Defler, Thomas (1982). A comparison of intergroup behavior in Cebus apella and Cebus albifrons. Primates 23: 385-392.
- K. Iwaza (1980): «Social behavior of the wild black–capped capuchin (Cebus apella)». En: Primates, 21: págs. 443-467; 1980.
- Iwaza, K (1988b). preliminary report on social changes of black–capped capuchin (Cebus apella). Field Studies of New World Monkeys. La Macarena Colombia 1: 13-18.
- C. H. Janson (1986): The mating system as a determinant of social evolution in capuchin monkeys (Cebus apella)». En: J. Else & P. Lee (eds.): Proceedings of the XIIth International Congress of Primatology. Cambrigde: Cambrigde University Press, 1986.
- D. P. Stevenson, M. J. Quiñónez F., y J. A. Ahumada P. (1992): «Relación entre la abundancia de frutos y las estrategias alimenticias de cuatro especies de primates en La Macarena (Colombia)». Informe al Banco de la República (manuscrito inédito), 1992.
- Janson, C.H (1985). echological al social consequences of food competition in Brown capuchin monkey. Unpublished Ph.D. thesis, University of Washington, Seattle.
- L. L. Klein, y D. J. Klein (1973a): «Observations on two taxa of neotropical primate intertaxa associations». En American Journal of Physical Anthropology, 38: págs. 649-654; 1973.
- L. L. Klein, y D. J. Klein (1976): «Neotropical primates: aspects of habitat usage, population density, and regional distribution in La Macarena, Colombia» (págs. 70-78). En: R. Throrington Jr., y P. G. Heltne: Neotropical primates: field studies and conservation. Washington: National Academy of Sciences, 1976.
- Soini, P (1986a). A synecological study of a primate community in the Pacaya–Samiria National Reserve, Perú. Primate Conservation 7:63-71.
- Terborgh, J (1983). Five new world primates: a study in comparative ecology. Princeton: Princeton University Press.
- T. R. Defler, y D. Pintor (1985): «Censusing primates by transect in a forest of known primate density». En: International Journal of Primatology, 6 (3): págs. 243-259; 1985.
- S. Y. Zhang (1995): «Activity and runging patterns in relation to fruit utilization by brown capuchins (Cebus apella) in French Guiana». En: International Journal of Primatology 16 (3): págs. 489-507; 1995.
- Defler: observaciones personales.
- M. Galetti (1990): «Predation on the squirrel sciurus a estuans by capuchin monkeys, Cebus apella». En: Mammalia 54 (1): págs. 152-154; 1990.
- K. Iwaza: «Social changes within a group of wild black–capped capuchin (Cebus apella)». En: Studies of New World Monkeys. La Macarena (Colombia), 3: págs. 1-6, año=1990
- C. P Van Schaik, y M. A. Van Noorwijk (1989): «The special role of male cebus monkeys in predation avoidance and its effect on groop composition». En Behavioral and Ecology and Sociobiology, 24: págs. 265-276; 1989.
- Bennett, S. 2003. Los micos de Colombia. Instituto de investigación de recursos Biologicos Alexander Von Humboldt y Fundación Tropenbos. Bogotá, Colombia. 260 p
- E. M. Wright, J. R. Bush, y D. E. Bush: «The reproductive cycle of capuchin (Cebus apella)». En Laboratory Animal Science. 27: págs. 651-654.
- P. Harvey, R. D. Martin, y T. H. Clutton: «Life histories in comparative aspect». En Brock, 1987. Págs 181-196.
- K. C. Phillips, I. S. Bernstein, E. L. Dettmer, H. Devermann, y R. M. Power: «Sexual behavior in brown capuchin monkey (Cebus apella)». En International Journal of Primatology, 15 (6): págs. 907-917; 1994.
- C. H. Freese, y J. R. Oppenheimer: The capuchin monkey, genus cebus, págs. 331-391; 1981.
- Varela, N. (2003). Biología, manejo y medicina del mono maicero. Grupo de Estudio de Animales Silvestres. Bogotá (Colombia), pág. 29.
Enlaces externos
 Wikispecies tiene un artículo sobre Sapajus apella.
Wikispecies tiene un artículo sobre Sapajus apella. Wikimedia Commons alberga una galería multimedia sobre Sapajus apella.
Wikimedia Commons alberga una galería multimedia sobre Sapajus apella.