Organismo genéticamente modificado
Un organismo genéticamente modificado u organismo modificado genéticamente (abreviado como OGM, OMG o GMO, por sus siglas en inglés), también llamado como transgénico erróneamente (pues a que un transgénico es una transferencia de uno o más genes de una especie a otra especie), es un organismo cuyo material genético ha sido alterado usando técnicas de ingeniería genética.[1][2] La definición estadounidense incluye igualmente las modificaciones realizadas mediante la selección artificial.[3][4] La ingeniería genética permite modificar organismos mediante la transgénesis o la cisgénesis, es decir, la inserción de uno o varios genes en el genoma. Los OGM incluyen microorganismos como bacterias o levaduras, plantas, insectos, peces y otros animales. Estos organismos son la fuente de los alimentos genéticamente modificados, y son ampliamente utilizados en investigaciones científicas para producir otros bienes distintos a los alimentos. El término OGM está muy asociado al término técnico legal, «organismo viviente modificado», definido en el Protocolo de Cartagena en Bioseguridad, que regula internacionalmente el comercio de los OGM vivientes (especialmente, "cualquier organismo viviente que posee una combinación de material genético obtenida mediante el uso de biotecnologías modernas").

Técnicas
Las posibles modificaciones genéticas que se pueden usar incluyen la mutación, inserción y deleción de genes. Cuando se inserta material genético este suele provenir de otra especie, de forma parecida a la transferencia horizontal que se produce en la naturaleza. Para producir de forma artificial esta transferencia suele ser necesario recurrir a diferentes técnicas. Los genes pueden ser incorporados a un virus o pueden ser físicamente inyectados en el núcleo de la célula con una aguja ultrafina o con un cañón de genes. Otras técnicas aprovechan la habilidad de ciertos organismos como los lentivirus o algunas bacterias como la Agrobacterium tumefaciens para transferir material genético a animales y plantas.[5][6]
La aplicación de la transgénesis permite transferir genes heredables entre especies más o menos separadas entre sí (por ejemplo, un gen presente en las luciérnagas puede ser transferido a un toro),[7] pero también las transferencias de genes pueden darse entre especies más próximas cuando las técnicas de entrecruzamiento clásicas fracasan (tal es el caso de la patata Fortuna, una variedad de patata genéticamente modificada, mezcla de la variedad Agria y la patata originaria de Sudamérica Solanum bulbocastanum). El aspecto innovador de estas nuevas técnicas recae en sus potenciales aplicaciones, beneficios económicos inmediatos, principalmente para los sectores médicos y de los alimentos. Los OGM han provocado controversias, y también una reflexión ética[8] además de una disputa comercial concerniente a la comercialización de organismos genéticamente modificados en la Unión Europea,[9] y su reglamentación en Europa.[10] Dentro de las biotecnologías, los OGM pertenecen a un área de investigaciones realizadas pasados los años 1990s al objeto de numerosas inversiones en investigación y desarrollo a partir de financiamiento tanto público como privado.
Al hacer la manipulación en el material genético, este puede hacerse heredable o no, en función del proceso usado y los genes implicados.
Historia
Aunque el ser humano ha estado modificando de manera indirecta la carga genética de plantas y animales desde hace al menos 10 000 años, no fue sino hasta 1973 cuando Herbert Boyer y Stanley Cohen consiguieron transferir ADN de un organismo a otro (una bacteria). El mismo año, Rudolf Jaenísch creó un ratón transgénico, que se convirtió en el primer animal transgénico de la historia.[11] Sin embargo, la modificación no se transmitió a sus descendientes. En 1981, Frank Ruddle, Frank Constantini y Elizabeth Lacy inyectaron ADN purificado en un embrión unicelular de ratón y demostraron que se producía la transmisión del material genético a las generaciones siguientes.[12][13]
En 1983 se creó la primera planta transgénica de tabaco.[14] Fue desarrollada por Michael W. Bevan, Richard B. Flavell y Mary-Dell Chilton mediante la creación de un gen quimérico que combinaba un gen de resistencia a un antibiótico con el plásmido T1 de la bacteria Agrobacterium. El tabaco fue infectado por la bacteria modificada con este plásmido, teniendo como resultado la inserción del gen quimérico en la planta. Mediante técnicas de cultivo de tejidos, se seleccionó una célula de tabaco conteniendo el gen y, a partir de esta, se desarrolló en una nueva planta.[15]
Las semillas y plantas transgénicas se empezaron a producir y comercializar en la segunda mitad del siglo XX. Su uso y comercialización se ha extendido a varios países y regiones, por su mayor productividad y resistencia a plagas.[16] Sin embargo, existe un movimiento contrario a su aceptación alegando que podrían no ser seguras o convenientes para la salud y para la alimentación de los seres humanos, a pesar de no existir evidencia científica alguna que respalde dicha postura. La legislación sobre la producción y venta de alimentos derivados de OGM varía enormemente de un país a otro, variando desde la legalización de su producción tras presentar estudios sobre su seguridad a regiones que se declaran libres de transgénicos.
Siendo inexistentes en 1993, en 2011 las superficies cultivadas con OMG ya representaban 160 millones de hectáreas según ISAAA (por sus siglas en inglés International Service for the Acquisition of Agri-biotech Applications —Servicio Internacional para la Adquisición de Aplicaciones Agro-biotecnológicas—, una organización no-gubernamental de promoción de biotecnologías,[17] casi el 50 % en los países en desarrollo.[17] Esto representa el 3 % de las tierras agrícolas a escala mundial, aunque en ciertos países como los Estados Unidos representan el 17 % de la superficie agrícola y el 47 % de las tierras arables.[17][18] Según el mismo organismo, el mercado de productos de cultivos comerciales transgénicos como maíz, soja y algodón mueve al año 160 billones de dólares (datos de 2011), y se venden 13,2 billones de semillas modificadas genéticamente.[17] Las organizaciones ecologistas estiman que las cifras concernientes a las superficies de cultivos están sobrevaluadas.[19]
En mayo de 2010, la revista Science publicó la realización del primer organismo con genoma integral sintetizado por científicos, aunque no se trata de una «creación», ya que en sí es una fabricación artificial a partir de un genoma preexistente.[20][21]
Usos de los OGM
Investigación
Uno de los primeros usos de los organismos genéticamente modificados fue la investigación. Mediante la inserción, deleción y trasposición de genes en diversos organismos es posible determinar la función de determinados genes. Una manera es mediante la técnica de knock out, en la que un gen o grupo de genes son desactivados para observar las características que cambian en el fenotipo. También se pueden usar promotores para sobreestimular la actividad de determinados genes.
Mediante la modificación genética es posible obtener animales que padezcan enfermedades análogas a las humanas, sirviendo de modelos para la investigación de dichas enfermedades y las pruebas preclínicas de medicamentos y terapias para combatirlas. Ralph L. Brinster y Richard Palmiter desarrollaron estas técnicas, responsables de la creación de ratones, ratas, conejos, ovejas, y cerdos transgénicos en la década de 1980, y establecieron muchos de los primeros modelos de enfermedades humanas, incluyendo el primer carcinoma causado por un oncogen.
El proceso de ingeniería genética en mamíferos es lento, tedioso y caro. Sin embargo, nuevas técnicas están haciendo que las modificaciones genéticas sean más fáciles y precisas en algunos casos determinados.[22]
Fabricación de productos terapéuticos
Los organismos modificados son usados también para fabricar productos destinados para uso terapéutico en humanos (productos farmacéuticos o tejidos para su implantación en xenotrasplantes).[23]
En el pasado, las formas humanas de proteínas como insulina, hormona del crecimiento y factor de coagulación, que sirven para tratar graves enfermedades y alteraciones en las personas, eran muy raras y costosas. Hoy en día, bacterias y levaduras transgénicas, modificadas con genes para proteínas humanas, producen estos compuestos de una manera muy económica y en gran abundancia. Las personas que tienen diabetes insulino-dependiente son tratadas con insulina humana pura producida por genes humanos introducidos en bacterias.[24]
El anticoagulante ATryn, usado para reducir el riesgo de coágulo durante operaciones quirúrgicas, se extrae de la leche de cabra modificada genéticamente.[25]
Asimismo, la vacuna contra la hepatitis B se produce con levaduras a la que se les ha insertado un gen para producir el antígeno HBsAg presente en la envoltura del virus de la hepatitis B.[26]
Terapia génica
La terapia génica usa virus genéticamente modificados para introducir genes en el ADN humano con el fin de curar algunas enfermedades. Aunque la terapia génica es relativamente nueva, ya ha tenido varios éxitos relevantes. Ha sido usada con éxito para tratar desórdenes genéticos como la inmunodeficiencia combinada grave[27] o la amaurosis congénita de Leber.[28] Además, se encuentran en fase de investigación tratamientos contra otras enfermedades actualmente incurables, como la fibrosis quística,[29] la anemia de células falciformes,[30] la enfermedad de Parkinson,[31][32] la diabetes[33] o la distrofia muscular,[34] entre otras.
Actualmente la terapia génica se centra solo en las células somáticas del cuerpo, por lo que los cambios introducidos en el código genético no pueden ser transmitidos a la descendencia. La terapia génica que tiene como objetivo las células reproductivas se denomina terapia génica de líneas germinales. Su desarrollo, que podría conducir al tratamiento y prevención de enfermedades genéticas transmisibles y defectos de nacimiento,[35] es muy controvertida y se encuentra dificultada por diversas polémicas éticas, religiosas y ecológicas, y está explícitamente prohibida en algunas jurisdicciones.[36]
Animales de compañía
La modificación genética permite la cría de animales hipoalergénicos, de forma que no produzcan reacciones adversas a las personas alérgicas. Actualmente se comercializan gatos modificados para no producir la glicoproteína Fel d1 y perros sin glicoproteína Can d1, responsables de la mayor parte de las respuestas alérgicas. También se comercializan peces cebra fluorescentes.
Producción industrial
La modificación de otros genes permite la obtención de plantas que sintetizan materiales con determinadas características interesantes para su uso industrial. La patata amflora produce un almidón modificado, rico en amilopectina, que se utiliza en la fabricación de papel, tejidos y adhesivos.
Resistencia a plagas y herbicidas
Es una de las aplicaciones comerciales más conocidas. Algunas plantas transgénicas incluyen genes que les confieren resistencia a determinados herbicidas, como el glifosato, utilizado para combatir plagas de otras plantas en los cultivos. Los principales ejemplos son el maíz RR y la soja RR. Ambos son cultivados y comercializados en varios países del mundo y tienen una importante cuota de mercado y producción. Otros cultivos tienen insertado el gen Bt que les confiere a las hojas de estos cultivos la resistencia a plagas, sin la necesidad de tener que ser rociadas con algún plaguicida.
Durante la década de 1990, una plaga de papaya ringspot virus asoló los cultivos de papaya de Hawái y redujo la producción de esta fruta en un 94 %. La introducción de una variedad transgénica de papaya resistente al virus ha revitalizado la producción.[37] Actualmente, el 77 % de la producción de papaya de las islas es transgénica.[38]
Alimentos mejorados o más eficientes

El primer alimento genéticamente modificado autorizado para consumo humano fue el tomate Flavr Savr, en 1994. Este tomate se estropeaba más lentamente que el convencional, lo que permitía a los agricultores recolectarlos cuando están maduros, en lugar de antes de alcanzar la madurez, como los tomates convencionales. Esto se traduce en una mejora del sabor y las propiedades alimenticias. Sin embargo, resultó ser un fracaso comercial.[39]
En algunos casos se pueden insertar genes para que sinteticen una mayor cantidad de nutrientes o nutrientes nuevos. Un ejemplo es el denominado arroz dorado, que sintetiza moléculas precursoras de la vitamina A y que se propone como complemento en lugares donde la dieta es pobre en esta vitamina.[40]
La empresa AquAdvantage está desarrollando un salmón transgénico que se encuentra en las últimas etapas legales para demostrar su seguridad y autorizar su comercialización. Este salmón es un salmón del Atlántico al que se le ha insertado un gen para producir la hormona del crecimiento de un salmón chinook del Pacífico y un promotor de abadejo. Con estas modificaciones, el salmón crece durante todo el año, y no solo en primavera y verano, y alcanza un tamaño apto para el mercado en 16 o 18 meses, en lugar de los 3 años del salmón convencional.[41]
Control de plagas
En 2010, se crearon en laboratorio mosquitos resistentes a malaria.[42][43][44] La OMS estima que la malaria mató a alrededor de un millón de personas en 2008.[45]
Un mosquito modificado genéticamente contiene un gen letal desarrollado para combatir la dispersión del dengue.[46] El mosquito Aedes aegypti es el principal portador del dengue, Su población en las islas Caimán se redujo en un 80 % mediante el uso de esta variedad GM.[47][48] Entre 50 y 100 millones de personas se contagian de dengue cada año y 40 000 mueren por esta causa.[49]
Se ha desarrollado una variedad de la oruga Pectinophora gossypiella que contiene un marcador fluorescente en su ADN. Esto permite a los investigadores hacer un seguimiento de las orugas que son esterilizadas por radiación y liberadas en cultivos con el fin de reducir la plaga causada por estos insectos.[49][50]
Controversia
En la actualidad, existen fuertes controversias entre promotores y detractores de la producción de organismos genéticamente modificados, en relación con su conveniencia, seguridad e impacto sobre el ambiente y el hombre.
La práctica de modificar genéticamente las especies para uso humano acompaña a la humanidad desde sus orígenes,[51][52] aunque solo recientemente se realiza en laboratorios y no en el campo o zonas de cultivo directamente. Sin embargo, la inocuidad de los transgénicos en el ambiente es objeto de controversia entre los sectores a favor de esta clase de biotecnología y los sectores ambientalistas en contra de la misma. Ambos sectores esgrimen estudios científicos para sustentar sus posturas, y se acusan mutuamente de ocultar —o ignorar— hechos frente al público.[53][54]
Por su parte, la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO, por sus siglas en inglés) indica que, con respecto a los cultivos transgénicos cuya finalidad es la alimentación, no se han observado daños al medio ambiente ni a la salud en ninguna parte del mundo.[55][56] De hecho, la reducción en el uso de pesticidas y herbicidas que conlleva el uso de transgénicos se ha traducido en beneficios medioambientales y para la salud de los trabajadores del campo.[56] En sus conclusiones la FAO determina que:
Hasta ahora, en los países donde se han producido cultivos transgénicos, no ha habido ningún informe verificable de que causen algún peligro importante para la salud o el medio ambiente. Las mariposas monarca no han sido exterminadas. Las plagas no han desarrollado resistencia al Bt. Han aparecido algunas pruebas de malas hierbas tolerantes a los herbicidas, pero estas no han invadido ecosistemas agrícolas o naturales. Por el contrario, se están viendo algunos beneficios sociales y ambientales importantes. Los agricultores están empleando menos plaguicidas y están sustituyendo productos químicos tóxicos con otros menos nocivos. Como consecuencia de ello, los trabajadores agrícolas y los suministros de agua están protegidos de los venenos, y aves e insectos benéficos están volviendo a los campos de los agricultores.[56]
Existe un amplio consenso científico en que los OMG que se encuentran actualmente en el mercado no representan un peligro mayor que los alimentos convencionales,[57][58][59][60][61][62] y hasta la fecha no se ha documentado ningún caso de enfermedad en humanos debido al consumo de OGM.[58][60][63] De hecho, mientras que los nuevos alimentos producidos por técnicas convencionales, la inocuidad de las modificaciones raramente es evaluada. Sin embargo, todos los organismos genéticamente modificados deben someterse a controles exhaustivos para garantizar su inocuidad, tanto para la salud humana como para el ambiente antes de ser comercializados.[64]
No se ha probado que ningún OGM presente riesgo alguno para la salud (por la producción de moléculas no deseadas, o por provocar alergias) o el medio ambiente (por la diseminación no deseada de genes). Varias organizaciones científicas internacionales, y notablemente el Consejo Internacional para la Ciencia afirman que los OMG comercializados no son peligrosos para la salud humana y que los riesgos de diseminación de OGM en el medio ambiente son correctamente controlados. Otras organizaciones no científicas, entre ellas el polémico[65] comité de investigación independiente sobre ingeniería genética de origen francés, o el pseudocientífico[66] Panel de Ciencia Independiente, del Reino Unido,[67] alegan que los estudios realizados por los organismos acreditados son insuficientes o superficiales,[68][69] y que en los cultivos transgénicos se deben tomar las prevenciones pertinentes para evitar la contaminación genética del medio ambiente.[70][71][72][73] Estos preceptos son reflejados ampliamente por el movimiento anti-OGM.[73]
Plaguicidas
Una de las ventajas del uso de cultivos genéticamente modificados es la reducción en el uso de diversos plaguicidas, como insecticidas y herbicidas. El uso de cultivos resistentes al glifosato ha reducido el uso de herbicidas más tóxicos y con mayor permanencia en el medio ambiente como la atracina, metribucina o el alacloro, reduciendo el riesgo de contaminación de acuíferos.[74][75] Algunos estudios aislados indican, sin embargo, que el uso de plantas resistentes al glifosato pueden estar fomentando un mayor uso de este.[76]
El uso de cultivos con el gen Bt reduce la necesidad de pesticidas convencionales.[77][78] Entre 1996 y 2006, el uso de cultivos transgénicos permitió una reducción global en el uso de pesticidas de 286 000 toneladas, una disminución del 15 %[79] y la introducción del algodón Bt en la India ha permitido a pequeños agricultores mayores rendimientos de sus cultivos y menores gastos en pesticidas.[80] Un estudio sobre los efectos de la introducción de algodón Bt en seis provincias de China encontró que permitió la reducción del uso de pesticidas a la mitad, duplicando las poblaciones de mariquitas, crisopas y arañas, extendiéndose los beneficios medioambientales a los campos adyacentes de maíz, soja y cacahuetes.[81][82] Si en la Unión Europea el 50 % de los cultivos fueran transgénicos, se estima que se dejarían de usar 14,5 millones de kilos de pesticidas y se produciría un ahorro de 20,5 millones de litros de diésel, lo que reduciría las emisiones de CO2 a la atmósfera en 73 000 toneladas.[83]
Sin embargo, las especies evolucionan de forma natural para adaptarse a los nuevos ambientes. En noviembre de 2009, científicos de Monsanto encontraron que las lagartas rosadas (una especie de polilla) de algunas partes de Gujarat, India, se habían vuelto resistentes a la primera generación de algodón Bt, que solo expresa un gen, el Cry1AC.[84][85] Esta resistencia se ha encontrado también en España, Australia, China y Estados Unidos.[86]
DuPont-Dow dejó de vender maíz modificado para producir pesticida en Puerto Rico después de que se identificaran individuos de cogollero del maíz en la isla inmune a dicho pesticida.[87]
Para contrarrestar estas adaptaciones se han desarrollado cultivos que expresan más de un gen Bt, que se dirigen a más de un receptor en los insectos, dificultando la aparición de individuos resistentes.
Ventajas
Para los partidarios de la biotecnología existen las siguientes ventajas:
Usos industriales
- Mejoras en el proceso industrial
En cuanto a las aplicaciones en agronomía y mejora vegetal en sentido amplio, poseen tres ventajas esenciales:
- Una gran versatilidad en la ingeniería, puesto que los genes que se incorporan al organismo huésped pueden provenir de cualquier especie, incluyendo bacterias (esto permite el cruzamiento entre especies de reinos diferentes, algo que probablemente jamás —para bien y beneficio o para mal y peligro potencial— podría suceder en forma natural).[88]
- Se puede introducir un solo gen en el organismo sin que esto interfiera con el resto de los genes; de este modo, es ideal para mejorar los caracteres monogénicos, es decir, codificados por un solo gen, como algunos tipos de resistencias a herbicidas.[89]
- El proceso de modificación genética demora mucho menos que las técnicas tradicionales de mejoramiento por cruzamiento; la diferencia es de años, y frutos en meses.
- Nuevos materiales
Además de la innovación en materia alimentaria, la ingeniería genética permite obtener cualidades novedosas fuera de este ámbito; por ejemplo, por producción de plásticos biodegradables y biocombustibles.
Para los consumidores
- Posibilidad de incorporar características nutricionales distintas en los alimentos;
- Vacunas comestibles, por ejemplo: tomates con la vacuna de la hepatitis B;[90]
- Producción de nuevos alimentos;
- Lucha contra el hambre y la desnutrición;
- Alimentos con mayor cantidad de nutrientes o nuevos nutrientes, como el arroz dorado.
Para los agricultores
Mejoras agronómicas relativas a la metodología de producción y su rendimiento:
- Aumento en la productividad y la calidad de los cultivos. La productividad aumenta de media más de un 21 % y el beneficio neto para el agricultor más de un 68 %.[16][91][92]
- Resistencia a plagas y enfermedades conocidas; por ejemplo, por inclusión de toxinas bacterianas, como las de Bacillus thuringiensis, específicas contra determinadas familias de insectos,[93] que son mucho más específicos y menos agresivos con el medio ambiente que los pesticidas convencionales;
- Tolerancia a herbicidas (como el glifosato o el glufosinato), salinidad, fitoextracción en suelos metalíferos contaminados con metales pesados,[94] sequías y temperaturas extremas.[95]
- Rapidez: el proceso de modificación genética demora mucho menos que las técnicas tradicionales de mejora por cruzamiento, que requiere varias generaciones para eliminar otros genes que se introdujeron en el mismo cruzamiento.
Ventajas para el ambiente
Sus defensores alegan que algunas variedades transgénicas han permitido una simplificación en el uso de productos químicos, como en el caso del maíz Bt, donde el combate de plagas ya no requiere el uso de insecticidas químicos de mayor espectro y menor biodegradabilidad.[96]
Por otra parte, las plantas transgénicas que producen proteína Bt, por ejemplo, necesitan menos pesticidas, por lo que se reduciría la cantidad de pesticidas necesarios.[97][98][99] De media, los cultivos transgénicos necesitan un 37 % menos de pesticidas que los cultivos convencionales.[92]
Inconvenientes

El movimiento anti-transgénico esgrime varios argumentos para oponerse a los OGM:
Daños a la salud
- Los antitransgénicos argumentan que los herbicidas asociados a los OGM, como el roundup son tóxicos.[100]
- Consideran que no se han realizado estudios suficientes para garantizar la inocuidad de su consumo.
- Durante el proceso de ingeniería genética se usan genes que otorgan resistencia a antibióticos para identificar las células con la modificación deseada. Existe la preocupación de que dichos genes puedan ser transferidos a microorganismos, originando cepas resistentes a los antibióticos.
- La posibilidad de usar intensivamente insecticidas a los que son resistentes los transgénicos hace que se vean afectadas y dañadas las especies colindantes (no resistentes).
- Aunque no se ha observado, el movimiento anti-transgénico argumenta que los transgénicos pueden generar nuevas alergias.[101]
- Se ha acusado al algodón transgénico de la ola de suicidios de agricultores acaecida en la India. Sin embargo, dicha ola empezó antes de la introducción del algodón transgénico y no se ha demostrado que haya una relación.[102][103][104]
Impacto medioambiental
- Se teme que el uso de OGM resistentes a herbicidas produzcan como efecto secundario que los agricultores empleen una mayor cantidad de herbicida, afectando a las especies colindantes.
- Aunque el empleo de recombinantes para toxinas de Bacillus thuringiensis es, por definición, un método específico, se sigue temiendo que afecte a especies beneficiosas.
- La transferencia horizontal de genes a bacterias de la rizosfera, aunque posible, se considera un riesgo remoto.[105]
- El polen de las especies transgénicas puede fecundar a cultivos convencionales, obteniéndose híbridos y transformando a estos cultivos en transgénicos.
Para los agricultores
- Las semillas obtenidas tras la cosecha no pueden ser sembradas por estos tanto porque violaría los contratos que han firmado porque las semillas híbridas pierden vigor y, en consecuencia, deben ser reemplazadas todos los años.[106]
Impacto económico
- El mercado de semillas transgénicas está dominado por muy pocas compañías multinacionales, lo que provoca un grave riesgo de oligopolio. Este hecho se ve agravado por la alta inversión inicial necesaria para desarrollar una variedad nueva y la gran cantidad de problemas legales que se encuentran las pequeñas compañías en algunos países.
Legislación

Los cinco países que producen más del 95 % de OGM
Puntos naranja: solo cultivos experimentales.
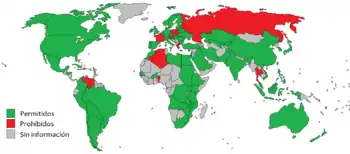
La Organización Mundial de la Salud dice al respecto:
Los diferentes organismos OGM incluyen genes diferentes insertados en formas diferentes. Esto significa que cada alimento GM y su inocuidad deben ser evaluados individualmente, y que no es posible hacer afirmaciones generales sobre la inocuidad de todos los alimentos GM. Los alimentos GM actualmente disponibles en el mercado internacional han pasado las evaluaciones de riesgo y no es probable que presenten riesgos para la salud humana. Además, no se han demostrado efectos sobre la salud humana como resultado del consumo de dichos alimentos por la población general en los países donde fueron aprobados. El uso continuo de evaluaciones de riesgo basándose en los principios del Codex y, donde corresponda, incluyendo el monitoreo post comercialización, debe formar la base para evaluar la inocuidad de los alimentos GM.[107]
En EE. UU.
La Administración de Fármacos y Alimentos estadounidense (FDA) aprobó en febrero de 2009 por primera vez el uso clínico de un primer medicamento obtenido usando animales genéticamente modificados. Se trata de ATryn, una forma recombinante de la hormona humana antitrombina, que se obtiene de la leche de cabras (Capra aegagrus hircus) modificadas genéticamente.[108][109] La droga, que previene la formación de coágulos sanguíneos en personas víctimas de deficiencia congénita de la hormona, ya había sido aprobada por la Unión Europea en 2006.[110]
En la Unión Europea
Según el cable 07PARIS4723 filtrado por wikileaks, el Departamento de Estado se muestra preocupado por el enfoque tomado por la Unión Europea y por el movimiento antitransgénico, que está intentando implementar procesos para evitar la toma de decisiones basadas en la evidencia científica.[111]
En España
En España la Ley 9/2003 de 25 de abril, por la que se establece el régimen jurídico de la utilización confinada, liberación voluntaria y comercialización de organismos modificados genéticamente, y por el Real Decreto 178/2004, de 30 de enero, por el que se aprueba el Reglamento General para el Desarrollo y Ejecución de dicha Ley, considera organismos genéticamente modificados los provenientes de las siguientes técnicas:
- Técnicas de recombinación del ácido nucleico, que incluyan la formación de combinaciones nuevas de material genético mediante la inserción de moléculas de ácido nucleico —obtenidas por cualquier medio fuera de un organismo— en un virus, plásmido bacteriano u otro sistema de vector y su incorporación a un organismo hospedador en el que no se encuentren de forma natural, pero puedan seguir reproduciéndose.
- Técnicas que suponen la incorporación directa en un organismo de material hereditario preparado fuera del organismo, incluidas la microinyección, la macroinyección y la microencapsulación.
- Técnicas de fusión de células (incluida la fusión de protoplastos) o de hibridación en las que se formen células vivas con combinaciones nuevas de material genético hereditario mediante la fusión de dos o más células utilizando métodos que no se producen naturalmente.
Se excluye por tanto a los procesos naturales (fertilización in Vitro, conjugación, transducción o transformación), así como a los métodos tradicionales como la mutagénesis o la fusión celular natural (poliploidías).
En Francia
Francia adoptó las leyes de la Unión Europea sobre transgénicos en 2007[112] siendo multada con 10 millones de euros por retrasar su aplicación durante 6 años.[113]
En febrero de 2008, el gobierno francés usó la cláusula de salvaguardia para prohibir el cultivo del maíz MON 810 después de que el senador Jean-François Le Grand, presidente de un comité formado para la evaluación de biotecnología dijera que había "serias dudas" sobre la seguridad del producto.[114] Doce científicos y dos economistas del comité acusaron a Le Grand de distorsionar el informe y aseguraron que no tenían "serias dudas", aunque quedaban por responder algunas preguntas sobre el impacto del maíz Bt en la salud y el ambiente.[115]
En septiembre de 2015, el gobierno francés anunció que continuaría prohibiendo el cultivo de plantas modificadas usando una provisión "opt-out", previamente acordada por los 28 miembros de la UE en marzo de 2015, y solicitaría a la Comisión Europea permiso para extender la prohibición a nueve cepas más de maíz. [116]
Rusia
En Rusia, no solo el cultivo, sino también la comercialización de productos elaborados con transgénicos está prohibida.[117]
En Perú
La Ley Nro. 29811, publicada el 9 de diciembre de 2011, establece una moratoria de 10 años que impide el ingreso y producción de organismos vivos modificados (OVM) con fines de cultivo o crianza, a ser liberados en el ambiente.[118]
Etiquetado de alimentos transgénicos
La polémica sobre los transgénicos también se traslada a la obligación o no de etiquetar los alimentos que contengan algún componente derivado de cultivos transgénicos. En este aspecto, la legislación varía según los países. En Estados Unidos y Canadá no es necesario este etiquetado,[119] pero sí en la Unión Europea, Japón, Ecuador, Malasia y Australia.[120][121] Este etiquetado requiere la separación de los componentes transgénicos y no transgénicos durante su producción, pero también durante el procesado subsiguiente, lo que exige un cuidadoso seguimiento de su trazabilidad.[120][121]
Véase también
Referencias
- «Petit glossaire OGM, INRA» (en francés). Archivado desde el original el 14 de septiembre de 2013. Consultado el 5 de enero de 2014.
- «Directive 2001/18/CE du Parlement européen et du Conseil du 12 mars 2001 relative à la dissémination volontaire d'organismes génétiquement modifiés dans l'environnement et abrogeant la directive 90/220/CEE du Conseil - Déclaration de la Commission» (en francés). Consultado el 5 de enero de 2014.
- «Genetically Engineered Foods» (en inglés). FDA. Consultado el 5 de enero de 2014.
- «Glossary of Agricultural Biotechnology Terms». Archivado desde el original el 9 de abril de 2010. Consultado el 5 de enero de 2014.
- Lee LY, Gelvin SB (February de 2008). «T-DNA binary vectors and systems». Plant Physiol. 146 (2): 325-332. OCLC 1642351. PMC 2245830. PMID 18250230. doi:10.1104/pp.107.113001.
- Park F (October de 2007). «Lentiviral vectors: are they the future of animal transgenesis?». Physiol. Genomics 31 (2): 159-173. OCLC 37367250. PMID 17684037. doi:10.1152/physiolgenomics.00069.2007.
- Jean-Paul Renard (28). [http://cerimes.cines.fr/3517/load/documents/utls/download/pdf/280100.pdf (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). «Texte de la 28ème conférence de l'Université de tous les savoirs, Le clonage»]. Centre Informatique National de l’Enseignement Supérieur. Consultado el 23 de abril de 2009. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- site de la Commission de l’éthique, de la science et de la technologie (Québec): «introduction» (enlace roto disponible en este archivo).; liste bibliographique
- «Case Study: The EU-US Dispute over Regulation of Genetically Modified Organisms, Plants, Feeds, and Foods» (en inglés). Consultado el 5 de enero de 2014.
- «Genetically Modified Food and Feed» (en inglés). Consultado el 5 de enero de 2014.
- Jaenisch, R. y Mintz, B. (1974) Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc. Natl. Acad. 71(4):1250–1254
- Gordon, J.; Ruddle, F. (1981). «Integration and stable germ line transmission of genes injected into mouse pronuclei». Science 214 (4526): 1244-6. Bibcode:1981Sci...214.1244G. PMID 6272397. doi:10.1126/science.6272397.
- Costantini, F.; Lacy, E. (1981). «Introduction of a rabbit β-globin gene into the mouse germ line». Nature 294 (5836): 92-4. Bibcode:1981Natur.294...92C. PMID 6945481. doi:10.1038/294092a0.
- Lemaux, P. (2008). «Genetically Engineered Plants and Foods: A Scientist's Analysis of the Issues (Part I)». Annual review of plant biology 59: 771-812. PMID 18284373. doi:10.1146/annurev.arplant.58.032806.103840.
- Bevan, M. W.; Flavell, R. B.; Chilton, M. D. (1983). «A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation». Nature 304 (5922): 184. doi:10.1038/304184a0.
- Focus on Yields. Biotech crops: evidence, outcomes and impacts 1996-2007. PG Economics. 2009. Consultado el 26 de agosto de 2013.
- données ISAAA 2011
- Rapport de l'Agence européenne pour l'environnement: «Late lessons from early warnings: science, precaution, innovation», (2013), p. 495.
- Vidal, John (8 de febrero de 2012). «Campaigners clash over industry claims of rise in GM crops». The Guardian (en inglés).
- Daniel G. Gibson, John I. Glass, Carole Lartigue, Vladimir N. Noskov, Ray-Yuan Chuang,Mikkel A. Algire, Gwynedd A. Benders, 2 Michael G. Montague, Li Ma, Monzia M. Moodie,Chuck Merryman, Sanjay Vashee, Radha Krishnakumar, Nacyra Assad-Garcia, Cynthia Andrews-Pfannkoch, Evgeniya A. Denisova, Lei Young, Zhi-Qing Qi, Thomas H. Segall-Shapiro, Christopher H. Calvey, Prashanth P. Parmar, Clyde A. Hutchison, III, Hamilton O. Smith, J. Craig Venter (20 de mayo de 2010). «Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome». Science (en inglés). doi:10.1126/science.1190719.
- Cécile Klingler (mayo de 2010). «Vers les premières bactéries synthétiques». La Recherche. Archivado desde el original el 24 de mayo de 2010. Consultado el 21 de mayo de 2010.
- Murray, Joo (20). Genetically modified animals. Canada: Brainwaving.
- Miller, Kenneth (2004). «3». Biología. Massachusetts: Prentice Hall. pp. p.332. ISBN 0-13-115538-5.
- Miller, Kenneth (2004). «3». Biología. Massachusetts: Prentice Hall. pp. p.331. ISBN 0-13-115538-5.
- Britt Erickson, 10 February 2009, for Chemical & Engineering News. FDA Approves Drug From Transgenic Goat Milk Accessed October 6, 2012
- «Hepatitis B Vaccine from Merck». Consultado el 9 de mayo de 2010.
- Cavazzana-Calvo M, Fischer A (June de 2007). «Gene therapy for severe combined immunodeficiency: are we there yet?». J. Clin. Invest. 117 (6): 1456-65. PMC 1878528. PMID 17549248. doi:10.1172/JCI30953.
- Richards, Sabrina (6 November 2012) «Gene Therapy Arrives in Europe.» The Scientist. Consultado el 15 de abril de 2013.
- Rosenecker J, Huth S, Rudolph C (October de 2006). «Gene therapy for cystic fibrosis lung disease: current status and future perspectives». Curr. Opin. Mol. Ther. 8 (5): 439-45. PMID 17078386.
- Persons DA, Nienhuis AW (July de 2003). «Gene therapy for the hemoglobin disorders». Curr. Hematol. Rep. 2 (4): 348-55. PMID 12901333.
- Lewitt, P. A.; Rezai, A. R.; Leehey, M. A.; Ojemann, S. G.; Flaherty, A. W.; Eskandar, E. N.; Kostyk, S. K.; Thomas, K.; Sarkar, A.; Siddiqui, M. S.; Tatter, S. B.; Schwalb, J. M.; Poston, K. L.; Henderson, J. M.; Kurlan, R. M.; Richard, I. H.; Van Meter, L.; Sapan, C. V.; During, M. J.; Kaplitt, M. G.; Feigin, A. (2011). «AAV2-GAD gene therapy for advanced Parkinson's disease: A double-blind, sham-surgery controlled, randomised trial.» The Lancet Neurology 10 (4): 309-319. doi:10.1016/S1474-4422(11)70039-4. PMID 21419704.
- Gallaher, James Gene therapy 'treats' Parkinson's disease BBC News Health, 17 March 2011. Retrieved 24 de abril de 2011
- Staff (13 February 2013) «Gene therapy cures diabetic dogs.» New Scientist. Consultado el 15 de febrero de 2013.
- Foster K, Foster H, Dickson JG (December de 2006). «Gene therapy progress and prospects: Duchenne muscular dystrophy». Gene Ther. 13 (24): 1677-85. PMID 17066097. doi:10.1038/sj.gt.3302877.
- Munson R, Davis LH (1992). «Germ-Line Gene Therapy and the Medical Imperative». Kennedy Institute of Ethic Journal 1 (2): 137-158.
- «International Law». The Genetics and Public Policy Center, Johns Hopkins University Berman Institute of Bioethics. 2010. Archivado desde el original el 2 de septiembre de 2014.
- Tripathi, S.; Suzuki, J. N. Y.; Ferreira, S. A.; Gonsalves, D. (2008). «Papaya ringspot virus-P: Characteristics, pathogenicity, sequence variability and control». Molecular Plant Pathology 9 (3): 269-280.
- «Papaya: A GMO success story». Hawaii Tribune-Herald. 10 de junio de 2013. Archivado desde el original el 10 de junio de 2015. Consultado el 29 de mayo de 2015.
- Weasel, Lisa H. 2009. Food Fray. Amacom Publishing.
- Miller, Kenneth (2004). «3». Biología. Massachusetts: Prentice Hall. pp. p.332. ISBN 0-13-115538-5.
- Case Study in GM Food Animals (en inglés)
- Gallagher, James «GM mosquitoes offer malaria hope.» BBC News, Health, 20 de abril de 2011. Consultado el 22 de abril de 2011
- Corby-Harris, V.; Drexler, A.; Watkins De Jong, L.; Antonova, Y.; Pakpour, N.; Ziegler, R.; Ramberg, F.; Lewis, E. E. et al. (2010). «Activation of Akt Signaling Reduces the Prevalence and Intensity of Malaria Parasite Infection and Lifespan in Anopheles stephensi Mosquitoes.» En Vernick, Kenneth D. PLoS Pathogens 6 (7): e1001003. doi:10.1371/journal.ppat.1001003. PMC 2904800. PMID 20664791.
- Windbichler, N.; Menichelli, M.; Papathanos, P. A.; Thyme, S. B.; Li, H.; Ulge, U. Y.; Hovde, B. T.; Baker, D. et al. (2011). «A synthetic homing endonuclease-based gene drive system in the human malaria mosquito.» Nature 473 (7346): 212-215. doi:10.1038/nature09937. PMC 3093433. PMID 21508956.
- World Health Organization, Malaria, Key Facts. Consultado el 22 de abril de 2011.
- Wise De Valdez, M. R.; Nimmo, D.; Betz, J.; Gong, H. -F.; James, A. A.; Alphey, L.; Black, W. C. (2011). «Genetic elimination of dengue vector mosquitoes.» Proceedings of the National Academy of Sciences 108 (12): 4772. doi:10.1073/pnas.1019295108
- Harris, A. F.; Nimmo, D.; McKemey, A. R.; Kelly, N.; Scaife, S.; Donnelly, C. A.; Beech, C.; Petrie, W. D. et al. (2011). «Field performance of engineered male mosquitoes.» Nature Biotechnology 29 (11): 1034-1037. doi:10.1038/nbt.2019. PMID 22037376.
- Staff (March 2011) Cayman demonstrates RIDL potential Archivado el 10 de noviembre de 2011 en Wayback Machine. Oxitec Newsletter, March 2011. Consultado el 20 de septiembre de 2011.
- Nicholls, Henry (14 September 2011) «Swarm troopers: Mutant armies waging war in the wild.» The New Scientist. Consultado el 20 de septiembre de 2011.
- Staff Pectinophora gossypiella (pink bollworm) OX1138 Oxitec. Retrieved 30 September 2011
- Doebley, John F.; et. al (2006). «The Molecular Genetics of Crop Domestication». Cell (Elsevier) 127 (7): 1309-1321. Consultado el 29 de abril de 2015.
- Gilbert, Scott F. (2013). «Evolution and Domestication: Selection on Developmental Genes?». Developmental Biology (10ª edición). Sinauer Associates Inc. ISBN 978-0-87893-978-7. Archivado desde el original el 26 de mayo de 2015. Consultado el 29 de abril de 2015.
- Ver argumentos a favor de la biotecnología y en contra de lo que consideran mitos de los grupos ambientalistas y proteccionistas agrícolas: La leyenda negra de los transgénicos y Mitos y realidades de los transgénicos
- Ver argumentos que se enfocan en lo negativo de la biotecnología actual y en contra de los que consideran ocultamiento de las empresas y científicos dedicados al ramo: Alimentos genéticamente modificados: ¿Son un riesgo para la salud animal o humana?, Contra los transgénicos Archivado el 30 de agosto de 2010 en Wayback Machine.
- Consenso Científico sobre los Cultivos Transgénicos y OMG. Este documento es un resumen fiel del destacado informe de consenso científico publicado en 2004 por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO): "El Estado Mundial de la Agricultura y la Alimentación 2003-2004". Elaborado por Green Facts
- «Depósito de documentos de la FAO». Consultado el 29 de abril de 2015.
- American Association for the Advancement of Science (AAAS), Board of Directors (2012). Legally Mandating GM Food Labels Could Mislead and Falsely Alarm Consumers Archivado el 4 de noviembre de 2013 en Wayback Machine.
- American Medical Association (2012). Report 2 of the Council on Science and Public Health: Labeling of Bioengineered Foods Archivado el 7 de septiembre de 2012 en Wayback Machine.
- World Health Organization. Food safety: 20 questions on genetically modified foods. Accessed December 22, 2012.
- United States Institute of Medicine and National Research Council (2004). Safety of Genetically Engineered Foods: Approaches to Assessing Unintended Health Effects. National Academies Press. Free full-text. National Academies Press. See pp11ff on need for better standards and tools to evaluate GM food.
- http://ec.europa.eu/research/biosociety/pdf/a_decade_of_eu-funded_gmo_research.pdf
- Other sources:
- Winter CK and Gallegos LK (2006). Safety of Genetically Engineered Food. Archivado el 12 de abril de 2015 en Wayback Machine. University of California Agriculture and Natural Resources Communications, Publication 8180.
- Ronald, Pamela (2011). «Plant Genetics, Sustainable Agriculture and Global Food Security». Genetics 188 (1): 11-20.
- Miller, Henry (2009). «A golden opportunity, squandered». Trends in biotechnology 27 (3): 129-130.
- Bett, Charles; Ouma, James Okuro; Groote, Hugo De (agosto de 2010). «Perspectives of gatekeepers in the Kenyan food industry towards genetically modified food». Food Policy 35 (4): 332-340. doi:10.1016/j.foodpol.2010.01.003.
- Li, Quan; Wahl, Thomas (2004). «Effects of information on consumers’ willingness to pay for GM-corn-fed beef». Journal of Agricultural and Food Industrial Organization 2 (2): 1-16.
- Dr. Christopher Preston, AgBioWorld 2011. Peer Reviewed Publications on the Safety of GM Foods.
- Key S, Ma JK, Drake PM (June de 2008). «Genetically modified plants and human health». J R Soc Med 101 (6): 290-8. PMC 2408621. PMID 18515776. doi:10.1258/jrsm.2008.070372.
- http://www.who.int/foodsafety/publications/biotech/20questions/en/
- Séralini, Gilles-Eric; Clair, Emilie; Mesnage, Robin; Gress, Steeve; Defarge, Nicolas; Malatesta, Manuela; Hennequin, Didier; De Vendômois, Joël Spiroux (2012). «Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize». Food and Chemical Toxicology 50 (11): 4221-31. PMID 22999595. doi:10.1016/j.fct.2012.08.005.
- «Institute of Science in Society: beware!». Dcscience.net. Consultado el 29 de mayo de 2015.
- The Independent Science Panel on GM Final Report
- «IRT» (en inglés). Archivado desde el original el 13 de diciembre de 2013. Consultado el 5 de enero de 2014.
- «Potential Health Hazards of Genetically Engineered Foods» (en inglés). Consultado el 5 de enero de 2014.
- «GMO genetic pollution alert: Genetically engineered wheat escapes experimental fields planted across 16 states Learn more: http://www.naturalnews.com/040541_gmo_genetic_pollution_ge_wheat.html##ixzz2pVTcFVRd» (en inglés). Consultado el 5 de enero de 2014.
- Paul J. Heald; James C. Smith. «THE PROBLEM OF SOCIAL COST IN A GENETICALLY MODIFIED AGE». THE UNIVERSITY OF MICHIGAN LAW SCHOOL (en inglés). Consultado el 5 de enero de 2014.
- «Health: Background Briefings Genetically modified food could pose unseen threat». BBC. 5 de junio de 1998. Consultado el 5 de enero de 2014.
- «Mounting Opposition to GMO Crops: The World’s People Reject Genetic Pollution of Food and the Environment» (en inglés). Consultado el 5 de enero de 2014.
- Shipitalo MJ, Malone RW, Owens LB (2008). «Impact of Glyphosate-Tolerant Soybean and Glufosinate-Tolerant Corn Production on Herbicide Losses in Surface Runoff». Journal of Environment Quality 37 (2): 401-8. PMID 18268303. doi:10.2134/jeq2006.0540.
- Shipitalo MJ, Malone RW, Owens LB (2008). «Impact of glyphosate-tolerant soybean and glufosinate-tolerant corn production on herbicide losses in surface runoff». J. Environ. Qual. 37 (2): 401-8. PMID 18268303. doi:10.2134/jeq2006.0540.
- Benbrook, CM (2012). «Impacts of genetically engineered crops on pesticide use in the U.S. -- the first sixteen years.». Environmental Sciences Europe 24 (24). doi:10.1186/2190-4715-24-24.
- Roh JY, Choi JY, Li MS, Jin BR, Je YH (April de 2007). «Bacillus thuringiensis as a specific, safe, and effective tool for insect pest control». J. Microbiol. Biotechnol. 17 (4): 547-59. PMID 18051264.
- Marvier M, McCreedy C, Regetz J, Kareiva P (June de 2007). «A meta-analysis of effects of Bt cotton and maize on nontarget invertebrates». Science 316 (5830): 1475-7. PMID 17556584. doi:10.1126/science.1139208.
- Brookes, Graham & Barfoot, Peter (2008) Global Impact of Biotech Crops: Socio-Economic and Environmental Effects, 1996-2006 Archivado el 3 de junio de 2018 en Wayback Machine. AgBioForum, Volume 11, Number 1, Article 3. Retrieved 12 August 2010
- Krishna, Vijesh V.; Qaim, Matin (2012). «Bt cotton and sustainability of pesticide reductions in India». Agricultural Systems 107: 47-55. doi:10.1016/j.agsy.2011.11.005.
- Carrington, Damien (13 June 2012) GM crops good for environment, study finds The Guardian. Retrieved 16 June 2012
- Lu y, W. K.; Wu, K.; Jiang, Y.; Guo, Y.; Desneux, N. «Widespread adoption of Bt cotton and insecticide decrease promotes biocontrol services». Nature 487 (7407): 362-365. doi:10.1038/nature11153.
- Parks, JR; Phipps, R. «Environmental benefits of genetically modified crops: Global and European perspectives on their ability to reduce pesticide use». Journal of Animal and Feed Sciences 11: 1-18.
- «Cotton in India». Monsanto. 5 de mayo de 2010.
- Bagla P (March de 2010). «India. Hardy cotton-munching pests are latest blow to GM crops». Science 327 (5972): 1439. PMID 20299559. doi:10.1126/science.327.5972.1439.
- Tabashnik BE, Gassmann AJ, Crowder DW, Carriére Y (February de 2008). «Insect resistance to Bt crops: evidence versus theory». Nat. Biotechnol. 26 (2): 199-202. PMID 18259177. doi:10.1038/nbt1382.
- Jack Kaskey for Bloomberg News Nov 16, 2012 DuPont-Dow Corn Defeated by Armyworms in Florida: Study
- Griffiths, J. F. A. et al. (2002). Genética. McGraw-Hill Interamericana. ISBN 84-486-0368-0.
- Agrios, G.N. (2005). Plant Pathology (5ª edición). Elsevier Academic Press. ISBN 0-12-044564-6.
- Xiao-Ming Lou (abril de 2007). «Expression of the human hepatitis B virus large surface antigen gene in transgenic tomato plants» (pdf). Clinical and Vaccine Immunology. 14 (4): 464-469. 1556-6811. Consultado el 11 de agosto de 2007.
- Sander J. Zwart,Wim G.M. Bastiaanssen. «Review of measured crop water productivity values for irrigated wheat, rice, cotton and maize». Agricultural Water Management 69 (2): 115-133.
- Wilhelm Klümper,Matin Qaim (Noviembre de 2014). «A Meta-Analysis of the Impacts of Genetically Modified Crops». Plos One 9 (11).
- E. Schnepfm et al. (1998). [Bacillus thuringiensis and its pesticidal crystal proteins «Bacillus thuringiensis and Its Pesticidal Crystal Proteins»]. Microbiology and Molecular Biology Reviews. 32 (3). ISSN 1098-5557.
- Mitch M. Lasat (1998). «Phytoextraction of toxic metals». Journal of Environmental Quality. 31. ISSN 1537-2537.
- Genti Kostandini,Bradford F. Mills,Steven Were Omamo,Stanley Wood. «Ex ante analysis of the benefits of transgenic drought tolerance research on cereal crops in low-income countries». Agricultural Economics 40 (4): 477-492.
- E. Schnepfm et al. (1998). «Bacillus thuringiensis and its pesticidal crystal proteins». Microbiology and Molecular Biology Reviews. 32 (3). ISSN 1098-5557.
- name="Morse">Morse, S.; Bennett, R.; Ismael, Y. (2004), «Why Bt cotton pays for small-scale producers in South Africa», Nature Biotechnology 22 (4): 379-380, consultado el 6 de mayo de 2009.
- Impact of Bt Cotton in China Carl Pray and Danmeng Ma Jikun Huang and Fangbin Qiao
- Genetically Engineered Crops for Pest Management in U.S. Agriculture Jorge Fernández-Cornejo and William McBride, with contributions from Cassandra Klotz-Ingram, Sharon Jans, and Nora Brooks Agricultural Economics Report No. (AER786) 28 pp, mayo de 2000
- «Health and Environmental Impacts of Monsanto's Roundup Pesticide». Organic Consumers Association (en inglés). Archivado desde el original el 10 de agosto de 2014. Consultado el 5 de noviembre de 2014.
- «Do GMOs Mean More Allergies?». GMO Compass (en inglés). Archivado desde el original el 24 de octubre de 2014. Consultado el 5 de noviembre de 2014.
- Abid, R. (1 de enero de 2013). «The myth of India’s ‘GM genocide’: Genetically modified cotton blamed for wave of farmer suicides». National Post. Consultado el 28 de junio de 2013.
- Ghosh, P. (2 de mayo de 2013). «India Losing 2,000 Farmers Every Single Day: A Tale Of A Rapidly Changing Society». International Business Times. Consultado el 28 de junio de 2013.
- Case studies: A hard look at GM crops. Nature. 1 de mayo de 2013.
- A.J. Conner, T.R. Glare, J.P. Nap: «The release of genetically modified crops into the environment», Plant journal, 2003.
- jobs. «India investigates Bt cotton claims : Nature News & Comment». Nature.com. doi:10.1038/nature.2012.10015. Consultado el 29 de mayo de 2015.
- OMS,. «20 preguntas sobre los alimentos genéticamente modificados». Archivado desde el original el 19 de agosto de 2007. Consultado el 11 de agosto de 2007.
- Environmental Assessment for tbe Bc6 rDNA Construct in GTC 155-92 Goats Expressing Recombinant Human Antitbrombin III (rbAT or ATRYN). Presentado por ante el Centro de Medicina veterinaria de FDA. 29 de enero de 2009. Revisado el 11 de febrero de 2009.
- FDA Approves Orphan Drug ATryn to Treat Rare Clotting Disorder. FDA News. U.S. Food and Drug Administration. Revisado el 6 de febrero de 2009.
- Informe público europeo de evaluación (EPAR): ATRYN. Resumen para el público general European Medicines Agency. EMEA/H/C/587.
- «Cable Viewer». Wikileaks.ch. 14 de diciembre de 2007. Archivado desde el original el 30 de mayo de 2015. Consultado el 29 de mayo de 2015.
- Sybille de La Hamaide (20 de marzo de 2007). «France adopts disputed EU laws on GMO crop growing». Reuters.
- Zoë Casey (9 de diciembre de 2008). «France fined over GM law».
- «AFP: French GM ban infuriates farmers, delights environmentalists». Afp.google.com. AFP. 8 de febrero de 2008. Archivado desde el original el 30 de diciembre de 2010. Consultado el 8 de marzo de 2010.
- GMO Compass. «Maize MON 810: France triggers safeguard clause». Archivado desde el original el 28 de septiembre de 2011.
- Sybille de La Hamaide, Gus Trompiz and Valerie Parent (17 de septiembre de 2015). «France bolsters ban on genetically modified crops».
- «Russia Completely Bans GMOs in Food Productionfechaacceso=23 de septiembre de 2015».
- Congreso de la República. Ley que establece la moratoria al ingreso y producción de organismos vivos modificados al territorio nacional por un período de 10 años.
- Trade barriers seen in EU label for bio-engineered ingredients. (Regulatory and Policy Trends). Business and the Environment 13.11 (Nov 2002): p14(1).
- northwestern.edu Archivado el 12 de enero de 2012 en Wayback Machine. Northwestern Journal of Technology and Intellectual Property Paper on: "Consumer Protection" Consumer Strategies and the European Market in Genetically Modified Foods Quote: The recent Trans Atlantic Consumer Dialogue (TACD) Statement on the WTO decision makes this clear: "clearly consumers' preference for non-GM food is the true engine of the market collapse for American crops." and For instance, Evenson notes that the politicization of GMOs is not merely a question of labeling as information, but unlabeled GM products as catalysts in the "globalization backlash."
- CBC Identifying genetically modified products. Quote: Yet as seen in this report from CBC's Marketplace, no such labeling law exists in Canada despite numerous surveys indicating up to 90 per cent of Canadians want mandatory labeling of GM food. Canada's leading national consumer group does not support mandatory labeling. It appeared to reverse its stance on December 3, 2003: http://www.consumer.ca/1626 Archivado el 2 de diciembre de 2009 en Wayback Machine.
Bibliografía
- Pratley, J. et at. 1996. Glyphosate resistance in annual ryegrass. Proc. Eleventh Ann. Conf. Grassld. Soc, NSW.
- Bergel, Salvador. 2001. "El principio precautorio y la transgénesis de las variedades vegetales" en: Bergel, Salvador, Alberto Díaz (org.). Biotecnología y Sociedad. Buenos Aires. Ciudad Argentina.
- Smith, J., Seeds of deception: exposing industry and government lies about the safety of the genetically engineered foods you're eating. 2nd. ed., Fairfield, Yes! Books, 2003. 290 pp.
Enlaces externos
 Wikiquote alberga frases célebres de o sobre Organismo genéticamente modificado.
Wikiquote alberga frases célebres de o sobre Organismo genéticamente modificado.- «Reglamento general para el desarrollo y ejecución de la ley 9/2003, de 25 de abril, por la que se establece el régimen jurídico de la utilización confinada, liberación voluntaria y comercialización de OGM». BOE.
- Evaluation of the EU legislative framework in the field of GM food and feed (pdf).
- ¿Qué dice la evidencia científica sobre la seguridad de los cultivos y alimentos transgénicos?
- Más de 240 instituciones científicas apoyan la seguridad y beneficios de los OGMs
- Glosario de biotecnología para la agricultura y la alimentación de la FAO Archivado el 2 de diciembre de 2011 en Wayback Machine.
- La Biotecnología Agrícola - informe de la FAO (2004).