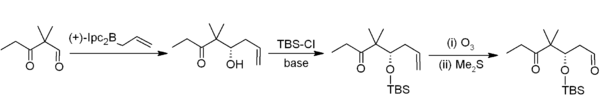Compuesto de organoboro
Los compuestos de organoboro u organoboranos son compuestos químicos orgánicos derivados del BH3, por ejemplo, los trialquilboranos. La química de los compuestos de organoboro o química de los organoboranos es la química de estos compuestos.[1][2] Estos compuestos son reactivos importantes en química orgánica que permiten muchas transformaciones químicas, la más importante de las cuales es la hidroboración.
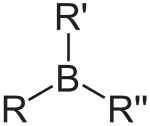
Propiedades
El enlace C-B es covalente y tiene una química baja (escasa diferencia de electronegatividad: 2,55 para el carbono y 2,04 para el boro) y por lo tanto, los compuestos alquílicos de boro son en general estables, aunque se oxidan fácilmente. Los grupos vinilo y los grupos arilo donan electrones y hacen menos electrofílico al boro y el enlace C-B gana algo de carácter de doble enlace. Al igual que el borano padre, el diborano, los organoboranos se clasifican en química orgánica como electrófilos fuertes, porque el boro no es capaz de completar un octeto de electrones. A diferencia del diborano sin embargo, los organoboranes no formandímeros.
Algunos boranos de interés son los carboranos, un grupo de compuestos de carbono y boro y el borabenceno, el equivalente con boro del benceno.
Compuestos de interés
Los organoboranos en los que el carbono es reemplazado por oxígeno son los ésteres borínicos, R2BOR, los ésteres bóricos, RB(OR)2, y los boratos, B(OR)3, como el trimetilborato. En química organometálica los compuestos con enlaces metal-boro se llaman borilos (M-BR2) o borilenos (M-B(R)-M).
Síntesis
A partir de reactivos de Grignard
Los organoboranos simples como el trietilborano o el tris(pentafluorofenil)borano pueden ser preparados a partir del trifluoroborano (como complejo de éter) y el reactivo de Grignard etilo o pentafluorofenilo.
A partir de alquenos
Los boranos reaccionan rápidamente con los alquenos en un proceso llamado hidroboración. Este concepto fue descubierto por Herbert Charles Brown en la Universidad de Purdue, trabajo por el que finalmente recibió el Premio Nobel (en colaboración con Georg Wittig por su descubrimiento de la reacción de Wittig). A pesar de que el diborano como compuesto puro es un dímero, el BH3 forma complejos 1:1 con disolventes básicos, por ejemplo THF. En una reacción de adición electrofílica ordinaria de un reactivo HX (donde X = Cl, Br, I, etc) la regla de Markovnikov establece que sea el átomo menos electronegativo, por lo general hidrógeno, el que se una al carbono menos sustituido del doble enlace, lo que determina regioselectividad. Con los boranos el modo de acción es el mismo, el hidrógeno se añade al carbono más sustituido porque el boro es menos electronegativo que el hidrógeno. La razón es que el boro es menos electronegativo que el hidrógeno. Cuando una carga positiva parcial se desarrolla en el alqueno lo hace en el átomo de carbono más sustituido, que es donde se añaden los átomos de hidrógeno con carga negativa parcial, dejando el átomo de carbono menos sustituido para el átomo de boro. La llamada adición de anti-Markovnikov es cuando el boro es reemplazado por un grupo hidroxilo en una reacción global de adición de agua al doble enlace en lo que parece ser una adición anti-Makovnikov.
Esto está más pronunciado cuando el compuesto de boro tiene sustituyentes muy voluminosos. Un reactivo de organoboro que a menudo se emplea en síntesis es el 9-borabiciclo[3.3.1]nonano o 9-BBN, que se genera a partir de la reacción de ciclooctadieno y diborano.[3] Las hidroboraciones tienen lugar estereoespecíficamente en modo syn, con los sustituyentes en la misma cara del alqueno. En esta reacción concertada el estado de transición se representa como un cuadrado con las esquinas ocupadas por carbono, carbono, hidrógeno y boro con el máximo solapamiento para los dos orbitales p de la olefina y el orbital del boro vacío.
Reacciones
Hidroboración-oxidación
En síntesis orgánica la reacción de hidroboración se usa además para generar otros grupos funcionales en el lugar del grupo boro. La reacción de hidroboración-oxidación ofrece una ruta de síntesis de alcoholes por oxidación del borano con peróxido de hidrógeno, o una oxidación más fuerte con óxido de cromo que genera funciones con grupo carbonilo.
Reordenamientos
Un segundo grupo de reacciones en las que están involucrados los compuestos de organoboro permite crear nuevos enlaces carbono-carbono. Se sabe que el monóxido de carbono reacciona muy fácilmente con un trialquilborano. A continuación se produce un 1,2-reordenación cuando un sustituyente alquilo del boro aniónico migra hacia el lado de carbono electrofílico del grupo carbonilo. El grupo carbonilo puede ser reducido a un grupo hidroxilo.
Alilboración
La alilboración asimétrica muestra otra aplicación útil de los organoboranos en la formación de enlaces carbono-carbono.[4] En este ejemplo de síntesis de Nicolau de las epotilonas,[5] la alilboración asimétrica (con un alilborano derivado de alfa-pineno quiral) se utiliza en conjunción con protección TBS y ozonólisis. En general, esto proporciona una secuencia de homologación de dos carbonos que ofrece la secuencia necesaria de acetogenina.
Transmetalación
Los compuestos de organoboro también se prestan a reacciones de transmetalación con compuestos de organopaladio. Este tipo de reacción se ejemplifica en la reacción de Suzuki.
Como agente reductor
Los hidruros de borano tales como 9-BBN y L-Selectride (tri-sec-butilborohidruro de litio) son agentes reductores. Un ejemplo de un catálisis asimétrica para la reducción de grupos carbonilo es la catálisis CBS. Esta catálisis también está basada en el boro, cuya finalidad es la coordinación con el átomo de oxígeno carbonílico.
Boratos
Los trialquilboranos, BR3, se pueden oxidar para dar los boratos correspondientes, B(OR)3. Un método para la determinación de la cantidad de enlaces C-B en por oxidación de R3B con óxido de trimetilamina (Me3NO) a B(OR)3. La trimetilamina (Me3N) formada puede entonces ser ajustada.
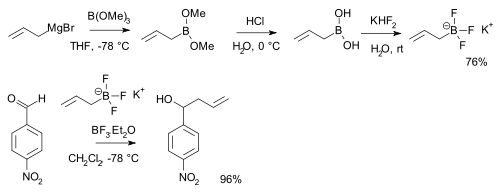
Los ácidos borónicos, RB(OH)2, reaccionan con bifluoruro de potasio, K[HF2] para formar sales trifluoroborato K[RBF3],[6] que son precursores de difluoruros de alquilboro y de arilboro nucleofílicos, ArBF2.[7] Las sales son más estables que los ácidos borónicos y se utilizan por ejemplo en la alquilación de ciertos aldehídos:[8][note 1]
Borillitio
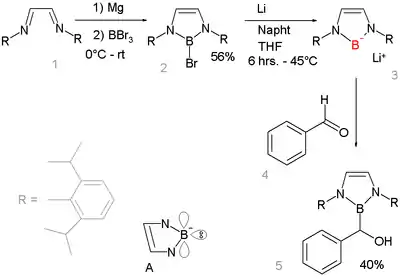
Los compuestos aniónicos de boro con carácter nucleofílico han sido difíciles de conseguir, pero un estudio de 2006 describe un compuesto de borillitio que reacciona como nucleófilo:[9][10]
Esto es notable porque otras sales de litio de elementos del período 2 son comunes, por ejemplo fluoruro de litio, hidróxido de litio, amida de litio y metillitio. Las reacciones de una base con un borohidruro R2BH no dan lugar a la desprotonación del anión borilo R2B-, sino a la formación del anión borilo R2B-H(base)+, ya que solo este camino de reacción proporciona un octeto completo.[11] En cambio, el compuesto de borilo se prepara por heterólisis reductiva de un enlace boro-bromuro con litio metálico. El nuevo compuesto de borillitio es muy similar e isoelectrónico con los carbenos N-heterocíclicos. Están diseñado para beneficiarse de la estabilización aromática (sistema de 6 electrones, contando los pares solitarios del nitrógeno y el orbital p vacío del boro, ver la estructura de A) y de la estabilización cinética de los voluminosos grupos 2,6-diisopropilfenilo. La difracción de rayos X confirma la hibridación sp2 en el boro y su reacción de adición nucleófila con benzaldehído da una prueba más de la estructura propuesta.
Alquilidenboranos
Los alquilidenboranos son compuestos del tipo RB=CRR con doble enlace boro - carbono y se forman muy raramente. Un ejemplo es el borabenceno. El compuesto principal es HB=CH2 que se puede detectar a bajas temperaturas. Un derivado bastante estable es CH3B=C(SiMe3)2, pero es propenso a ciclodimerización.[12]
Diborenos
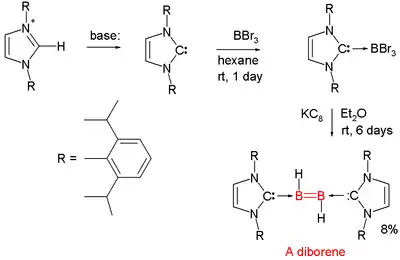
Los compuestos químicos con dobles enlaces boro - boro son raros. En 2007, se informó sobre el primer diboreno neutro (RHB=BHR).[13][14][15] Cada átomo de boro tiene un protón unido a él y cada átomo de boro se coordina a un carbeno denominado carbeno NHC.
Boroles
El compuesto cíclico borol, un análogo estructural del pirrol, no ha sido aislado, pero sus derivados sustituidos conocidos como boroles sí son conocidos.
Otros usos
El trietilborano (TEB) fue utilizado para encender el combustible JP-7 de los motores J58 de Pratt & Whitney que propulsan al Lockheed SR-71 Blackbird.
Notas
- Se muestra una secuencia de reacción a partir de la reacción de bromuro de alilmagnesio con trimetilborato, seguido por hidrólisis del éster borónico con ácido clorhídrico dando ácido borónico. El aldehído es p-nitrobenzaldehido.
Véase también
- Compuestos de carbono con otros elementos de la tabla periódica:
Enlaces químicos del carbono con el resto de átomos
| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
- The Roles of Boron and Silicon, Susan E. Thomas; Oxford Chemistry Primers No.1; 1991.
- Organometallics Christoph Elschenbroich 3rd Ed. 2006 ISBN 3-527-29390-6 – Wiley-VCH, Weinheim
- Advanced Organic Chemistry, F.A. carey, R.J. Sundberg ISBN 0-306-41088-5
- Lachance, H.; Hall, D. Org. React. 2008, 73, 1. (doi: 10.1002/0471264180.or073.01)
- Nicolaou, K.C.; Sarabia, F.; Ninkovic, S.; Finlay, M.R.V.; Boddy, C.N.C. (1998). «Probing The Ring Size Of Epothilones: Total Synthesis Of 14-, 15-, 17-, And 18 Epothilones A». Angewandte Chemie. International edition in English 37 (1–2): 81-84. Archivado desde el original el 14 de marzo de 2012. Consultado el 2 de marzo de 2008.
- Conversion of Arylboronic Acids into Potassium Aryltrifluoroborates: Convenient Precursors of Arylboron Difluoride Lewis Acids E. Vedejs, R. W. Chapman, S. C. Fields, S. Lin, M. R. Schrimpf J. Org. Chem. 1995; 60(10); 3020–3027. doi 10.1021/jo00115a016
- Organotrifluoroborates and Monocoordinated Palladium Complexes as Catalysts—A Perfect Combination for Suzuki–Miyaura Coupling Gary A. Molander and Belgin Canturk Angew. Chem. Int. Ed. 2009, 48, 9240 – 9261doi 10.1002/anie.200904306
- Organoboron compounds as mild nucleophiles in Lewis acid- and transition metal-catalyzed C–C bond-forming reactions Robert A. Batey, Tan D. Quach, Ming Shen, Avinash N. Thadani, David V. Smil, Sze-Wan Li, and D. Bruce MacKay Pure Appl. Chem., Vol. 74, No. 1, pp. 43–55, 2002. http://www.iupac.org/publications/pac/2002/pdf/7401x0043.pdf
- Boryllithium: Isolation, Characterization, and Reactivity as a Boryl Anion Yasutomo Segawa, Makoto Yamashita, Kyoko Nozaki Science 6 October 2006: Vol. 314. no. 5796, pp. 113 – 115 doi 10.1126/science.1131914
- Boron Attacks Electropositive element pressed into action as nucleophilic boryllithium Bethany Halford Chemical & Engineering News October 9, 2006 Volume 84, Number 41 p. 11 Link
- Boronic Acids: Preparation, Applications in Organic Synthesis and Medicine. Dennis G. Hall ISBN 3-527-30991-8
- Reactions at the Boron-Carbon Double Bond of Methyl(methylidene)boranes Peter Paetzold, Ulli Englert, Rudolf Finger, Thomas Schmitz, Alexander Tapper, and Ralf Ziembinski Z. Anorg. Allg. Chem. 2004, 630, 508–518 doi 10.1002/zaac.200300396
- A Stable Neutral Diborene Containing a BdB Double Bond Yuzhong Wang, Brandon Quillian, Pingrong Wei, Chaitanya S. Wannere, Yaoming Xie, R. Bruce King, Henry F. Schaefer, III, Paul v. R. Schleyer, and Gregory H. Robinson doi 10.1021/ja075932i
- Neutral Diborene Is A First Ron Dagani Chemical & Engineering News October 1, 2007 Volume 85, Number 40 p. 10
- El boro precursor es tribromuro de boro y el agente reductor es KC8 que extrae los protones necesarios del disolvente dietiléter.